
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Азокрасители. Ализариновый желтый
Курсовая работа: Азокрасители. Ализариновый желтый
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМ. Е.А. БУКЕТОВА
ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ И ПОЛИМЕРОВ
КУРСОВАЯ РАБОТА
На тему: Азокрасители. Ализариновый жёлтый.
Подготовил: ст.гр. ХТОВ- 32
Кадырбеков Р. А.
Проверил: Нурмагамбетова М. Т.
Караганды 2009
Содержание
Введение
I Общие сведения об азокрасителях
1.1 Общая характеристика
1.2 Деление азокрасителей по группам
1.3 Классификация азокрасителей
1.3.1 Классификация по способу применения
1.3.2 Классификация по химической структуре
1.3.3 Классификация Степанова Б. И
4. Крашение. Подготовка материалов.
II Синтез азокрасителя
2.1 Условия получения азокрасителя в лабораторных условиях
2.2 Диазотирование
2.3 Азосочетание
2.3.1 Механизм реакции
2.3.2 Условия проведения реакции
2.4 Выделение красителя
2.5 Синтез ализаринового жёлтого
Заключение
Список литературы
Введение
Области применения органических красителей очень многочисленны и разнообразны. Их применяют для окрашивания пряжи и ткани самого различного вида: льняных, шерстяных, хлопчатобумажных, шёлковых, из искусственных и синтетических волокон. Органическими красителями окрашивают кожу, мех, дерево, бумагу, различные виды пластмасс, резину, пищевые продукты и т.д. Органические красители используются для получения лакокрасочных материалов, художественных красок, цветных карандашей, типографских красок и чернил. И для окрашивания разных материалов нужны различные по свойствам органические красители. В настоящее время известно около 10000 видов синтетических красителей, и число их непрерывно растёт. Каждый год появляется большое число новых все более прочных, ярких и удобных в применении красителей, которые заменяют устаревшие. Отрасль химической промышленности, производящая органические красители и промежуточные продукты, необходимые для их производства, называется анилинокрасочной промышленностью. Название это сложилось исторически, так как первые синтетические красители были получены из анилина.
I. Общие сведения об азокрасителях
1.1 Общая характеристика
Красители — химические соединения, обладающие способностью интенсивно поглощать и преобразовывать энергию электромагнитного излучения в видимой и в ближних ультрафиолетовой и инфракрасной областях спектра и применяемые для придания этой способности другим телам. Само слово «краситель» происхождением своим обязано А. Е. Порай-Кошицу.
Отличительная особенность красителя — способность пропитывать окрашиваемый материал (например, текстиль, бумагу, мех, волосы, кожу, древесину, пищу) и давать цвет по всему его объёму.
Азокрасители органические соединения, содержащие одну или несколько азогрупп, например конго красный, метиловый оранжевый, β-нафтолоранж и другие. Азокрасители разнообразны по цвету, как правило, не очень стойки. Азокрасители — самый многочисленный класс синтетических красителей, применяют для крашения тканей, кожи, бумаги, резины, в лакокрасочной, полиграфической и других отраслях, в аналитической химии как индикатор. Органические красители, в молекулах которых содержится одна или несколько азогрупп —N=N—, связывающих ароматические радикалы. По числу этих групп различают моно-, дис-, трис- и полиазокрасители. Обычно азокрасители в ароматическом ядре содержат замещенные или незамещённые группы NH2 и OH, а также NO2, Cl, S03H, COOH и др. Кислотные группы обусловливают растворимость А. в воде.
Синтез азокрасителей основан на сочетании ароматических диазосоединений ArN2Cl с фенолами, ароматическими аминами или их производными, например:
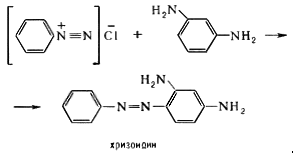
Простейшие моноазокрасители обычно окрашены в жёлтый, оранжевый или красный цвет. Увеличение числа азогрупп, замена фенильных радикалов нафтильными и увеличение числа окси- и аминогрупп приводят к углублению цвета.
1.2 Деление азокрасителей по группам
В зависимости от растворимости, химической природы и особенностей взаимодействия с окрашиваемыми материалами азокрасители делят на следующие группы:
1. Пигменты
(азопигменты) - главным образом. Моноазокрасители и дисазокрасители. (например,
I); не содержат кислотных (SO3H, COOH), основных [NH2,
(CH3)2N или др.], ониевых [(СН3)2![]() и др.] групп и поэтому не растворимы в воде; высокопрочные пигменты не
растворимы также в большинстве органических растворителей и пластмассах. Как
правило, молекулы пигментов содержат NO2, Cl, CH3, CH3O,
(C2H5)2NSO2 и др. заместители.
Иногда пигменты наносят на минеральные субстраты, напр. Аl(ОН)3,
BaSO4, мел, часто с добавками минеральных наполнителей для понижения
интенсивности окраски.
и др.] групп и поэтому не растворимы в воде; высокопрочные пигменты не
растворимы также в большинстве органических растворителей и пластмассах. Как
правило, молекулы пигментов содержат NO2, Cl, CH3, CH3O,
(C2H5)2NSO2 и др. заместители.
Иногда пигменты наносят на минеральные субстраты, напр. Аl(ОН)3,
BaSO4, мел, часто с добавками минеральных наполнителей для понижения
интенсивности окраски.
2. Жиро-, спирто- и ацетонорастворимые азокрасители (напр., II) по химическому строению аналогичны пигментам, но обычно не содержат NO2 и Cl; не растворимы в воде, хорошо растворимы в органических растворителях, моторных топливах, жирах, маслах и т.п.
3. Дисперсные азокрасители - обычно моноазокрасители; плохо растворимы в воде, растворимые в органических растворителях и полимерах.
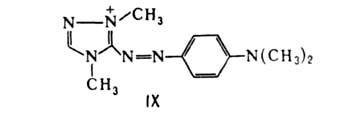
4. Основные и катионные азокрасители содержат в молекуле основные или ониевые группы, например красный азокраситель (IX); растворимый в воде с образованием цветных катионов.
5. Кислотные азокрасители- чаще всего моноазокрасители и дисазокрасители, содержащие одну или несколько групп SO3H, напр. красители формул III и IV; растворяются в воде с образованием цветных анионов.
6. Лаки (азолаки) - не растворимые в воде соли (обычно Ва или Са) некоторых кислотных азокрасителей. Применяются для тех же целей, что и пигменты.
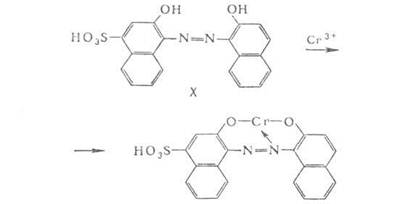
7. Хромовые (протравные) азокрасители характеризуются наличием групп SO3H (реже СООН), придающих растворимость в воде, и в орто-орто'-положениях к азогруппе - групп ОН, NH2 или СООН, которые при крашении могут образовывать с Сr3+ внутрикомплексные соединения; пример - хромовый сине-черный (X). В некоторых хромовых А. группы ОН и СООН содержатся в одном ароматическом ядре в орто-положении друг к другу. При крашении хромовыми азокрасители белковых волокон атом Сr связывает в комплекс молекулы азокрасителя и белка (например, кератина шерсти) по его функциональным группам (СООН, ОН, NH2), в результате чего возрастает устойчивость окрасок.
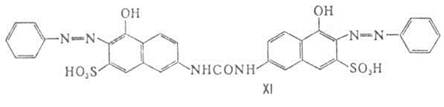
8. Прямые азокрасители - в основном дис- и полиазокрасители., например прямой ярко-оранжевый (XI). Обладают сродством к целлюлозным волокнам благодаря ван-дер-ваальсовому взаимодействию и водородным связям между группами красителя (ОН и NH2, атомы N гетероциклов и особенно NH—СО) и группами ОН целлюлозы.
9. Активные азокрасители обычно растворимы в воде; содержат группировки, которые при крашении вступают в химическую реакцию с молекулами субстрата, с образованием ковалентных связей, благодаря чему окраски устойчивы к мокрым обработкам и трению.
10. Азогены нерастворимые азокрасители, образующиеся непосредственно на волокне сочетанием диазосоединений с азосоставляющими.
11. Металлсодержащие азокрасители - внутрикомплексные соединения азокрасителя с Сu2+ , Сr3+ , Со3+, реже с Ni2 + и Fe2+. Исходные азокрасители содержат группировки, характерные для хромовых азокрасителей. По свойствам и способам применения относятся к кислотным, дисперсным, активным и прямым красителям. Окраски отличаются повышенной светостойкостью и другими ценными свойствами.
1.3 Классификация азокрасителей
Средства для окрашивания текстильных материалов можно классифицировать на красители и пигменты. Термины «краситель» и «пигмент», хотя их часто используют как равнозначные, обозначают четко различающиеся функции при окрашивании текстильных материалов. Краситель - это вещество, которое – по крайней мере на какой-то стадии обработки - обладает внутренним сродством к окрашиваемому материалу (притяжением к нему). Красители растворимы в красильной среде на некоторой стадии процесса крашения. Они проникают внутрь материала и образуют более или менее прочную связь с волокнами. Все текстильные красители - органические вещества.
Пигмент - это вещество, применяемое для придания окраски поверхности ткани. Пигменты не обладают внутренним сродством с текстильными материалами и удерживаются на них с помощью специальных химических препаратов. Пигменты могут быть как органическими, так и неорганическими веществами.
Красители можно классифицировать как по способу применения, так и по химической структуре. Технологи, занимающиеся крашением, классифицируют красители по способу применения. Специалисты-химики, занимающиеся синтезом красителей и изучающие взаимосвязи между структурой и свойствами веществ, классифицируют красители по химической структуре.
1.3.1 Классификация по способу применения
В текстильной промышленности обычно используются красители восьми основных классов. Первые пять классов красителей (прямые, сернистые, азоидные, реактивные и кубовые) используются в основном для крашения целлюлозных волокон, например хлопковых и вискозных. Последние три класса красителей (кислотные, основные и дисперсные) применяются для крашения других натуральных и синтетических волокон.
Прямые красители. Эти анионные водорастворимые красители называются так потому, что обладают высоким сродством к целлюлозным волокнам и могут применяться без вспомогательных химических средств. Однако на практике скорость крашения и интенсивность окраски могут быть увеличены добавками неорганических солей, например хлорида или сульфата натрия. Прямые красители широко используются для крашения хлопковых и вискозных тканей. Их наибольшее достоинство – простота применения, а недостаток в том, что в ряде случаев они неустойчивы к мокрым обработкам. Устойчивость прямых красителей к мокрым обработкам повышают введением закрепителей и с помощью различных технологических приемов.
Сернистые красители. Сернистые красители это органические соединения, получаемые нагревом соединений из группы аминов или фенолов в присутствии серы. Сернистые красители существуют в форме пигментов, не обладающих сродством к целлюлозе. В процессе обработки сернистыми красителями используются химические реакции восстановления и окисления. Путем восстановления сернистые красители переводятся в водорастворимую форму, обладающую сродством к целлюлозе. После их поглощения волокнами сернистые красители надо окислить для обратного преобразования в пигментную форму. Наибольшее достоинство сернистых красителей низкая стоимость. К недостаткам относятся невысокая яркость и, в некоторых применениях, низкая устойчивость к мокрым обработкам и воздействию света.
Азоидные красители. Эти красители синтезируются внутри волокон в ходе реакции двух компонентов, ни один из которых не является красителем. Поскольку один из компонентов – нафтол, азоидные красители иногда называют нафтоловыми. Вещество, образующееся при азоидном крашении, является пигментом. Однако азогены классифицируются как красители, потому что отдельные их компоненты действуют как таковые перед тем, как они прореагируют внутри волокна с образованием пигмента. Важное достоинство азоидных красителей состоит в том, что они обеспечивают дешевый способ получения оттенков некоторых цветов, особенно красного. Их недостаток – не всегда достаточная устойчивость к трению.
Реактивные красители. Реактивные красители, иногда называемые активными или волоконно-реактивными, разработаны в 1950-х годах. Реактивные красители образуют химическое соединение с волокном и становятся его частью. Поскольку связь между красителем и волокном прочна, реактивные красители очень устойчивы к мокрым обработкам, что является их основным достоинством. Реактивные красители, как правило, дороже прямых, сернистых и азоидных. Устойчивость реактивных красителей к воздействию хлора и других отбеливателей иногда бывает невысокой.
Кубовые красители. Эти красители похожи на сернистые в том отношении, что они являются пигментами, т.е. в процессе обработки сначала должны быть восстановлены, а потом окислены. На этом, однако, их сходство заканчивается. Кубовые красители обладают, как правило, очень высокой устойчивостью к мокрым обработкам и воздействию света; исключение составляет индиго. Большой недостаток кубовых красителей – высокая стоимость.
Кислотные красители. Кислотные красители называются так потому, что содержат в своей структуре кислотные группы. Кислотные группы красителя реагируют с основными группами белковых (шерсть и шелк) и полиамидных (найлон) волокон с образованием связей между красителем и волокном через органические солевые группы. Эти связи прочны и придают окраске высокую устойчивость к мокрым обработкам.
Основные красители. Эти красители иногда называют катионными, потому что молекула красителя содержит положительный заряд. Основные группы красителя реагируют с кислотными группами акриловых, полиэфирных и полиамидных волокон, поддающихся крашению катионными красителями, а также белковых волокон. При этом между красителем и волокнами образуются связи примерно таким же путем, как в реакциях между кислотными красителями и волокнами (см. выше). Недостаток основных красителей – низкая устойчивость окраски к свету, особенно для белковых волокон.
Дисперсные красители. Дисперсные красители используются в основном для крашения полиэфирных, полиамидных и ацетилцеллюлозных волокон, хотя они могут окрашивать и другие волокна. Дисперсные красители почти нерастворимы в воде и должны быть диспергированы в ней для образования красильной ванны. Эти красители были разработаны в 1920-х годах специально для крашения ацетилцеллюлозных волокон. Дисперсные красители – единственный вид красителей, пригодных для крашения ацетатных и немодифицированных полиэфирных волокон.
1.3.2 Классификация по химической структуре
В молекулах красителей присутствуют разнообразные структурные группы. Однако свыше половины всех красителей можно классифицировать как азокрасители или антрахиноновые красители.
Азокрасители. Азогруппы, т.е. два атома азота, соединенные двойной связью, обусловливают цвет свыше половины всех промышленно производимых красителей. Азогруппа -N=N- является сильным хромогеном (источником цвета), и поэтому азокрасители обычно обладают высокой красящей способностью. Молекулы азокрасителей могут содержать от одной до четырех, а иногда и больше азогрупп. Моноазокрасители (одна азогруппа) наиболее важны, дисазокрасители (две азогруппы) – вторые по значению. Азогруппы соединены с ароматическими ядрами, например бензолом или нафталином, которые в качестве заместителей могут содержать хлор и бром, а также нитро-, амино- и другие группы. Общая структурная формула моноазокрасителя может быть записана в виде A-N=N-B, где A и (или) B - ароматические ядра. Все азокрасители – синтетические соединения, не имеющие натуральных аналогов. Число теоретически возможных молекул с азогруппами чрезвычайно велико. Азокрасители характеризуются наличием в молекуле одной или нескольких азогрупп —N=N—, связывающих остатки ароматического или гетероароматического соединения друг с другом или с остатками соединений, имеющих активные СН2-группы. Молекулы содержат также электронодонорные заместители, например ОН, NH2, N(CH3)2, OCH3, NHCOCH3, чаще всего вместе с электроноакцепторными (NO2, CN, SO2CH3 и т.п.) и (или) атомами галогенов, реже - только электроноакцепторные. Получают азокрасители способами, общими для всех азосоединений, главным образом азосочетанием.
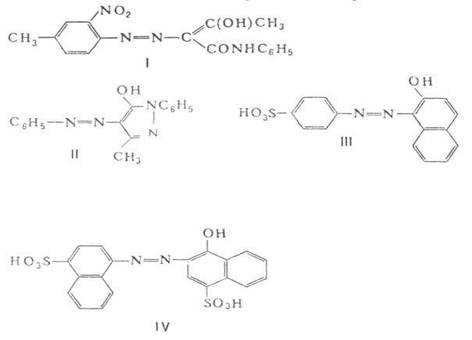
По числу азогрупп в
молекуле различают моно-, дис- и полиазокрасители. Цвет моноазокрасителя
определяется химическим строением связанных азогруппой остатков (различающихся
структурой и размерами![]() электронной
сопряженной системы), числом и положением в них заместителей. Наиболее
практически важные моноазокрасители, содержащие один электронодонорный
заместитель, имеют следующие цвета: желтый -производные
бензолазоацетоацетарилидов, пиразолоназобензола и азобензола, например, пигмент
желтый светопрочный формула I), жирорастворимый желтый 3 (II); оранжевый и
красный -производные соответственно нафталиназобензола и азонафталина, например
кислотный оранжевый (III) и кислотный красный 2С (IV). Углубление цвета
достигается увеличением
электронной
сопряженной системы), числом и положением в них заместителей. Наиболее
практически важные моноазокрасители, содержащие один электронодонорный
заместитель, имеют следующие цвета: желтый -производные
бензолазоацетоацетарилидов, пиразолоназобензола и азобензола, например, пигмент
желтый светопрочный формула I), жирорастворимый желтый 3 (II); оранжевый и
красный -производные соответственно нафталиназобензола и азонафталина, например
кислотный оранжевый (III) и кислотный красный 2С (IV). Углубление цвета
достигается увеличением![]() -электронной
системы и усилением ее поляризации следующими способами: заменой
электронодонорных заместителей на более сильные или введением дополнит.
заместителей (например, как в моноазокрасителях общей формулы V); введением
электроноакцепторных заместителей в остаток диазосоставляющей (VI); применением
в качестве диазосоставляющей аминов гетероциклического ряда. Моноазокрасители
общей формулы V могут иметь оранжево-красный (X = Н, R = Н), ярко-красный (X =
Н, R = = NHCOCH3), синевато-красный (X = Н, R = NH2),
красно-фиолетовый (X = CH3CONH, R = OH), фиолетовый (X = = NH2,
R = OH) и голубой [X = (CH3)2N, R = ОН] цвета;
моноазокрасители общей формулы VI - рубиновый (X = NH2) и фиолетовый
(X = NO2).
-электронной
системы и усилением ее поляризации следующими способами: заменой
электронодонорных заместителей на более сильные или введением дополнит.
заместителей (например, как в моноазокрасителях общей формулы V); введением
электроноакцепторных заместителей в остаток диазосоставляющей (VI); применением
в качестве диазосоставляющей аминов гетероциклического ряда. Моноазокрасители
общей формулы V могут иметь оранжево-красный (X = Н, R = Н), ярко-красный (X =
Н, R = = NHCOCH3), синевато-красный (X = Н, R = NH2),
красно-фиолетовый (X = CH3CONH, R = OH), фиолетовый (X = = NH2,
R = OH) и голубой [X = (CH3)2N, R = ОН] цвета;
моноазокрасители общей формулы VI - рубиновый (X = NH2) и фиолетовый
(X = NO2).
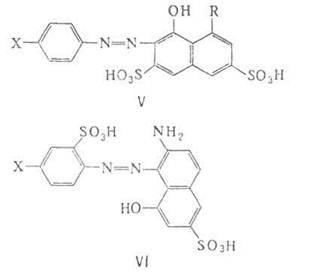
Цвет дис- и полиазокрасителей зависит также от наличия сопряжения между азогруппами. Возникновение единой сопряженной системы углубляет цвет по сравнению с цветом каждого моноазокрасителя, остаток которого входит в состав дис- и полиазокрасителя и который образован из тех же исходных компонентов, взятых в том же порядке, что и при получении последних, а также по сравнению с цветом смеси этих моноазокрасителей. Например, дисазокрасители (формула VII) - aлoгo цвета; моноазокрасители - желтого (VII, а; содержит в положении 4' группу NH2) и оранжевого (VII, о) цветов, смесь их - желто-оранжевого цвета. Обычно цвет полиазокрасителя углубляется при увеличении числа сопряженных азогрупп до 4; при большем числе азогрупп цвет повышается из-за нарушения плоскостности молекулы (увеличение углов поворота вокруг простых связей Аr—N при удлинении молекулы), приводящего к нарушению сопряжения.
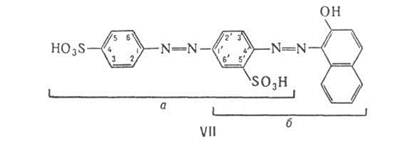
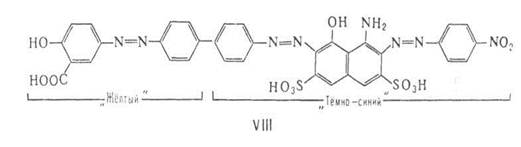
Во многих дис- и полиазокрасителях цепь сопряжения разорвана, например, как в красителях типа ArN=NAr'—X— —Ar"N=N—Аг'", где X = О, S, CH2, CONH и т.п. или отсутствует (поворот Аr' и Аr" делает молекулу неплоской). Части молекулы, разделенные фрагментом X, поглощают свет независимо друг от друга. Цвет таких красителей приблизительно соответствует цвету смеси азокрасителей, которые могли бы образоваться при разрыве молекулы по X. Например, полиазокраситель VIII окрашен в зелёный цвет, соответствующий смеси составляющих его жёлтого моноазокрасителя и тёмно-синего дисазокрасителя.
Антрахиноновые красители. По своему практическому значению антрахиноновые красители уступают только азокрасителям. Хотя антрахиноновые красители имеют более яркий цвет, чем азокрасители, они дороже их и слабее по красящей способности.
1.3.3 Классификация Б.И. Степанова
В последнее время Б. И. Степановым разработана новая классификация красителей, опирающаяся на признаки общности хромофорных систем красителей, а порядок чередования классов определяется последовательным усложнением хромофорных систем. По этой классификации все синтетические красители представлены в виде девятнадцати классов. Она удобна при изучении химии технологии красителей, но менее удобна для студентов, специализирующихся в области крашения и отделки волокнистых материалов. По сходству строения красителей, их химических свойств и методов применения все синтетические красители разделены на следующие классы.
Нитро- и нитрозокрасители.
Полиметиновые красители.
Арилметановые красители.
Хинониминовые красители.
Азокрасители.
Азометиновые красители.
Антрахиноновые красители.
Антрапиридиновые красители.
Кубовые красители.
9.1. Индигоидные и тиоиндигоидные красители.
9.2. Антрахиноновые и другие кубовые красители.
9.3. Периноновые красители.
9.4. Полициклохиноновые красители.
10. Сернистые красители.
11. Фталоцианиновые красители.
12. Флуоресцентные (оптические) отбеливатели.
1.4 Крашение. Подготовка материалов
Красители - химические соединения, используемые для придания окраски различным материалам, например текстилю, бумаге, мехам, волосам, коже и древесине. Крашение - процесс придания окраски таким материалам. Ежегодное мировое потребление красителей составляет около полумиллиона тонн; свыше двух третей этого количества идет на окраску текстильных материалов. В этой статье описываются красители для текстильных волокон и крашение текстильных материалов.
Качество крашения. Окраска - первейшее соображение, возникающее у потребителя при выборе ткани или другого изделия. Глаз человека способен обнаружить малые различия в окраске ткани, поэтому производитель ткани должен обеспечить равномерность (ровноту) ее окраски. Как правило, свойство равномерности гораздо важнее для окраски, чем для любого другого вида химической отделки. Например, если распределение мягчителя в ткани неравномерно, то потребитель этого не заметит, поскольку такая неравномерность не сказывается на свойствах ткани, важных для потребителя. С другой стороны, даже неискушенный наблюдатель заметит неравномерность окраски. Кроме того, важен контроль постоянства окраски при переходе от одной партии красителя к другой или в пределах одного куска ткани, поскольку различия в окраске соседних элементов швейного изделия проявятся почти неизбежно. Отсутствие метамеризма, т.е. свойства двух цветовых оттенков совпадать при освещении одним источником света и различаться при освещении другим источником, также должно учитываться при крашении материалов.

Компьютерное моделирование цвета
Устойчивость окраски определяет, насколько охотно будет пользоваться данным текстильным изделием потребитель. Окраска ткани должна сохраняться в течение срока службы изделия, но в некоторых случаях она может блекнуть, оставаясь приятной на вид. Важна также устойчивость окраски материала при мокрых обработках, стирке, химической чистке, трении, воздействии света, пота, атмосферных загрязнителей, погодных условий и других неблагоприятных факторов. Назначение конкретного текстильного изделия определяет требуемые степень, характер и устойчивость его окраски. Например, для обивки автомобильных сидений устойчивость окраски к химической чистке не так важна, как устойчивость к световому воздействию, которая имеет для нее первостепенное значение.
Ровнота окраски и ее устойчивость - главные факторы в выборе красителей и методов крашения для текстильных материалов. Для достижения приемлемых ровноты и устойчивости окраски надо учитывать такие переменные, как температура, давление, количества красителей и текстильно-вспомогательных веществ, а также свойства волокон.
II. Синтез азокрасителя
2.1 Условия получения азокрасителей в лабораторных условиях
В настоящее время группа азокрасителей включает самый большой и самый разнообразный ассортимент искусственных органических красителей. Основные условия получения азокрасителей в лабораторных условиях
1. Применение чистых исходных веществ.
2. Точное соблюдение относительных количеств реагирующих веществ.
3. Энергичное и постоянное перемешивание или встряхивание при проведении реакций диазотирования и сочетания.
4. Защита диазосоединений от нагревания и света. Применение диазосоединений непосредственно после их получения.
2.2 Диазотирование
Диазотирование протекает по уравнению:
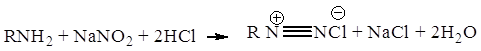
Одна свободная сульфогруппа замещает моль соляной кислоты например:
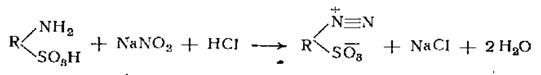
В то время как количество нитрита должно точно соответствовать теоретическому, кислоту всегда берут в избытке, а именно в лабораторных условиях, как правило, сверх 2 эквивалентов кислоты, требуемых по уравнению реакции, берут еще избыток 0.5 эквивалента. Для аминов. являющихся слабыми основаниями, соли которых сильно гидролизуются в воде (например, для хлор- и нитроанилинов) избыток кислоты повышают до 1—3 эквивалентов. В тех случаях, когда основание не растворяется даже в таком избытке кислоты, например, нитрохлоранилин, диазотирование проводят в суспензии, если основание имеется в виде тонкой дисперсной пасты; если же оно является сухим, то его можно перевести в пасту растворением в концентрированной серной кислоте, выливанием этого раствора в ледяную воду, отсасыванием и промыванием. Динитроанилины и нитродихлоранилины и другие аналогичные соединения не удается диазотировать этим методом; такие основания можно диазотироватъ лишь в концентрированной серной кислоте.
Сульфокислоты и карбоновые кислоты могут диазотироваться, как обычные амины, если они хорошо растворяются в воде в присутствии кислот. Во многих случаях, когда это условие не выполняется, рекомендуется подлежащие диазотированию кислоты в виде их солей со щелочными металлами растворить в воде, смешивать эти нейтральные растворы с нужным количеством раствора нитрита и смесь выливать при хорошей перемешивании в разбавленную соляную кислоту (обратное диазотирование); сульфокислота и азотистая кислота при этом одновременно переходят в свободное состояние и, как правило, успевают прореагировать друг с другом до того, как произойдет осаждение трудно растворимой кислоты. Однако если свободная сульфокислота очень трудно растворима — это имеет место именно в случае некоторых амино-азокрасителей, которые должны быть продиазотированы дальше с целью получения полиазокрасителей, то она выпадает раньше, чем может произойти ее диазотирование. Такую кислоту трудно продиазотировать до конца, особенно если диазосоединение практически нерастворимо. В таких особых случаях может оказать благоприятное действие применение значительного избытка нитрита и прибавление с самого начала небольшого количества нитрита к соляной кислоте. Кроме того, раствор сульфокислоты довольно сильно разбавляют и медленно прибавляют его при хорошем перемешивании в соляную кислоту, содержащую нитрит.
До окончании диазотирования диазосоединение отфильтровывают, благодаря чему удаляется избыток нитрита.
1,2- и 2,1-амнионафтолы и их сульфокислоты и другие производные не могут быть гладко продиазотированы ни по одному из описанных методов, так как они в кислом растворе окисляются азотистой кислотой в соответствующие хиноны. Однако диазотирование аминонафтолов в виде их солей с минеральными кислотами или сульфокислот аминонафтолов, содержащих одну свободную сульфогруппу, проходит безукоризненно, если обрабатывать эти соединения нитритом в отсутствие дополнительного количества кислоты и в присутствии либо эквивалентного количества цинковой соли, либо небольшого количества медной соли; в последнем случае надо по окончании диазотирования удалить медь, цинк же, в общем, не мешает.
Особое место занимают также те основания, которые, помимо первичной аминогруппы, содержат в молекуле также вторичную аминогруппу, как например моноэтил-п-фенилендиамин н особенно п-амино-дифениламин и его производные. Эти основания можно довольно гладко продиазотировать так, чтобы иминогруппа осталась незатронутой; однако образующиеся при этом диазосоединения очень медленно сочетаются и, хроме того, очень легко разлагаются. Поэтому поступают таким образом, что берут на 1 моль основания 2 моля нитрита. В этих условиях диазотируется первичная аминогруппа, а вторичная одновременно при этом нитрозируется. Эти нитрозированные диазосоединения гораздо легче вступают в реакцию азосочетания и обладают намного большей устойчивостью. После сочетания из готового красителя нитрозо-группу удаляют нагреванием с кислотой или с основанием либо слабыми восстановителями такими, как бисульфит (красители — вариамины).
Следует еще отметить, что концентрированная соляная кислота в присутствии нитрита выделяет хлор; это, естественно, может повлечь за собой образование побочных продуктов. Поэтому диазотируемая смесь но должна содержать более чем 20% -ную свободную HCI. При диазотировании в разбавленных кислых растворах нет надобности, как это часто рекомендуют, очень медленно прибавлять раствор нитрита. Для оснований, которые особенно склонны к образованию диазоаминосоединений или к сочетанию с самими собой, с целью избежаний таких побочных реакций даже лучше вес количество нитрита прибавить сразу. Необходимо только следить за тем, чтобы было достаточное охлаждение, которое достигается лучше всего прибавлением к тегирующему раствору льда.
2.3 Азосочетание
Взаимодействие диазосоединений с ароматическими аминами и фенолами, сопровождающееся образованием веществ, содержащих азогруппу —N = N—, связанную с двумя ароматическими радикалами, называют азосочетанием.
Диазосоединения получили название диазосоставляющих реакции азосочетания, а амины или фенолы азосоставляющей.
2.3.1 Механизм реакции
Установлено, что реакция азосочетания протекает по механизму электрофильного замещения, в котором атакующим агентом выступает ион диазония (Аг—N=N),а субстратом — ароматические системы, содержащие в п- или о-положении заместители NH2, NHAlk, NHAr, N(Alk)2, NHSO3H, NHNO2, ОН и в некоторых случаях OAlk:
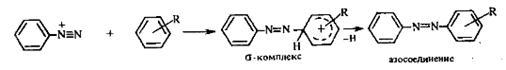
Вследствие небольшой активности ионов диазония реакция протекает направленно с образованием п- или о-изомеров. Электроноакцепторные заместители в диазониевом ионе повышают его реакционную способность, а электронодонорные группы понижают ее.
Азосоединения содержат наряду с хромофорной азогруппой ауксохромные группы азосоставляющей, вследствие чего они являются красителями.
2.3.2 Условия проведения реакций
Для осуществления реакции азосочетания готовят два компонента: диазосоединение и азосоставляющий реагент. Раствор диазосоединения получают с соблюдением всех правил (см. выше). Чрезвычайно важным фактором является рН среды. В зависимости от природы азосоставляющего компонента создают слабокислую среду для аминопроизводных и слабощелочную для соединений, содержащих гидрокси-, карбокси- и сульфогруппы. Этот прием необходим, чтобы перевести азокомпонент в раствор и, таким образом, провести сочетание в гомогенных условиях.
Как правило, для получения азосоединений охлажденный раствор соли диазония постепенно, при энергичном перемешивании, прибавляют к охлажденному раствору азокомпонента. Если диазосоединение нестабильно, порядок прибавления реагентов обратный.
Азосочетание часто проводят без охлаждения компонентов, особенно в тех случая, когда диазосоединение является стабильным и мало реакционноспособным, как, например, диазосоединения нафталина.
Для повышения скорости реакции сочетания на практике прибегают также к увеличению концентрации реагентов.
Реакцию сочетания осуществляют с таким расчетом, чтобы в реакционной смеси всегда был избыток азосоставляющей. За ходом этого процесса следят по пробе «на вытек». Ее проводят следующим образом: на фильтровальную бумагу наносят каплю реакционной массы, к которой добавляют раствор натриевой соли 2-нафтол-3,6-дисульфокислоты (R-соль). Отсутствие окраски (образования красителя) указывает на то, что условия сочетания выдержаны.
2.4 Выделение азокрасителей
Если краситель мелкодисперсный, то прибегают к высаливанию: в реакционную смесь добавляют хлорид натрия из расчета 200 г на 1 л раствора. Этот способ используется также и в том случае, когда краситель хорошо растворим. При наличии в азосоединениях солеобразных групп, придающих продукту хорошую растворимость в воде, для выделения красителя в реакционную смесь добавляют кислоту.
Меры предосторожности в работе такие же, как и в других синтезах с использованием кислот.
2.5 Синтез ализаринового (протравного) жёлтого
Реактивы для синтеза: м-нитроанилин 2,5 г., соляная кислота (ρ —1,19 г/см')— 10.1 г (8,5 мл); нитрит натрия— 1,5 г; салициловая кислота —2.5 г. ,карбонат натрия — 7,5 г; хлорид натрия, 10%-ный раствор.
Посуда и оборудование: стакан вместимостью 100 мл; стакан фарфоровый вместимостью 200 мл; воронка капельная; мешалка; термометр; баня ледяная.
В стакане растворили 2,5 м-нитроанилина в разбавленной соляной кислоте (8,5 мл концентрированной НС1 в 40 мл воды). Для полного растворения содержимое слегка нагревали. Охладив полученную смесь до 0°С, ее диазотировали, добавляя по каплям из капельной воронки раствор 1,5 г нитрита натрия в 5 мл воды. Следили за тем, чтобы температура не поднималась выше 5°С. Диазораствор при хорошем размешивании приливали к находящемуся в фарфоровом стакане при 0°С раствору 2,5 г салициловой кислоты и 7,5 г карбоната натрия в 40 мл воды. Жёлтый осадок красителя отфильтровали, слегка промыли 10%-ным раствором хлорида натрия и сушили при 40-50°С.
Химизм процесса состоит в следующем:
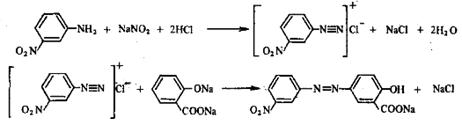
(C13H8N3Na05 ).
Выход 3,6 г (около 64% от теоретического).
Полученный нами краситель – ализариновый (протравный) жёлтый (З-карбокси-З'-нитро-гидроксиазобензол) — жёлтый азокраситель, в виде натриевой соли хорошо растворим в воде. Малорастворим в воде и 95 % спирте, легко растворим при нагревании.
Переход окраски раствора от светло-желтой к красно-оранжевой в интервале рН 10,0—12,0.
Раствор индикатора это 0,1 % раствор.
Приготавливают его путём растворения 0,1 г индикатора в 100 мл воды. Растворение проводят при нагревании на водяной бане.
Заключение
Синтетические красители заняли в мире современного человека пусть не самое важное, но значимое место. Ведь большинство изготовленных человеком предметов, которые мы – люди используем в повседневной жизни, или которые просто украшают наш интерьер, будут более приятны в эксплуатации, если им придать определённую окраску. Примерно за 150 лет были изучены их свойства, отработаны различные способы их получения, предложены интересные теории, объясняющие способность красителя нести и передавать свою неповторимую окраску.
На тему синтетических красителей сегодня имеется масса научной литературы, где можно найти всё: от истории развития до поставленных методик получения, причём объём той литературы постоянно пополняется; масса предприятий занимается выпуском красителей и крашением текстильных и других материалов, создавая столь необходимые на сегодняшний день рабочие места для наших современников и для нас.
Список литературы
1. Бородкин В. Ф. Химия красителей .—М.: Химия, 1981. — 248 с.
2. Г. Э. Фирц-Давид, Л. Бланже. Основные процессы синтеза красителей. —М.: Изд-во иностр. Литературы, 1957. —382 с.
3. Чекалин М. А., Пассет Б. В., Иоффе Б. А.Технология органических красителей и промежуточных продуктов: Учебное пособие для техникумов.— 2-е изд., перераб. —Л.: Химия, 1980. 472 с, ил.
4. Мельников Б. Н. Виноградова Г. И. Применение красителей. Учеб. для вузов — М.: Химия, 1986.— 240 с.
5. Ч. Дж. Овербергер, Ж-П. Анселм, Дж. Г. Ломбардино. Органические соединения со связями «азот —азот». — Л.:, Химия, 1970. — 128 с.
6. Орлова О. В., Фомичева Т. Н. Технология лаков и красок: Учебник для техникумов. М., Химия, 1990.— 384 с; ил.
7. www.roshimprom.ru
© 2009 База Рефератов