
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Азотная кислота
Курсовая работа: Азотная кислота
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет ______________________________
Кафедра________________________________
Курсовая работа
“Азотная кислота”
| Выполнил: | студент Х-Б-Г факультета | |
| Курс: | 1 | |
| Проверил: | Группа: | 16(2) |
| “_____”______________2001г. | Фамилия: | Лапшин Сергей |
Тверь
Содержание:
Содержание:...................................................................................... 2
Структура азотной кислоты............................................................. 3
Безводная азотная кислота............................................................... 3
Дымящая азотная кислота................................................................ 3
Строение кислоты с МВС................................................................. 3
Нитроний-ион.................................................................................... 4
Список литературы:.......................................................................... 7
Структура азотной кислоты
Азотная кислота имеет tпл.=–41,6ºC, tкип=–82,6ºC. Её плотность составляет 1,552 г/см3. С водой смешивается в любых соотношениях, образуя азеотроп (68,4% по массе HNO3 tкип=121,9ºC)
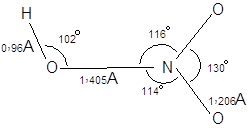 |
В газовой фазе молекула азотной имеет плоское строение. Вращение группы ОН относительно NO2 затруднено. В целом молекулу можно изобразить следующим образом: Безводная азотная кислота
Азотная кислота, не содержащая воды, является безводной. В ней протекают следующие равновесные процессы:
![]()
Чистая азотная кислота самоионизированна:
![]() ,
,
причем
мольная концентрация каждого вида частиц равна 0,51 моль/ л
при -10ºC. В твердом состоянии молекула кислоты представляет собой
гидроксид нитрония: ![]() .Интерес представляет собой взаимодействие азотной и
серной кислот:
.Интерес представляет собой взаимодействие азотной и
серной кислот:
![]() .
.
Отсюда видно, что азотная кислота амфотерна.
Дымящая азотная кислотаАзотную кислоту с концентрацией 97-99% часто называют дымящей. Дымящая азотная кислота при хранении разлагается:
![]()
![]()
Дымящая азотная кислота - сильный окислитель. Она способна поджечь скипидар и другие органические вещества.
Строение кислоты с МВСРассмотрим строение азотной кислоты с позиции метода валентных связей. Для этого посмотрим, какие орбитали принимают участие в образовании молекулы этой кислоты.
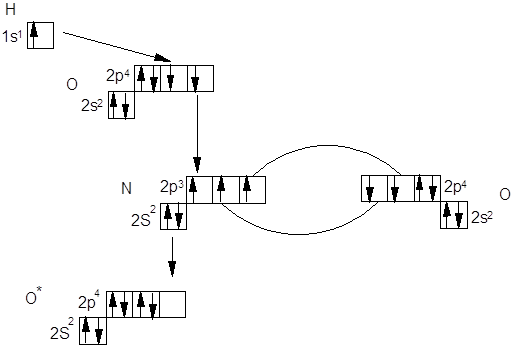
Таким образом азотную кислоту можно
представить в виде:
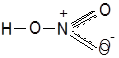 |
Однако современные методы исследования показали, что строение кислоты таково:
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи.
Нитроний-ионЭтот
ион ![]() непосредственно возникает
не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в
растворах окислов азота в этой кислоте и в других сильных кислотах.
непосредственно возникает
не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в
растворах окислов азота в этой кислоте и в других сильных кислотах.
Ранние физические измерения, выполненные известным ученым Ганчем, свидетельствовали об ионизации HNO3 в серной кислоте:
HNO3+2H2SO4=H3NO32++2HSO4-.
Поздние исследования, проведенные Хьюзом, Ингольдом и другими учеными, показали, что предложения Ганча не вполне верно. Так, скорость нитрования бензола возрастает в 1000 раз при переходе от 80%-ных к 90%-ным растворам H2SO4. Подобные кинетические данные по нитрованию в растворах серной кислоты, нитрометана, и ледяной уксусной кислоты были объяснены тем, что атакующей частицей является - ион:
![]()
![]()
![]()
Важность ионизации первого типа подтверждается тем, что добавление ионизированных нитратов к реакционной смеси замедляет реакцию. Процесс нитрования можно представить в виде:
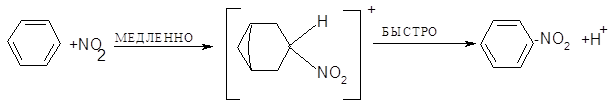
Окончательным подтверждением существования ионов нитрония явилось выделением солей нитрония. Соли содержат линейный катион:
Длина связи N-O составляет 110 пм. Выделение солей нитрония происходит следующим образом:
|
|
(1) |
|
|
(2) |
|
|
(3) |
Реакции
(1) и (2) представляют собой, в действительности, просто реакции обмена,
поскольку N2O5 в
твердом состоянии и в растворе безводных кислот существуют в виде ионов ![]() и
и ![]() . Реакция (3) представляет
собой реакцию ангидрида кислоты
. Реакция (3) представляет
собой реакцию ангидрида кислоты ![]() c
основанием
c
основанием ![]() .
.
Соли
нитрония - кристаллические вещества, термодинамически устойчивы,
но химически очень активны. Они быстро гидролизуются влагой воздуха; кроме
того, ![]() , например, бурно реагирует
с органическими веществами, однако в растворе нитробензола его можно использовать
для нитрования.
, например, бурно реагирует
с органическими веществами, однако в растворе нитробензола его можно использовать
для нитрования.
Соединения, содержащие нитроний-ион являются промежуточными соединениями при нитровании ароматических веществ.
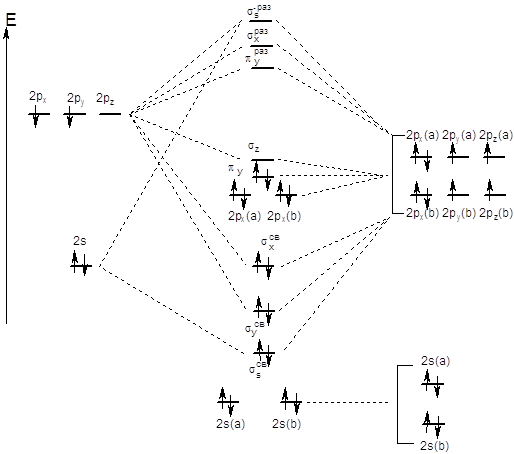
С метода молекулярных орбиталей нитроний-ион
выглядит так:
Список литературы:
1. Ахметов Н.С. Неорганическая химия. М.:Высшая школа 1975.
2. Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия1994
3. Коттон Ф. Уилкинсон Дж. Современная неорганическая химия. том.2. М.: Мир.1969.
4. Реми Г. Курс неорганической химии. том 1. М.: Мир.1972.
5. Общая химия./Под редакцией Соколовской Е.М. и Гузея Л.С. М.: Московский университет.1989.
6. Химический энциклопедический словарь/ редакцией И.Л.Кнунянца. М.: Московская энциклопедия. 1983.
© 2009 База Рефератов