
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Извлечение кремнефтористоводородной кислоты при процессе производства фосфорной кислоты
Реферат: Извлечение кремнефтористоводородной кислоты при процессе производства фосфорной кислоты
ВВЕДЕНИЕ
В процессе производства концентрированных фосфатных удобрений фосфорсодержащая руда подвергается экстракции раствором серной кислоты. Полученная разбавленная фосфорная кислота концентрируется упариванием и затем используется для получения концентрированных жидких и гранулированных фосфорсодержащих удобрений. В процессе экстракции фосфорной кислоты из руды серной кислотой образуется фтористый водород. При наличии диоксида кремния образуется кремнефто-ристоводородная кислота. Данная курсовая работа посвящена изучению способов переработки и извлечения из отходов ценных элементов.
Глава 1. ПРОИЗВОДСТВО ЭКСТРАКЦИОННОЙ ФОСФОРНОЙ КИСЛОТЫ
Производство экстракционной фосфорной кислоты (ЭФК) является одним из наиболее крупнотоннажных среди производств основной химической промышленности. Основная доля производимой фосфорной кислоты приходится на дигидратный метод, позволяющий получать в зависимости от качества перерабатываемого сырья кислоту с содержанием 22-32% Р2О5. Диготратный способ отличается сравнительно мягким температурно-концентрационным технологическим режимом, прост и дает выход Р2О5 в продукционную кислоту. В то же время относительно низкая концентрация получаемой кислоты требует последующей ее упарки до 40-50% Р2О5.
Дигидратный метод относится к наиболее разработанным в промышленной практике. Его совершенствование идет в основном по пути принятия новых аппаратурных решений, направленных на интенсификацию процесса, оптимизацию и стабилизацию температурного режима. Стремление получать более концентрированную ЭФК уже в технологическом цикле ее производства, т.е. без специального упаривания, выразилось в разработке и промышленной реализации полугидратного процесса [1]. Прямой полугидратный процесс в традиционном варианте характеризуется технических сложностей, связанных с повышенной температурой, выделением фтористых газов, а также более низким выходом Р2О5 в кислоту, чем в дигидратном методе. Это обстоятельство, влияющее на высокую интенсивность процесса и сравнительно низкие капитальные вложения, несколько затормозило распространение полугидратного метода. На практике полугидратным методом получают кислоту с содержанием Р2О5 от 36 до 45%.
Полугидратный процесс более чувствителен к отклонениям технологического режима, так как осуществляется в более узких, чем полугидратный процесс, интервалах температуры и концентраций Р2О5, СаО, SО3 в жидкой фазе. Поэтому очень ванным условием стабильной и эффективной работы полугидратных систем является оснащение их надежной системой контроля и автоматического регулирования, применения АСУТП.
Отходами в производстве ЭФК являются газообразные соединения фтора, а также сульфат кальция в виде дигидрата (фосфогипс) или полугидрата (фосфополугидрат). Фтор в дигидратном процессе выделяется в газовую фазу преимущественно в виде SiF4, в полугидратном процессе помимо SiF4 газовая фаза содержит НF.
Вопросы улавливания и утилизации фтора в производстве ЭФК нашли свое рациональное решение путем водной абсорбции фтористых газов и используемой получаемой таким образом фторкремниевой кислоты для производства фторсодержащих солей.
Более сложной остается проблема утилизации фосфогипса. Его выход на 1 т Р2О5 в фосфорной кислоте в дигидратном процессе колеблется от 2 до 6% в зависимости от содержания кальция в фосфатном сырье, в случае полугидратного процесса эта величина для апатитового концентрата равна 3,7%.
К основным направлениям использования фосфогипса относятся.
- химическая мелиорация солончаковых почв;
- производство вяжущих для строительства;
- термическая регенерация серной кислоты и производство цемента;
- конверсионное получение сульфата аммония.
Из указанных направлений наиболее целесообразными являются второе и особенно третье, связанное с получением серной кислоты, используемой вновь для разложения фосфатного сырья. Внедрение в промышленную практику комбинированных методов показало вполне очевидную тенденцию в производстве ЭФК на достижение максимального Р2О5 выхода в кислоту с одновременным получением по возможности более чистого фосфата кальция, имея ввиду его дальнейшую утилизацию.
Однако комбинированная технология часто отличается значительным увеличением продолжительности процесса или существенным усложнением технологической схемы (процессы с двойной фильтрацией) [1].
В настоящее время накопились многочисленные и всесторонние данные о свойствах модифицированных фосфорнокислых растворов и поведении в них кристаллогидратов сульфата кальция, а также сведения о селективном растворении составных частей фосфатного сырья. Они послужили основанием различных предложенных способов экстракции фосфорной кислоты из апатитового концентрата и фосфоритов Каратау в сочетании с последующим ее использованием, или с предварительным обезмагниванием бедных доломитизированных фосфоритов для кислотной переработки.
В настоящее время существует два способа получения фосфорной кислоты: полугидратный и дигидратный способы.
Полугидратным методом получают кислоту, содержащую 35-48% Р2О5. Это позволяет увеличить мощность действующих цехов в 1,3-1,5 раза и несколько уменьшить количество отхода - сульфатного остатка.
В значительной мере успехи, достигнутые в области изучения и освоения полугидратного метода, основаны на технических усовершенствованиях и достижениях производства экстракционной фосфорной кислоты дигидратным методом.
Оба процесса протекают с выделением твердых фаз - дигидрата и полугидрата сульфата кальция в метастабильном состоянии, но резко отличающихся по своей растворимости, устойчивости, размерам и форме кристаллов.
Успешное осуществление процесса полугидратным методом возможно при выделении достаточно стабильных кристаллов полугидрата, обеспечивающих максимально полное отделение фосфорной кислоты от осадка и не гидратирующихся в процессе промывки водой на фильтре и при дальнейшей транспортировке и хранении.
Температурные условия процесса зависят от концентрации получаемой кислоты и в области метастабильното существования полугидрата в системе CaSO4×Н3РО4×Н2О заключены в относительно небольших пределах. При концентрации кислоты от 35 до 50% Р2О5 верхний диапазон температур изменяется от 10 до 90°С. Нижний диапазон, начиная с 70°С, не представляет практического интереса, особенно при содержании в кислоте более 37-40% Р2О5 вследствие малой скорости реакции и затруднений, связанных с отделением осадка от кис лоты большой вязкости.
При малой растворимости и медленном растворении полугидрата последний долго дегидратируется и при 115-125°С в концентрированной фосфорной кислоте.
Присутствие в растворе 0,5-0,6% фтористых и кремнефтористых соединений приводит к резкому уменьшению размеров кристаллов и замедлению фильтрования в 2 раза. Увеличение содержания фтористых соединений до 1% замедляет фильтрование в 5 раз. Появление кристаллов полугидрата игольчатой формы вызвано торможением роста граней призмы при быстром росте вершинных граней вследствие избирательной адсорбции примеси на гранях растущего кристалла. Но совместное присутствие в растворе примесей соединений алюминия и ионов фтора вызывает (при содержании до 2% А12О3 и 0,4-0,5% F) образование, более изометричных кристаллов с лучшими фильтрующимися свойствами, чем в отсутствие примесей. Полное превращение полугидрата в гипс в растворах, содержащих 10-18% Р2О5, завершается в течение 1 ч. При содержании в кислоте 25% P2O5 фазовый переход заканчивается в течение 1,5-2 ч [3].
Скорость гидратации полугидрата в значительной степени зависит и от условий его получения. Чем выше концентрация фосфорной кислоты, в которой происходило выделение полугидрата, тем медленнее происходит его оводнение в разбавленных растворах.
В России освоено и налажено в промышленных масштабах производство полугидратным методом фосфорной кислоты концентрации 45-48 и 35-38% Р2О5. Кислоту концентрации 45-48% Р2О5 в небольших масштабах производят по способу, разработанному в НТИ им. Ленсовета совместно с Винницким химическим комбинатом и ЛенНИИГипрохимом. В основе способа получения 35-38%-ной кислоты на типовых промышленных установках лежат разработки, проведенные в НИУИФе, ЛенНИИГипрохиме, Воскресенском ПО «Минудобрение», на Красноуральском медеплавильном комбинате и др.
По способу, предложенному в ВИУИФе, апатитовый концентрат разлагают смесью 92-93%-ной H2SO4 и оборотной концентрированной фосфорной кислоты при 94-95°С с получением кислоты, содержащей 43-48% Р2О5 и 0,7-1,3% SO3. Процесс протекает при интенсивном выделении фторсодержащих газообразных соединений (более 50% от общего содержания в сырье) и степени разложения апатита, равной 97,5%).
В настоящее время фосфорную кислоту концентрации 35-37% Р2О5 из апатитового концентрата полугидратным методом по способу НИУИФа и Воскресенского ПО «Минудобрения» получают на ряде предприятий. Для предварительного смешения серной и фосфорной кислот применяют высокоскоростной смеситель конструкции Воскресенского ПО «Минудобрения» и НИИХиммаша. Он представляет собой аппарат типа «труба в трубе», выполненный из нержавеющей стали. Во внутреннюю трубу сверху подают разбавленную охлажденную серную кислоту с температурой не более 60°С, которая распределяется форсункой, помещенной на конце трубы. В наружную трубу тангенциально подводят оборотную фосфорную кислоту. Кислоты смешиваются на выходе из трубы над поверхностью пульпы; в экстракторе.
Процесс ведут преимущественно с применением цилиндрических, реакторов. Прямоугольные железобетонные экстракторы с рабочим объемом 740 м3 с годовой производительностью 140 тыс.т Р2О5 представляют большие затруднения в эксплуатации. Экстрактор разделен внутри перегородками на восемь рабочих секций и две дополнительных, изнутри покрыт антикоррозионной защитой. Крышка экстрактора защищена листом из нержавеющей стали.
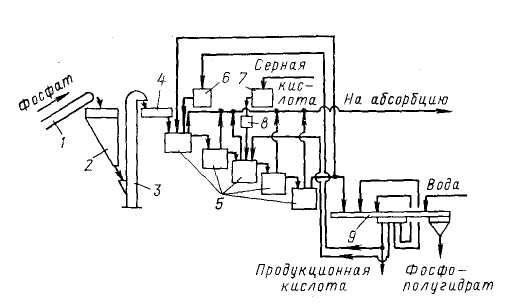
Технологическая схема: 1 – ленточный конвейер; 2 – бункер; 3 – элеватор; 4 – весовой дозатор; 5 – экстракторы с мешалками; 6,7 – напорные баки; 8 – щелевой расходомер; 9 – карусельный вакуум-фильтр
В полугидратном процессе фосфатное сырье, фосфорная кислота и ретурная пульпа попадают в первый из двух каскадно расположенных реакторов 5 первой монокальцийфосфатной стадии процесса. В двух реакторах этой стадии при температуре 90-95°С в течение 1,2-1,7 ч фосфат разлагается 3,5-4,0 кратным (в расчете на образование Са(Н3РО4)2) избытком фосфорной кислоты. По истечении указанного времени на выходе из второго реактора коэффициент разложения фосфата достигает 98-99%.
В последующих трех реакторах 5 происходит экстракция фосфорной кислоты при взаимодействии вводимой в третий реактор серной кислоты и находящегося в пульпе монокальцийфосфата в присутствии второго фильтрата, поступающего с фильтра. Процесс идет очень быстро при температуре 95-100°С и при отсутствии в жидкой фазе свободной серной кислоты. Применение определенных способов подачи реагентов, способствующих минимизации возникающих в объеме реакционной пульпы градиентов температуры и концентраций, обеспечивает также минимальные значения величин пресыщения жидкой фазы по сульфату кальция. Такие меры позволяют выделять полугидрат в виде изометричных, близких к сферической форме кристаллов, сросшихся в агрегата диаметром до 100 мкм.
Пульпа, содержащая в жидкой фазе 45-50% Р2О5, делится на два потока: один (2/3 пульпы) возвращают в экстрактор, а второй (1/3 пульпы) направляют на разделение на карусельном вакуум-фильтре 9. Продукционную кислоту частично возвращают в процесс, осадок фосфополугидрата промывают водой противотоком.
Глава 2. ПЕРЕРАБОТКА ОТХОДОВ, ОБРАЗУЮЩИХСЯ В ПРОЦЕССЕ ПОЛУЧЕНИЯ ФОСФОРНОЙ КИСЛОТЫ
Переработка фосфогипса. Фосфогипс образуется как отход в производстве фосфорной кислоты из природных фосфатов. При разложении фосфатов серной кислотой в раствор переходит фосфорная кислота и образуется труднорастворимый сульфат кальция (фосфогипс):
Ca5F(PO4)3 + 5H2SO4 = 5CaSO4 + 3H3PO4 + HF
В зависимости от температуры и концентрации получаемой кислоты сульфат кальция выделяется в форме дигидрата CaSO4 • 2H2O (гипс), полугидрата CaSO4 1/2Н2О или безводной соли CaSO4 (ангидрит). При получении экстракционной фосфорной кислоты дигидратным способом образуется 7,5-8,4 т влажного фосфогипса в пересчете на дигидрат. Фосфогипс (в пересчете на сухое вещество) содержит до 94% CaSO4, а также в виде примесей неразложившийся фосфат, неотмытую фосфорную кислоту, полуторные оксиды, соединения стронция, различные микропримеси (редкоземельные элементы, Mo, Co, Mn, Zn), соединения фтора.
Основными примесями, препятствующими прямому использованию фосфогипса вместо природного гипса в строительстве, являются соединения фтора и Р2Од. В России и странах СНГ в настоящее время в отвалах находится более 40 млн. т фосфогипса и ежегодно образуется около 10 млн. т этого отхода. Фосфогипс помимо загрязнения окружающей среды наносит большой экономический ущерб, поскольку до 10% себестоимости фосфорной кислоты приходится на затраты по его транспортировке и хранению. Шламохранилища занимают огромные площади земель, необходимых сельскому хозяйству.
В нашей стране и за рубежом разработано несколько направлений использования фосфогипса, ниже приводится их экономическая эффективность в расчете на 1 т отхода:
| Область использования | Экономический эффект, руб/т |
| Производство гипсовых вяжущих | +3,5 |
| Производство портланд цемента (в качестве добавок) | +2,5 |
| Производство серной кислоты и цемента | -8,6 |
| Производство серной кислоты и извести | -6,6 |
| Производство сульфата аммония | -22,2 |
| Сельское хозяйство | +6,4 |
Процесс получения гипсовых вяжущих из фосфогипса обычно состоит из двух стадий: очистка фосфогипса от соединений фтора и фосфора и последующая дегидратация CaSO4 2Н2О до CaSO4 • 1/2H2О. Дегидратацию осуществляют путем обжига в печах при температуре 150-170 °С либо в автоклавах при 120-170 °С. Технология получения вяжущих освоена в промышленном масштабе, в настоящее время по этому методу перерабатывается в мире 3 млн. т фосфогипса и производится 1,9 млн. т вяжущих материалов.
В производстве цемента фосфогипс гранулируют и подсушивают в барабанных сушилках до содержания гигроскопической влаги около 5%. Использование фосфогипса уменьшает расход топлива в производстве цемента, повышает производительность печей и качество цементного клинкера.
В производстве серной кислоты и цемента высушенный фосфогипс смешивают с глиной, песком и коксом и обжигают при 1200-1400 °С. При обжиге протекают следующие реакции:
CaSO4 + 2С = CaS + 2СО2; CaS + 3CaSO4 = 4СаО + 4SO2
Процесс может быть описан суммарной реакцией:
2CaSO4 + С = 2СаО + 2SO2 + СО2
В процессе применяют небольшой избыток углерода (20-30% от стехиометрического) для компенсации его расхода на побочные реакции.
Образующийся диоксид серы направляется на окисление до SO3, который далее абсорбируется водой с получением серной кислоты.
В производстве серной кислоты и извести фосфогипс восстанавливают коксом или продуктами конверсии природного газа:
CaSO4 + 2С = CaS + 2СО2; CaSO4 + 4СО = CaS + 4СО2; CaSO4 + 4Н2 = CaS + 4Н2О
Сульфид кальция обрабатывают водой, а полученную суспензию - диоксидом углерода:
CaS + Н2О + СО = H2S + CaCO3
Полученный сероводород окисляется до диоксида серы:
H2S + 3/2О2 = SO2 + Н2О
Разработаны способы, основанные на взаимодействии предварительно приготовленного (NH4)2CO3 с фосфогипсом или на непосредственном контактировании газообразных NНз и СО2.
Разработана схема комплексной переработки фосфогипса в сульфат аммония, оксид кальция и концентрат редкоземельных элементов. Метод основан на том, что СаО, полученный из осадка СаСО3, растворяется в аммониевых солях, а редкоземельные элементы остаются в осадке. Прокаливание СаСО3 проводят при 1000 "С, полученный оксид кальция обрабатывают раствором NH4Cl с получением раствора СаСl2 и осадка редкоземельных элементов. Аммонизированный раствор СаСl2 насыщается CO2 для выделения СаСО3 и регенерации NH4Cl.
В сельском хозяйстве фосфогипс используется для гипсования солонцовых почв. При внесении в такие почвы фосфогипса (6-7 т на 1 га) происходит образование сульфата натрия, который легко вымывается. Фосфогипс рекомендуется применять в качестве местных удобрений. Использование такого удобрения экономически оправданно при отсутствии дальних перевозок (до 500 км). Использование фосфогипса не требует очистки от Р2O5 поскольку эта примесь играет положительную роль при внесении в почву.
Потребность в нашей стране в серосодержащих удобрениях составляет более 2 млн т/год.
Среди других методов переработки фосфогипса перспективным является извлечение из него элементной серы путем восстановления при температуре 1100-1200 °С.
Фосфорные шлаки — побочный продукт производства фосфора термическим способом в электропечах. При температуре 1300—1500 °С фосфат кальция взаимодействует с углеродом кокса и кремнеземом, в результате чего образуются фосфор и шлаковый расплав. Шлак сливается из печей в огненно-жидком состоянии и гранулируется мокрым способом. На 1 т фосфора приходится 10—12 т шлака. На крупных химических предприятиях получают до 2 млн т шлака в год.
Химический состав фосфорных шлаков близок к составу доменных. Суммарное содержание в них оксида кальция и кремнезема достигает 95% при их соотношении 0,9—1,1.
Особенностями фосфорных шлаков являются содержание в них Р205 и CaF2 (до 3% каждого) и пониженное количество А1203 (обычно не более 4%). Различия в содержании Р205 и CaF2 и коэффициентах основности, определяющих физико-химические свойства шлаковых расплавов и особенности грануляции, существенно влияют на фазовый состав, структуру и свойства шлаков. Гранулированный шлак электрофосфорного производства светло-серого цвета с синеватым оттенком, имеет стекловатую структуру; плотность примерно 2,8 г/см3, насыпную плотность в сухом состоянии около 1220 кг/м3. Петрографическими исследованиями установлено, что 90—95% шлака составляет стекло с включениями кристаллов псевдоволластонита и других минералов. Гранулометрический состав гранулированных фосфорных шлаков соответствует зерновому составу обычных мелко- или средне-зернистых строительных песков.
Гипсосодержащие, известковые и железистые продукты — это отходы ряда химических и смежных с ними производств.
Гипсосодержащие продукты образуются при производстве ряда химических продуктов: минеральных кислот (фосфогипс и фосфопо-лугидрат, борогипс, фторангидрит, фторогипс), органических кислот (цитрогипс) и др., химической обработке древесины (гидролизный гипс), обработке водных растворов некоторых солей и кислот (крем-негипс, титаногипс и др.), очистке промышленных газов, содержащих S02 (сульфогипс); производстве солей из озерной рапы (рапной гипс).
Из гипсосодержащих продуктов в наибольшем количестве образуется фосфогипс. На 1 т экстракционной фосфорной кислоты (в пересчете на 100% Н3Р04) образуется 3,6—6,2 т фосфогипса в пересчете на сухое вещество.
На некоторых предприятиях годовой выход фосфогипса достигает 2,5 млн т. Стоимость транспортирования и хранения его в отвалах составляет до 30% общей стоимости сооружений и эксплуатации основного производства.
Фосфогипс представляет собой отходы сернокислотной переработки апатитов или фосфоритов в фосфорную кислоту или концентрированные фосфорные удобрения.
При разложении природных фосфатов серной кислотой в раствор переходит фосфорная кислота и образуется труднорастворимый сульфат кальция. В общем случае реакция растворения апатитов в смеси серной и фосфорной кислот имеет вид:
Ca3(P04)3F + 5H2S04 + nH3P04 + mH20 -> -> (п + 3) Н3Р04 + 5CaS04mH20 + HE
Кристаллический осадок сульфата кальция отделяют от фосфорной кислоты фильтрованием.
Химический состав фосфогипса в основном определяется качеством используемого фосфатного сырья, а также способом производства экстракционной фосфорной кислоты. Ниже приведен химический состав фосфогипса на основе Кольских апатитовых концентратов (в %): СаО - 39-40; S03 - 56-57; Р205 (общ.) - 1,0-1,2; Р205 (во-дораствор.) 0,5—0,6; F — 0,3—0,4. Присутствие примесей затрудняет использование фосфогипса, а в некоторых случаях, например, при высокой радиоактивности оно становится невозможным. Радиоактивность фосфогипса на основе широко применяемого в странах СНГ Кольского апатита сравнительно невысокая. В зависимости от температуры и концентрации получаемой кислоты сульфат кальция может быть выделен в форме дигидрата CaS04-2H26 (гипс), полугидрата CaSO40,5H2O или безводной соли CaS04 (ангидрит).
Экстракционную фосфорную кислоту получают дигидратным и полугидратным способами. При дигидратном способе образуемый фосфодигидрат содержит 93—95% двуводного гипса с механической примесью 1—1,5% пятиокиси фосфора и некоторого количества кремнезема и других оксидов. Фосфогипс имеет вид шлама влажностью до 40%. Твердая фаза шлама тонкодисперсна и более чем на 50% состоит из частиц размером менее 10 мкм. Двуводный гипс в фосфогипсе имеет вид правильных игольчатых кристаллов и пучкообразных сростков.
При производстве фосфорной кислоты способом экстракции по полугидратной схеме побочным продуктом является фосфополугидрат сульфата кальция, содержащий 92—95% cc-CaS04- 0,5H2O, т.е. основного компонента высокопрочного гипса. Однако наличие на поверхности кристаллов полугидрата пассивирующих пленок без специальной технологической обработки препятствует проявлению вяжущих свойств у этого продукта. Влажность фосфополугидрата составляет до 25%.
Предприятия химической промышленности располагают побочными продуктами, удовлетворяющими техническим требованиям на известь или позволяющими получить ее обжигом карбоната кальция.
К первым относятся карбидная известь, отходы электровозгонки и обогащения фосфоритов, ко вторым известковые отходы содового производства, карбонатные шламы азотно-туковых заводов и предприятий целлюлозно-бумажной промышленности и др.
Карбидная известь побочный продукт получения ацетилена при действии воды на карбид кальция. Известковое тесто на основе так называемого «карбидного ила» содержит примеси неразложившего-ся карбида кальция и растворенного ацетилена. Применять его можно после выдерживания в течение 1—2 мес до исчезновения запаха ацетилена, что определяется нагреванием пробы в фарфоровой чашке до 70 °С с помешиванием в течение 20 мин.
Порошковая карбидная известь отличается от извести-пушонки размерами и формой зерен. В ней кристаллы гидрата оксида кальция имеют вид пластинок размером до 0,2 мм, а в обычной пушонке они имеют сферическую форму и размеры 0,5—1 мм. Содержание активных оксидов (СаО + MgO) в карбидной извести зависит от продолжительности ее пребывания на воздухе в отвалах и составляет 50—70%, т. е. ее активность достигает активности извести третьего сорта или может быть несколько меньше. Для улучшения вяжущих свойств карбидной извести при изготовлении автоклавных изделий целесообразно измельчать ее совместно с песком.
Близкими по составу и свойствам к карбидной извести являются некоторые отходы смежных отраслей химической промышленности, такие как подзол и окшара. Подзол — отход кожевенной промышленности, окшара — текстильной. Оба отхода представляют собой известковое тесто с примесями соответственно органических веществ, хлора и хлорида кальция.
Некоторые известковые отходы химической промышленности, например, получаемые при электровозгонке и обогащении фосфоритов, представляют собой разбавленные суспензии, которые при сгущении и фильтрации близки по качеству к известковому молоку.
Наибольшее количество карбонатных отходов, пригодных для производства извести и портландцемента, скапливается на содовых, целлюлозно-бумажных и азотно-туковых предприятиях в виде шламов. Их применение невозможно без очистки от примесей и частичного обезвоживания, например в центрифугах непрерывного действия или в вакуумных барабанных фильтрах.
Наиболее распространенными железистыми побочными продуктами химической промышленности являются пиритные огарки — отход переработки серного колчедана (пирита) в серную кислоту. Химический состав пиритных огарков (%): Fe203 — 56—77; Si02 9—22; А1203- 1-18; СаО- 0,8-5; MgO- 0,1-0,2; S03- 1-11; потери после прокаливания — до 5,5%. По минералогическому составу они представляют собой смесь оксидов железа с непрореагировавшим пиритом и оксидами других металлов. В незначительных количествах содержатся примеси сернокислых солей щелочно-земельных металлов, свинца, цинка, меди, кобальта. Гранулометрический состав огарков характеризуется сравнительно высокой дисперсностью, основная масса зерен (более 90%) имеет крупность не более 0,14 мм.
К железистым отходам относятся также железистые шламы анили-нокрасочных заводов. Содержание оксидов железа в них в расчете на Fe203 составляет 81—93%, в том числе закисного железа около 20%.
К кремнеземистым побочным продуктам химической промышленности относится, например, сиштоф — твердый остаток после получения хлорида или сульфата алюминия из каолина. Его химический состав представлен в основном тремя оксидами: Si02 (до 55%), А1203 (до 20%) и S03 (до 12%). Потери при прокаливании составляют около 10%.
Сиштоф получают также при производстве сернокислого алюминия из глины. При обработке дегидратированной огнеупорной глины серной кислотой глинозем переходит в раствор, а кремнезем остается. В таких отходах содержится 80—90% активного кремнезема. Примесями при этом являются неразложившаяся глина и сульфат или хлорид алюминия.
Лигнин — отход гидролизного производства, один из компонентов древесины, представляющий собой аморфный полимер сложного строения. Природный лигнин при выделении из древесины претерпевает необратимые превращения. В отходе гидролизного производства, кроме собственно лигнина, содержатся остатки полисахаридов, минеральные и органические кислоты, смолы, воск, азотистые вещества и др. Влажность лигнина 65—70%, средняя плотность — 500— 600 кг/м3, теплотворная способность 6300—7600 кДж/кг, зольность до 3%. Высокая дисперсность и внутренняя поверхность (700—800 м2/г), а также преобладание микропор обусловливают хорошие сорбцион-ные свойства лигнина и его пластичность.
Химическая и смежные с ней отрасли промышленности располагают многочисленными побочными продуктами, которые применяются или могут применяться в качестве поверхностно-активных веществ или добавок электролитов при производстве строительных материалов.
Поверхностно-активные вещества — это органические соединения, в молекулы которых входят одновременно полярная группа (например, ОН, СООН, NH) и неполярная углеводородная цепь. Общей особенностью ПАВ является способность к концентрированию на поверхности раздела фаз, т. е. к адсорбции.
В зависимости от изменения степени смачиваемости твердых тел при образовании адсорбционных слоев различают гидрофилизующие и гидрофобизующие ПАВ. Из ПАВ первой группы, применяемых обычно в качестве добавок-пластификаторов, наиболее распространены концентраты технических лигносульфонатов (ЛСТ) — отходы, получаемые из сульфитных щелоков, образующихся при сульфитной варке целлюлозы. При варке сернистая кислота связывается с лигнином древесины. Технические лигносульфонаты включают кальциевые, иногда магниевые или натриево-аммонийные соли лигносульфоновых кислот, а также древесные сахара и небольшие примеси скипидара, фурфурола, органических кислот и др. Сахара и другие примеси в ЛСТ, обладающие восстанавливающей способностью, объединяют в группу редуцирующих веществ.
Близкими к техническим лигносульфонатам по характеру действия являются паточная барда — отход переработки патоки в этиловый спирт, сульфитные щелоки и сточные воды целлюлозного производства. В качестве пластифицирующих добавок применяются также другие ПАВ, полученные из отходов химической, нефтехимической и пищевой промышленности — пластификатор адипиновый, щелочные стоки производства капролактама (ЩСПК), белковый гидролизат, молочная сыворотка и др.
Гидрофобизующие ПАВ, применяемые при производстве строительных материалов, содержат нафтеновые и высшие жирные кислоты и их производные. Распространены кубовые остатки, образуемые при производстве синтетических жирных кислот с числом атомов углерода в молекуле от С10 до С2о- Представителем гидрофобизующих ПАВ на основе нафтеновых кислот является мылонафт — отход очистки дистиллятов нефти едким натрием.
Некоторые химические отходы содержат электролиты. При производстве 1 т соды получается около 8 м3 дистиллерной жидкости, представляющей собой суспензию нерастворимых продуктов в растворе хлоридов кальция и натрия. Средний состав этой жидкости (г/м3): СаС12- 85-95; NaCl - 45-50; СаС03 - 6-15; CaS04 - 3-5; Mg(OH) 2 -3-10; CaO - 2-4; (Fe203 + А1203) - 1-3; Si02 - 1-4. Для захоронения эту жидкость перекачивают в шламонакопители (так называемые «белые моря»).
Щелочесодержащими отходами являются метасиликат натрия (побочный продукт производства диоксида титана или глинозема), содощелочной плав (отход капролактамового производства), щелочные отходы производства фенола.
При производстве хлорида калия из сильвинита около 80% извлекаемой из недр руды после переработки идет в отвал в виде галито-вых отходов, глинисто-солевых шламов и рассолов. На поверхности земли вблизи калийных предприятий скопились миллионы тонн солевых отвалов.
При коксовании каменного угля наряду с основным продуктом — коксом — образуются газ, бензол, сырая каменноугольная смола и другие продукты. Выход сырой смолы составляет до 5% от массы каменного угля. При фракционной разгонке смолы получают легкие, средние и тяжелые масла, содержащие ряд химических веществ, а также антраценовое масло и пек — компоненты дорожного дегтя. В процессе отстаивания каменноугольной смолы в хранилищах образуются фусы — отходы, содержащие смолистые вещества (50—80%), угольную и коксовую пыль, железистые и другие соединения. В процессе очистки серной кислотой бензольной фракции каменноугольной смолы образуется так называемая кислая смолка, представляющая собой черную вязкую массу с плотностью 1,28—1,3 г/см3.
К отходам коксохимического производства относятся также кубовые остатки ректификации сырого бензола и некоторые другие продукты.
Крупнотоннажные отходы образуются в процессе переработки нефти в виде кислых гудронов, нефтяных шламов, отработанных масел и др.
ГЛАВА 3. ИЗВЛЕЧЕНИЕ КРЕМНЕФТОРИСТОВОДОРОДНОЙ КИСЛОТЫ ИЗ ПРОЦЕССА ПРОИЗВОДСТВА ФОСФОРНОЙ КИСЛОТЫ
В процессе производства концентрированных фосфатных удобрений фосфорсодержащая руда подвергается экстракции раствором серной кислоты. Полученная разбавленная фосфорная кислота концентрируется упариванием и затем используется для получения концентрированных жидких и гранулированных фосфорсодержащих удобрений. В процессе экстракции фосфорной кислоты из руды серной кислотой образуется фтористый водород. При наличии диоксида кремния образуется кремнефто-ристоводородная кислота. Большое количество фтористых соединений остается в разбавленной фосфорной кислоте в виде фтористого водорода и кремнефтористоводородной кислоты. В процессе концентрирования упариванием большинство фтора выделяется вместе с паром в виде HF и четырехфтористого кремния в различных количествах, определяемых составом исходных руд. Токсичность этих соединений требует очистки отходящих газов. В то же время газы содержат ценный химический материал для получения фторсодержащих неорганических солей. На отдельных заводах от 10 до 30 тыс. т/год фторсодержащих соединений может быть получено в результате очистки отходящих газов.
Использует прямоточный абсорбер для выделения фтора в виде крем-нефтористоводородной кислоты с невысоким содержанием фосфора из отходов производства фосфатов. Аппарат представляет собой усовершенствованный прямоточный абсорбер, использующий многократное циклонное разделение, прямоток и многократное капельное рассекание потока. Абсорбер и его место в общем процессе показаны на рис. 1.
При начале работы системы нагреватель 9, испаритель 13 и циркуляционный трубопровод 12 заполняются до требуемого уровня фосфорной кислотой. Уровень кислоты в испарителе 13 поддерживается постоянным и регулируется сливной трубой 5 (барометрическая труба). Далее в холодильник 28 подается вода и с помощью вакуумного насоса (не показан) в системе создается вакуум.
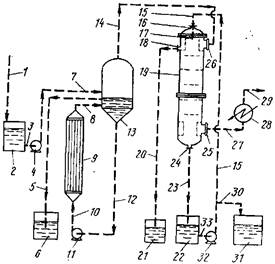
Включается циркуляционный насос И для подачи фосфорной кислоты и начинается подача пара в нагреватель 9. При этом кислотный раствор в трубках нагревателя перегревается и образуется паро-кислотная смесь, которая непрерывным потоком подается из 9 в испаритель 13. В испарителе 13 пары выходят по линии 14, а жидкость стекает в трубу 12. Таким образом осуществляется непрерывное циркулирование кислоты через линию 12 в нагреватель 9, через насос // и трубопровод 8, затем в испаритель 13 по линии 8 и из испарителя и циркуляционную трубу 12, после этого процесс повторяется.
Когда кислота в 12 достигает необходимой концентрации начинается непрерывная подача в систему разбавленной кислоты из резервуара 2 по линиям 3 и 7 с помощью насоса 4.
Концентрированная кислота при превышении уровня сливается из испарителя 13 по трубе 5 в резервуар для сбора концентрированной кислоты 6. В известном способе пары из 13 подавались в конденсатор 28 с помощью вакуумного насоса, при этом получалась кремнефтористоводородная кислота, загрязненная фосфорной кислотой.
Для выделения фторсодержащих соединений из паров дополнительно используется прямоточный абсорбер 19, который помещается между испарителем 13 и конденсатором 28. Пары из испарителя 13 по линии 14 проходят в верхнюю часть абсорбера 19 через ввод 26 и контактируют с рециркулируемым раствором. Затем пары выходят из 19 по линии 27 и конденсируются в конденсаторе 28. В нем поддерживается температура достаточно низкая для конденсации всех паров. Таким образом исключается возможность загрязнения воздуха.
При включении системы резервуар 22 заполняется водой и приводится в действие насос 32. Абсорбер 19 орошается раствором, подаваемым через ввод 17 насосом 32 по линии 15 из резервуара 22. При этом происходит промывка паров, поступающих из испарителя 13 через ввод 26. Водорастворимые компоненты паров поглощаются циркулирующим раствором.
В случае переработки газов производства фосфорной кислоты мокрым способом происходит реакция взаимодействия тетрафторида кремния с водой в соответствии с уравнением
![]()
Фтористый водород взаимодействует с диоксидом кремния с образованием кремне-фтористоводородной кислоты
![]()
Жидкость из абсорбера 19 проходит по трубе 23 в резервуар 22, откуда снова подается для орошения абсорбера насосом 32. По мере достижения концентрации кремнефто-ристоводородной кислоты ~30 %, раствор из 22 по линии 30 отводится в резервуар для хранения получаемого раствора кремнефтористоводородной кислоты 31.
Температура в аппарате для выделения фтористых соединений соответствует равновесной температуре пара при данном используемом давлении. Абсорбер 19 работает при давлении 13,5—98,5 КПа, температура пара при этих условиях составляет 20—95° С.
В верхней части абсорбера находится сливное отверстие 18 для удаления по линии 20 в резервуар 21 любых жидкостей, конденсирующихся перед подачей в абсорбер. В нижней части находится выходное отверстие 25 для удаления по линии 27 паров, остающихся после прохождения через абсорбер. В нижней части также находится отверстие 24 для вывода жидкости по линии 23 в резервуар для циркулирующей жидкости 22.
ЛИТЕРАТУРА
1. Кислотные методы переработки фосфатного сырья / Е.Л. Яхонтова, И.А. Петропавловский, В.Ф. Кармышов, И.А. Спиридонова. – М.: Химия, 1988. – 288 с.
2. Шуб Б.И. Перспективы развития полугидратного процесса получения экстракционной фосфорной кислоты / Б.И. Шуб, Э.В. Хлебодарова // Химическая промышленность. – 1999. - №11. – С.41-43.
3. Большая советская энциклопедия / под ред. А.Н. Прохорова. М.: Советская энциклопедия, 1976. – Т.23.
4. Копылев В.Н. Технология экстракционной фосфорной кислоты / В.Н. Копылев. – М.: Химия, 1981. – 224 с.
© 2009 База Рефератов