
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Комплексне лікування гострої тонкокишкової непрохідності з використанням ентеральної терапії
Реферат: Комплексне лікування гострої тонкокишкової непрохідності з використанням ентеральної терапії
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАЦІОНАЛЬНА МЕДИЧНА АКАДЕМІЯ ПІСЛЯДИПЛОМНОЇ ОСВІТИ
імені П.Л. ШУПИКА
ЖДАНОВ Сергій Миколайович
УДК 616.34 – 007. 272 - 08
КОМПЛЕКСНЕ ЛІКУВАННЯ ГОСТРОЇ ТОНКОКИШКОВОЇ НЕПРОХІДНОСТІ З ВИКОРИСТАННЯМ РАННЬОЇ ЕНТЕРАЛЬНОЇ ТЕРАПІЇ
(клініко-експериментальне дослідження)
Спеціальність: 14.01.03 - хірургія
А В Т О Р Е Ф Е РА Т
дисертації на здобуття наукового ступеня
кандидата медичних наук
Київ-2008
Дисертацією є рукопис.
Робота виконана у Вищому державному навчальному закладі України “Українська медична стоматологічна академія”, МОЗ України.
Науковий керівник:
доктор медичних наук, професор
Лігоненко Олексій Вікторович, завідувач кафедри
загальної хірургії з доглядом за хворими, з оперативною
хірургією та топографічною анатомією ВДНЗУ “Україн-
ська медична стоматологічна академія” МОЗ України,
Офіційні опоненти:
доктор медичних наук, професор, Бобров Олег Євгенович, завідувач кафедри хірургії і судинної хірургії
Національної медичної академії післядипломної освіти імен П.Л. Шупика, МОЗ України
доктор медичних наук, член кореспондент АМН України професор, Лупальцов Володимир Іванович, завідувач кафедри хірургічних хвороб Харківського медичного університету, МОЗ України
Захист відбудеться 20.02.2008 р. о 13 годині на засіданні спеціалізовано вченої ради Д 26.613.08 при Національній медичній академії післядипломно освіти імені П.Л. Шупика МОЗ України за адресою: 04112, м. Київ вул. Дорогожицька, 9
З дисертацією можна ознайомитись у бібліотеці Національно медичної академії післядипломної освіти імені П.Л. Шупика МОЗ України, за адресою: 04112, м. Київ вул. Дорогожицька, 9
Автореферат розісланий 17.01.2008 р.
Вчений секретар
спеціалізованої вченої ради
Д 26.613.08, к. мед. наук, доцент Гвоздяк М.М.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Гостра тонкокишкова непрохідність – це тяжка патологія черевної порожнини, яка відноситься до однієї з найважливіших проблем екстрено хірургії. В структурі захворювань ургентної хірургії гостра тонкокишкова непрохідність (ГТКН) займає одне з провідних місць. Незважаючи на прогрес, який був досягнутий протягом останніх років, результати комплексного лікування цього важкого захворювання не можуть задовільнити клініцистів, оскільки післяопераційна летальність залишається високою і сягає 13-17% і не ма тенденції до зменшення [Бєляєва О.О. та співав., 1999, 2004, Бобров О.Е. та співав., 2000, Бойко В.В. та співав., 2004, Зайцев В.Т. та співав., 2000, Лігоненко О.В. та співав., 2007, Саєнко В.Ф. та співав., 2001, Bass K.N.,1997, Nonaka D., 1998].
Багаточисельними дослідниками встановлено, що однією з складових частин патогенезу ГТКН є порушення фізіологічних функцій тонкої кишки [Миминошвили А.О. та співав., 2007, Радзіховський А.П. та співав., 2006, Слонецький Б.І. та співав., 2007, Afessa B. 1999, Dofferhoff A.S., 1992]. Загальновизнаним є те, що в результаті гіповолемії, порушень центральної і регіонарно гемодинаміки, мікроциркуляції і реологічних властивостей крові в умовах парезу тонкої кишки розвивається гіпоксія тканин і розлади клітинного метаболізму, як приводять до виникнення некробіотичних процесів в стінці кишки [Андрющенко В.П., Федоренко С.Т. 1995, Матвійчик Б.О. та співав., 2007, Мілиця М.М. та співав., 2007, Тамм Т.І. та співав., 2007, Mc.Gil S.N., 1998]. Висловлюються також думки, що в результаті порушень порожнистого і пристінкового травлення, посиленого розмноження мікрофлори, активації гнилісних і бродильних процесів кишковий вміст набуває токсичних властивостей і є причиною ураження стінки тонкої кишки [Ганжий В.В., Тищенко В.В., 2006, Shih HC., et al. 1999].
Слід відмітити, що проведені в останні роки дослідження доводять можливість надходження токсичних продуктів, мікробів і їх токсинів в кровоносне і лімфатичне русла і черевну порожнину. Високий вміст бактерій в просвіт кишківника на фоні ішемії, гіпоксії і атрофії його слизової – все це служить основою гіпотези про наявність бактерійної транслокації при критичних станах. Транслокація ендотоксинів може грубо порушувати фізіологічні процеси з розвитком системної запальної реакції та виникненню поліорганної недостатност (ПОН). Однак, в доступній нам літературі ми не знайшли робіт, присвячених динаміці морфологічних, мікробіологічних та біохімічних змін в слизовій оболонці тонкої та товстої кишки, особливо її проксимальних відділів на різних етапах перебігу ГТКН, що не дає повного уявлення про можливі шляхи проникнення бактерій та їх токсинів у черевну порожнину.
За останні роки також доведено, що в проксимальних відділах тонкої кишки зосереджені значні популяції біфідо-і лактобактерій, які мають виражену антагоністичну активність по відношенню до патогенних бактерій, регулюють якісний та кількісний склад мікрофлори кишечника в нормі, сповільнюють ріст та розмноження в ньому патогенних та умовнопатогенних мікроорганізмів, підтримують структурну та функціональну цілісність слизової оболонки тонкої кишки [Gando S. et al., 1999, Stechmiler J.K., et al., 1997]. Тим не менше, відсутні дан про динаміку змін кількісного та якісного складу мікрофлори і, особливо популяцій біфідо-і лактобактерій в процесі перебігу ГТКН. Все це вимагає, на наш погляд, визначення напрямків та розробки найбільш ефективних методів профілактики та ентерального лікування, направлених на збереження морфологічно та функціональної цілісності слизової оболонки тонкої кишки та запобігання феномену “бактерійної транслокації”. Цьому і присвячене наше дослідження.
Зв’язок роботи з науковими програмами, темами. Робота виконана відповідно до плану науково-дослідної роботи Вищого державного наукового закладу України Українська медична стоматологічна академія” (м. Полтава) “Запальн незапальні захворювання органів і систем людини, що сформувалися під впливом екологічних, стресових, імунних, метаболічних і інфекційних факторів. Стан гемо-гомеостазу, гемодинаміки при застосування традиційних і нетрадиційних способів лікування” (№ державної реєстрації 018U000143).
Мета дослідження. Покращити результати комплексного лікування хворих з гострою тонкокишковою непрохідністю шляхом розробки та впровадження ранньої ентеральної терапії і стандартизацією до-, нтра- та післяопераційного їх ведення.
Задачі дослідження:
1. Провести ретроспективний аналіз результатів лікування хворих на ГТКН у лікувальних закладах м. Полтави і вивчити причини незадовільних результатів.
2. Розробити експериментальну модель ГТКН, яка б була максимально близькою за клінічними, лабораторними морфологічними проявами і перебігом цього захворювання до клініки.
3. Вивчити динаміку змін лабораторних, патоморфологічних і мікробіологічних показників у тонкій, товстій кишці та перитонеальному випоті тварин з моделлю ГТКН та у хворих для розробки ранньої ентеральної біологічної терапії.
4. Розробити спосіб нтраопераційної діагностики порушень бар’єрної функції кишечнику при ГТКН.
5. Розробити спосіб інтраопераційного визначення герметичності швів міжкишкових анастомозів при виконанні резекц кишки у хворих з гострою тонко кишковою непрохідністю.
6. Розробити спосіб профілактики мікробної транслокації з товстої кишки при гострій тонкокишковій непрохідності.
7. Розробити методику комплексного лікування хворих з гострою тонкокишковою непрохідністю як стандарт ведення хворих на до-, інтра- та післяопераційному етапах.
Об’єкт дослідження: гостра тонкокишкова непрохідність.
Предмет дослідження: рання ентеральна терапія в комплексному лікуванні гостро тонкокишкової непрохідності.
Методи дослідження: експериментальні, клінічні, біохімічні, мікробіологічні, патоморфологічні, статистичні.
Наукова новизна одержаних результатів.
Запропонований новий “Спосіб моделювання гострої тонкокишкової непрохідності”, який максимально близький за клінічними, лабораторними, морфологічними проявами станом біоценозу кишківника (Патент України № 21676) до перебігу цього захворювання у клініці – відкриває перспективу подальшого поглибленого вивчення патогенезу цього захворювання і розробки нових методів лікування.
Вперше, на підставі співставлення результатів клінічних, лабораторних, патоморфологічних і мікробіологічних експериментальних досліджень, запропоновано об’єктивний “Спосіб інтраопераційної діагностики порушень бар’єрної функції кишечнику при гострій тонкокишковій непрохідност (Патент України № 21677); “Спосіб інтраопераційного визначення герметичност швів міжкишкових анастомозів (Патент України № 21675), “Спосіб профілактики мікробної транслокації з товстої кишки при гострій тонкокишковій непрохідност (Патент України № 23899).
Вперше експериментально розроблено і впроваджено в клініку “Спосіб ранньої біологічно ентеральної терапії при гострій тонкокишковій непрохідності” (Патент України 26831).
Вперше вивчена динаміка лабораторних, патоморфологічних мікробіологічних змін у хворих з ГТКН з використанням запропонованих способів діагностики і лікування.
Практичне значення одержаних результатів.
Застосування способу профілактики мікробної транслокації з товстої кишки у черевну порожнину при гострій тонкокишковій непрохідност забезпечує швидке очищення і знищення патогенної і умовно-патогенної мікрофлори кишки. Це суттєво зменшує інфікування черевної порожнини.
Спосіб діагностики порушення бар’єрної функції кишки у хворих на гостру тонкокишкову непрохідність забезпечує швидку візуальну діагностику порушення бар’єрної функції кишки і локалізацію найбільш уражених ділянок черевної порожнини шляхом виявлення місць інтенсивного бактеріального забруднення – вогнищ найбільшого інфікування черевної порожнини для адекватного дренування та запобігання розвитку перитоніту.
Застосування інтраопераційного способу визначення герметичності швів міжкишкових анастомозів дозволяє хірургу у короткий термін визначати і усувати ділянки негерметичності анастомозу це сприяло запобіганню неспроможності швів анастомозу.
Впровадження результатів дослідження в практику.
Впровадження в клініку способу ранньої біологічно ентеральної терапії при гострій тонкокишковій непрохідності дозволило у більш ранні терміни почати ентеральне годування хворого, суттєво знизити рівень нтоксикації, досягти більш швидкого відновлення моторної функції кишечнику та зменшити процеси злукоутворення. Використання вищеназваних способів в комплексному лікуванні хворих дозволило суттєво знизити післяопераційну летальність.
Результати досліджень впроваджені в учбовий процес кафедр загальної та факультетсько хірургії ВДНЗУ “УМСА” (м. Полтава)., кафедри загальної хірургії Одеського державного медичного університету, кафедри медичної діагностики та невідкладних станів ФПО Тернопільського державного медичного університету імені І.Я. Горбачевського. А також в практику лікувальної роботи хірургічних відділень міської клінічно лікарні №2 та центральної районної клінічної лікарні м. Полтави, відділково залізничної лікарні ст. Полтава-Південна, міської клінічної лікарні м. Одеса, обласної клінічної лікарні м. Рівне.
Особистий внесок здобувача. Отримані в роботі дані є результатом самостійного виконання клінічних та експериментальних досліджень, а також оцінки та трактовки результатів біохімічних, морфологічних та мікробіологічних аналізів. Дисертантом зібраний і оброблений фактичний матеріал, проведен клініко-біохімічні дослідження у хворих. Матеріал для патоморфологічних досліджень зібраний автором особисто. Самостійно проведені експериментальн дослідження. Модель ГТКН, яку використовували для проведення експерименту запропонована автором. Автор вивчив динаміку змін показників лабораторних, патоморфологічних мікробіологічних досліджень у тварин з ГТКН, що дало можливість запропонувати впровадити для клінічного застосування “Спосіб інтраопераційної діагностики порушень бар’єрної функції кишечника при гострій тонкокишковій непрохідност (Патент України № 21677); “Спосіб інтраопераційного визначення герметичност швів міжкишкових анастомозів (Патент України № 21675), “Спосіб профілактики мікробної транслокації з товстої кишки при гострій тонкокишковій непрохідност (Патент України № 23899), “Спосіб ранньої біологічної ентеральної терапії при гострій тонкокишковій непрохідності“ (Патент України № 26831).
В клініці самостійно проводив лікування хворих на ГТКН, безпосередньо приймав участь при виконанні оперативних втручань.
Апробація результатів дисертації.
Матеріали дослідження доповідалися на науково-практичній конференції з міжнародною участю “Рани, ранова інфекція, ранні післяопераційні ускладнення в абдомінальній та судинній хірургії” (Київ, 14-15 грудня 2006 р.); Всеукраїнській науково-практичній та навчально-методичній конференції “Фундаментальні науки – хірургії” (ІІІ Скліфосовські читання) (Полтава, 5-6 квітня 2007 р), Всеукраїнській науково-практичній конференції молодих вчених (Медична наука-2007) “Актуальн проблеми сучасної медицини”. – Полтава, 2007.
Публікації. По темі дисертації опубліковано 3 статті у фахових журналах зареєстрованих ВАК України, отримано 5 деклараційних патентів України. З списку опублікованих по темі дисертації 1 робота написана особисто, 2 – у співавторстві.
Обсяг і структура дисертації. Дисертація викладена на 174 сторінках машинописного тексту і складається з вступу, огляду літератури, характеристики об’єктів та методів дослідження, двох розділів власних досліджень, обговорення отриманих результатів, висновків, практичних рекомендацій, списку використано літератури, додатків. Робота ілюстрована 9 таблицями, 6 малюнками. Список літератури містить 217 робіт вітчизняних авторів і 130 іноземних.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали та методи дослідження. З метою оцінки впливу ранньої ентеральної терапії на мікробний біоценоз тонкої і товстої кишки при гострій тонкокишковій непрохідності (ГТКН) та для розробки і апробації нових схем лікування цього захворювання в клініці, були проведені експериментальні дослідження. Розподіл тварин по серіям наведений в таблиці 1.
Таблиця 1
Розподіл експериментальних тварин по групам дослідів
| Серії | К-сть тварин | Вплив | Показники, що вивчались |
| 1 | 2 | 3 | 4 |
|
1 серія (контрольна) |
5 | - | Загальнолабораторні та біохімічні показники, мікробний біоценоз тонкої і товстої кишки |
|
2 серія (дослідна) |
25 | модель ГТКН | Загальнолабораторні та біохімічні показники, мікробний біоценоз тонкої кишки, товстої кишки, перитонеального випоту |
|
3 серія (дослідна) |
25 | модель ГТКН | Вивчення термінів інфікування черевно порожнини шляхом транслокації мікрофлори з тонкої кишки |
|
4 серія (дослідна) |
25 | модель ГТКН | Вивчення термінів інфікування черевної порожнини шляхом транслокації мікрофлори з товстої кишки та вивчення впливу пробіотиків на мікрофлору кишечника |
|
5 серія (дослідна) |
5 | модель ГТКН | Вивчення впливу пробіотиків на мікрофлору товстого кишечника |
В першій серії дослідів вивчали загальнолабораторні та біохімічні показники, мікробний біоценоз тонкої і товстої кишки.
Загально лабораторні та біохімічні показники, мікробний біоценоз тонкої кишки, товстої кишки, перитонеального випоту на 6, 9, 12, 18 та 24 години з моменту відтворення експериментальної моделі (Патент України 21676) (друга серія дослідів).
Вивчення термінів і шляхів інфікування черевної порожнини шляхом транслокації мікрофлори з тонкої кишки (3 серія) виконували після відтворення ГТКН за вище описаною методикою в ті ж терміни, що і в попередній серії дослідів. Вивчення термінів і шляхів інфікування черевної порожнини шляхом транслокації мікрофлори з товстої кишки (4 серія) проводили аналогічно попередній серії дослідів, метиленовий синій і антибіотик вводили тваринам per rectum.
На п’яти тваринах (V серія) нами досліджено спосіб очищення товстої кишки. Метод передопераційної підготовки при ГТКН здійснювали шляхом введення у просвіт товстої кишки (per rectum) води з рН-5,5 і пробіотика лінекса, чим забезпечується швидке очищення і знищення патогенно умовно-патогенної мікрофлори кишки.
Клінічні дослідження проведені у 137 хворих, оперованих з приводу ГТКН на базах Центральної районно клінічної лікарні, відділкової залізничної клінічної лікарні ст. Полтава-Південна, II міської клінічної лікарні м. Полтави, І клінічної лікарні м. Києва віком від 18 до 91 року протягом 2005 2007 рр. Розподіл хворих з ГТКН по групах спостережень представлений в табл. 2.
Таблиця 2
Розподіл хворих з ГТКН по групах спостережень
| Групи | Вид оперативного втручання, вид лікування | Кількість хворих |
| 1 | 2 | 3 |
| Контрольна | - | 10 |
| Перший період спостережень | 1. Роз’єднання злук + інтубація кишечника + загальноприйняте лікування | 50 |
| 2. Роз’єднання злук + резекція кишки + нтубація + загальноприйняте лікування | 17 | |
Другий періодспостережень |
1. Роз’єднання злук + інтубація кишечника + запропонована ентеральна терапія | 52 |
| 2. Роз’єднання злук + резекція кишки + нтубація + запропонована ентеральна терапія | 18 | |
| Всього | 137/10 | |
Лабораторні методи дослідження: кількість еритроцитів, концентрація гемоглобіну, швидкість осідання еритроцитів, концентрацію білірубіну (Биць Ю. В., Данилова Л. Я., 2001); загальний білок сироватки крові, білкові фракції, вміст калію, натрію, хлоридів (Меншиков В.В. та співавт., 1987); вміст залишкового азоту, креатиніну, сечовини (Колб В.Г., Камышников В.С., 1976); АЛаТ, АСаТ (Young D.S. et al., 1975), патоморфологічні дослідження (Меркулов Г.А., 1969).
Запропонована нами схема комплексного лікування хворих на ГТКН включає декілька розроблених та запатентованих нами оригінальних лікувально-профілактичних заходів, як використовуються в процесі ведення хворих на ГТКН на передопераційному етапі, в процесі проведення оперативного втручання, та на етапах реабілітації.
У процесі передопераційної підготовки використовували запропонований нами “Спосіб профілактики мікробної транслокації з товстої кишки при гострій кишковій непрохідності” (Патент України № 23899).
Очищення товстої кишки запропонованим способом дозволяє знизити бактеріальну забрудненість, Clostridsum spp. з 105 до 103, Escherichia з 108 до 103, Proteus spp. з 104 до 102, Klebsiella spp. з 105 до 102, Staphylococcus aureus з 104 до 102, Enterococcus spp. з 106 до 103, і підвищити кількість Bifidobacterium spp. з 103 до 109, Lactobacillium spp. з 103 до 107.
На етапі оперативного втручання нами був використаний “Спосіб інтраопераційної діагностики порушення бар’єрної функції кишечнику при гострій тонкокишковій непрохідності” (Патент України № 21677).
Нами запропонований “Спосіб інтраопераційного визначення герметичності швів міжкишкових анастомозів” (Патент України № 21675).
На етапі оперативного втручання нами також був використаний Спосіб ранньої біологічної ентеральної терапії при гострій тонкокишковій непрохідності” (Патент України № 26831).
Спосіб ранньої біологічно ентеральної терапії при гострій тонкокишковій непрохідності дозволяє знизити бактеріальну забрудненість тонкої кишки Clostridіum spp. з 103 до 102, Escherichia з 104 до 102, Klebsiella spp. з 104 до 102, Staphylococcus spp. з 105 до 102, Enterococcus spp. з 103 до 102, і підвищити кількість Bifidobacterium spp. з 102 до 103, Lactobacillium spp. з 102 до 103.
Мікробіологічні дослідження проводили на середовищ Плоскірєва і вісмут-сульфат агарі (для патогенних і умовно-патогенних ентеробактерій), на жовчево-сольовий агарі (для стафілококів), на середовищ Сабуро (для грибів), середовищі Блауррока (для біфідум бактерій), МРС-2 (для лактобацил).
Результати дослідження
Лабораторні, морфологічні і мікробіологічні показники тварин контрольної групи (практично здорові тварини) використовувались для порівняння змін аналогічних показників тварин дослідних груп.
Загально лабораторні та біохімічні показники експериментальних тварин з відтвореною моделлю відповідали в часових проміжках розвитку захворювання у хворих на ГТКН.
Вивчення мікробіоценозу тонкої кишки у нтактних щурів показало, що в ній визначаються, головним чином, невелик популяції грампозитивних факультативних аеробів, невелика кількість анаеробів, дріжджів і грибків. Однак у тварин після моделювання ГТКН мікробний пейзаж корінним чином змінюється.
В динаміці розвитку ГТКН відбувається швидка колонізація усіх відділів тонко кишки мікроорганізмами, які не властиві цьому відділу кишечника. Після дев’ято години відтворення захворювання повністю зникають лакто- і біфідобактерії. Відбувається вірогідне зростання кількості умовно патогенної мікрофлори клебсієл, ентеробактера, цитробактера. Вже через шість годин після розвитку ГТКН почали висіватися патогенні мікроорганізми – гемолітичні стафілококи, гемолітична кишкова паличка, фекальні стрептококи – до 18-24 години їх рівень перевищував 105 куо/мл.
При вивченні змін у мікроекологічному стані товстої кишки доведено, що вже через шість годин після відтворення експериментальної ГТКН суттєво змінюється кількісний і якісний склад мікрофлори: вірогідно зменшується кількість біфідо- лактобактерій, з’являються патогенні мікроорганізми – гемолітична кишкова паличка і гемолітичні стафілококи (до 102 куо/мл., а на 24 год. – до 105 куо/мл.). До 24 години кількість біфідо- і лактобактерій зменшилась у 1000 разів, а кількість умовно-патогенної мікрофлори зросла у таку ж кількість разів. Зростання більше ніж у 100 разів зафіксовано з боку кишково палички, ентерококів, дріжжеподібних грибів.
Через шість годин після моделювання ГТКН у випоті з черевно порожнини були виявлено бактеріальне забруднення всіма мікроорганізмами, як досліджувались. Критичного рівня (105 куо/мл.) патогенні мікроорганізми досягли вдвічі швидше, ніж сапрофіти та умовно-патогенна мікрофлора. Гемолітичний стафілокок, який вперше виявили в незначній кількості – 1.4х102 куо/мл (P<0,05) на 9 годину відтворення захворювання, до 24 години сягав рівня 2,4х105+1,3х104 куо/мл (P<0,05), таку ж картину спостерігали і при вивченн гемолітичної кишкової палички: з 1,9х102 куо/мл (P<0,05) кількість до 24 години становив 2,7х105+1,6х104 куо/мл (P<0,05). Ще більш стрімке зростання спостерігали при вивченні синьо-гнійно палички і фекальних стрептококів, які вперше висіяли через 12 годин після відтворення захворювання – 2,9х102 куо/мл (P<0,05) та 1,9х102 куо/мл (P<0,05), а через 24 годин їх кількість становила – 2,7х104+1,3х103 куо/мл (P<0,05) та 3,1х104+1,7х103 куо/мл (P<0,05) відповідно.
При патоморфологічному дослідженні кишечнику у тварин з моделлю ГТКН були виявлені розповсюджені циркуляторні розлади, особливо на рівні мікроциркуляторного русла у вигляді вазодилятації, венозного повнокрів’я, стазу, підвищення проникненості судин з розвитком набряку і осередкових периваскулярних крововиливів. Починаючи з 12-годинного спостереження на фон цих змін відмічено дистрофічні і некротичні зміни всієї стінки кишки, як обумовлені ендогенним токсикозом і вищенаведеними судинними розладами. Ступінь виразності судинних і тканинних змін знаходиться у прямій залежності від тяжкості і тривалості інтоксикації, обумовленої патологічним процесом у кишці.
При вивченні бар’єрно функції тонкої (введення суміші per os) та товстої кишки (введення per rectum) у тварин з моделлю ГТКН (патент України № 21677) доведено, що порушення бар’єрної функції тонкої кишки при ГТКН відбувається на 9 годину з початку відтворення захворювання, а товстої кишки – на 6 годину. Отримані результати дають підставу стверджувати, що бактеріальна транслокація починається з товстої кишки.
На п’яти тваринах (V серія) нами впроваджений спосіб очищення товстої кишки ГТКН (Патент України 26831). Очищення товстої кишки запропонованим способом дозволяє знизити бактеріальну забрудненість умовно-патогенними мікроорганізмами Clostridіum spp. з 105 до 103, Escherichia з 108 до 103, Klebsiella spp. з 105 до 102, Enterococcus spp. з 106 до 103, підвищити кількість Bifidobacterium spp. з 103 до 109, Bacteroides spp. до 109, Lactobacillium spp. з 103 до 107.
Позитивн результати експериментальних досліджень дозволили нам провести наступн клінічні дослідження з впровадження розроблених нами способів - передопераційної підготовки, нтраопераційної діагностики порушення бар’єрної функції кишечника та післяопераційного використання ранньої ентеральної терапії.
Клінічна картина перебігу гострої тонкокишкової непрохідності, загально лабораторні та біохімічні показники у хворих, які знаходились під нашим спостереженням, суттєво не відрізнялись від описаних в літературних джерелах.
В перший період спостереження померло 2 хворих (4%), яким виконано роз’єднання злук і інтубація тонкого кишечнику та відбувалось лікування за загальноприйнятою методикою. З 17 хворих, яким виконана резекція тонкої кишки за загальноприйнятою методикою, померло 4, летальність становила 23,5%.
В другий період спостережень у 52 хворих, яким виконано оперативне втручання по роз’єднанню злук + інтубація кишечнику та застосовували комплексне лікування запропонованими способами передопераційної підготовки, інтраопераційної діагностики порушень бар’єрно функції кишечнику та ранньої біологічної ентеральної терапії дозволило уникнути післяопераційної летальності. Ведення 18 хворих другого періоду спостереження було аналогічним, летальність становила 5,5%.
При патогістологічному дослідженні кишки померлих хворих обох груп спостереження виявлено розповсюджені циркуляторні розлади, особливо на рівні мікроциркуляторного русла у вигляді вазодилятації, венозного артеріального стазу і тромбозу, підвищення проникненості судин з розвитком осередкових, широко розповсюджених дистрофічних, некробіотичних і некротичних змін, які привели до наростання явищ розлитого перитоніту, що підтримувалось транслокацією мікроорганізмів через уражену стінку кишки і летального кінця.
При вивченні біоценозу мікрофлори тонкої кишки у хворих з ГТКН без резекції кишки які отримували загальноприйняте лікування (Рис. 3), в динаміці розвитку відбувається швидка колонізація усіх відділів тонкої кишки мікроорганізмами, які не властиві цьому відділу кишечника. Після 12 години з моменту операц повністю зникають лакто- і біфідобактерії. Відбувається значне вірогідне зростання кількості умовно-патогенної мікрофлори – клебсієл, ентеробактера, цитробактера. Вже під час оперативного втручання почали висівалися патогенн мікроорганізми – гемолітичні стафілококи, гемолітична кишкова паличка, фекальн стрептококи – до 24 години після втручання їх рівень перевищував 104 куо/мл.
Під час виконання оперативного втручання, коли видаляється некротизована ділянка кишки висівається велика кількість мікроорганізмів, які властиві товстому кишечнику. Появу патогенно флори можна пояснити некрозом стінки кишки і транслокацією мікроорганізмів з товстої кишки. З 6-ї години після операції зникають антагоністи патогенно умовно-патогенної флори – біфідо- і лактобактерії. Не дивлячись на використання в післяопераційному періоді сучасних антибіотиків патогенну флору виявляли протягом 3 діб – це було приводом для пошуку біологічної ентеральної терапії у ранньому післяопераційному періоді.
52 хворим другого періоду спостереження, яким було виконано роз’єднання злук і назогастральна інтубуція тонкої кишки, застосовували у передопераційному періоді запропоновану нами профілактику мікробно транслокації з товстої кишки (Патент України № 23899). Інтраопераційно застосовували запропоновану нами ранню біологічну ентеральну терапію (Патент України № 26831).
Через 6 годин після оперативного втручання висівалися поодинокі колонії біфідобактерій лактобактерій. Зростала кількість кишкової палички – 3,7х103 +1,3х102 куо/мл (P<0,05). Кількість умовно-патогенних мікроорганізмів зменшилась відносно попереднього часового проміжку і становила 1,2х106+0,3х105 куо/мл (P>0,05). Вірогідно зменшилась кількість патогенних мікроорганізмів - гемолітичного стафілококу – 1,8х102 куо/мл (P<0,05), гемолітично кишкової палички до 1,7х102 куо/мл (P<0,05), синьо-гнійної палички залишилась на попередньому рівні, фекальних стрептококів до 2,1х103+0,9х102 куо/мл (P<0,05). Через 12 годин після втручання гемолітичний стафілокок, гемолітична кишкова паличка і фекальні стрептококи – не висівалися, кількість синьо-гнійної палички вірогідно зменшилась – 2,7х102 куо/мл (P<0,05). Через 24 години зафіксоване різке зростання біфідобактерій лактобактерій – 2,8х103+1,4х102 куо/мл (P<0,05) 3,7х103+1,5х102 куо/мл (P<0,05) відповідно. Бактероїди, клостридії, кишкова паличка і стафілококи не висівалися, ентерококи поодинокі колонії. Кількість дріжжеподібних грибів становила – 1,7х102+0,3х102 куо/мл (P<0,05). Через 3 доби після оперативного втручання кількість біфідобактерій і лактобактерій залишалася на рівні попереднього досліджуваного часового проміжку і була значно вища контрольної групи пацієнтів. Зафіксовано повернення рівня умовно-патогенної флори до вихідного рівня контрольної групи.
Таким чином в динаміці лікування зазначеним способом відбувається нормалізація екологічного пейзажу тонкої кишки, що призводить до можливості ентерального годування у ранньому післяопераційному періоді і відновлення нормальної функції кишечнику.
Мікробний пейзаж, який виявили під час операції з резекцією кишки + ентеральна терапія був наступним (Рис. 4): вірогідно зросла кількість умовно-патогенних ентеробактерій – клебсієл, ентеробактер, цітробактер з 105 у контрольній групі до 4,9х107+1,5х106 куо/мл (P<0,05). Під час операції був виявлений гемолітичний стафілокок – 2,9х105+ 1,3х104 куо/мл (P<0,05), гемолітична кишкова паличка – 1,6х104+1,1х103 куо/мл (P<0,05), синьо-гнійна паличка – 1,5х104+1,1х103 куо/мл (P<0,05), фекальні стрептококи – 3,4х105+1,2х104 куо/мл (P<0,05).
Через 24 години вірогідно збільшилась кількість біфідобактерій і лактобактерій до 3,6х103+0,2х102 куо/мл (P>0,05) і 2,4х103+1,1х102 куо/мл (P>0,05). У цей часовий проміжок ми висіяли крім умовно-патогенної флори у кількост 2,2х105+1,1х104 куо/мл (P>0,05), що відповіда показникам контрольної групи, лише синьо-гнійну паличку - 0,3х102 куо/мл (P>0,05).
Через 3 доби після оперативного втручання кількість біфідобактерій і лактобактерій знаходились на рівні попередньої досліджуваємої групи 3,9х103+1,2х102 куо/мл (P>0,05) і 1,2х103+0,6х102 куо/мл (P>0,05), але на порядок вищими за контрольну групу. У цей часовий проміжок ми висіяли лише умовно-патогенної флори у кількості 2,7х104+1,3х103 куо/мл (P>0,05), що відповідає показникам контрольної групи.
Таким чином, на підставі отриманих результатів можна стверджувати про доцільність використання біологічної ентеральної терапії у ранньому післяопераційному періоді для покращення пригнічення і знищення патогенної мікрофлори при гострій тонкокишковій непрохідності.
При вивченні спектру мікрофлори дистального відділу товстої кишки у хворих з ГТКН при загальноприйнятому лікуванні вже під час виконання оперативного втручання зафіксовано вірогідне зменшення біфідо- і лактобактерій, і цей процес зростав до третьої доби. Збільшилась кількість кишкової палички, ентерококів, дріжжеподібних грибів і умовно- патогенної мікрофлори. З моменту надходження хворих до стаціонару висівалися і зростали у досліджувані часові проміжки патогенні гемолітичні стафілококи, гемолітична кишкова паличка і синьо-гнійна паличка і цей процес ми простежували протягом трьох діб. Все це свідчить про значні зміни екосистеми товстої кишки у хворих з ГТКН, які призводять до контамінації і інфікування черевної порожнини. Нормалізувати ці процеси було поставлено за мету у процесі лікування наступної групи хворих.
Спектр мікрофлори дистального відділу товстої кишки у хворих з ГТКН при ранній біологічній ентеральній терапії через 6 годин після оперативного втручання мав наступні показники: вірогідно збільшилась кількість усіх патогенних мікроорганізмів – гемолітичного стафілококу до 2,3х103 +1,2х102 куо/мл (P<0,05), гемолітичної кишкової палички - 2,7х103+1,3х102 куо/мл (P<0,05), синьогнійної палички - 1,7х104+1,3х103 куо/мл (P<0,05). Зросла кількість фекальних стрептококів до 2,7х105+1,3х104 куо/мл (P<0,05). Протягом наступних 12 годин вірогідно знизилась кількість цих мікроорганізмів - гемолітичного стафілококу до 2,9х102 куо/мл (P<0,05), гемолітичної кишкової палички - 1,8х102 +0,2х102 куо/мл (P<0,05), синьо-гнійної палички - 2,3х103+1,1х102 куо/мл (P<0,05). На 24 годину досліджень патологічних мікроорганізмів практично не виявляли. Кількість фекальних стрептококів залишалася на рівні контрольних показників.
Таким чином вже під час виконання оперативного втручання зафіксовано вірогідне зменшення біфідо- і лактобактерій, і цей процес тривав протягом 12 годин, після чого вже через добу, завдяки ранній біологічній ентеральній терапії кількість цих мікроорганізмів зросла у 100 разів.
Протягом першої післяопераційної доби вдалося нормалізувати біоценоз товстої кишки знищити патогенні мікроорганізми, які висівалися протягом 12 годин. Цього ефекту ми не спостерігали у попередній групі хворих не дивлячись на використання антибіотиків широкого спектру дії. Таким чином можна стверджувати про доцільність і обов’язкове призначення ранньої біологічної ентерально терапії.
При дослідженні мікрофлори перитонеального випоту у хворих з ГТКН при загальноприйнятому лікуванні (Рис. 1) мікробний пейзаж, який виявили під час оперативного втручання у випоті з черевної порожнини був наступним: кількість біфідобактерій становила 0,7х102+0,1х102 куо/мл. (Р<0,05). Протягом наступних 12 годин їх кількість вірогідно збільшилась до 1,9х104+1,4х103 куо/мл. (Р<0,05). Пік обсіменіння біфідобактеріями перитонеального випоту зафіксовано на 24 годину досліджень - 3,8х104+2,7х103 куо/мл. (Р<0,05). Через 3 доби кількість біфідобактерій знизилась більш ніж у 100 разів - 2,9х102 куо/мл. (Р<0,05). Під час втручання кількість лактобактерій становила 1,4х102 куо/мл., максимум зафіксовано на 24 годину - 2,4х104+1,6х103 куо/мл. (Р<0,05), але й на третю добу ми висівали ці бактерії з перитонеального випоту - 3,3х102 куо/мл. (Р<0,05).
Кількість кишкової палички на момент операції становила 1,3х102 куо/мл, але вже через шість годин цей показник зріс більш ніж у 10 разів - 3,4х103 +1,6х102 куо/мл. (Р<0,05). Через 12-24 години зафіксовано максимальне зростання до 3,6х104+2,1х103 куо/мл. (Р<0,05). На 3 добу досліджень у випоті ще висівали кишкову паличку - 2,8х102 куо/мл. (Р<0,05).
Кількість умовно-патогенних ентеробактерій – клебсієл, ентеробактера, цітробактера вже під час втручання становила 1,7х102 куо/мл (P<0,05), протягом доби цей показник зростав до 1,5х104+1,2х103 куо/мл (P<0,05) на 24 годину досліджень. На 3 добу з випоту висівали 1,7х102 куо/мл (P<0,05) умовно-патогенних ентеробактерій.
Патогенних мікроорганізмів під час втручання не висівали, а вже через 6 годин був висіяний гемолітичний стафілокок – 1,4х102 куо/мл (P<0,05), гемолітична кишкова паличка – 1,9х102 куо/мл (P<0,05) Синьо-гнійна паличка фекальні стрептококи на цей момент не висівалися.
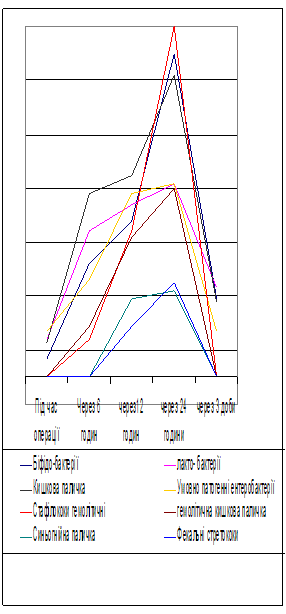
Рис. 1. Динаміка обсіменіння перитонеального випоту хворих першої групи спостереження після резекції тонкої кишки (схема)
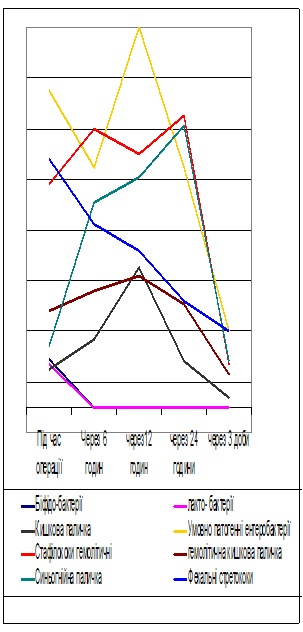
Рис. 3. Динаміка обсіменіння тонкої кишки хворих першої групи спостереження після резекції тонкої кишки (схема)
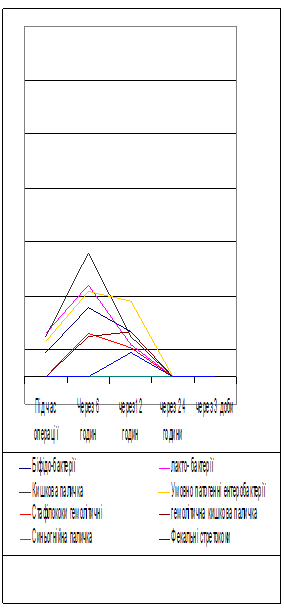
Рис. 2. Динаміка обсіменіння перитонеального випоту хворих другої групи спостереження після резекції тонкої кишки (схема)
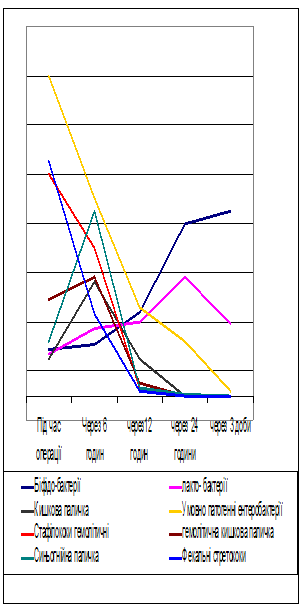
Рис. 4. Динаміка обсіменіння тонкої кишки хворих другої групи спостереження після резекції (схема)
Максимальна кількість патогенних мікроорганізмів зафіксована через добу після втручання - гемолітичного стафілококу до 4,5х104+2,4х103 куо/мл (P<0,05), гемолітичної кишкової палички - 1,4х104+1,2х103 куо/мл (P<0,05), синьо-гнійної палички - 3,9х102 куо/мл (P<0,05), фекальних стрептококів - 1,8х103+1,6х102 куо/мл (P<0,05). На 3 післяопераційну добу патологічних мікроорганізмів не виявляли.
Таким чином, вже під час виконання оперативного втручання зафіксовано появу, як анаеробної, так і аеробної мікрофлори у перитонеальному випоті, а на 6-12 годину після втручання висіваються вже і патогенні мікроорганізми. Максимальна кількість усіх перерахованих мікроорганізмів зафіксована на 24 годину досліджень. Поява мікроорганізмів у перитонеальному випоті пояснюється транслокацією їх через скомпроментовану стінку товстої і тонкої кишки.
Лікувальну доктрину по недопущенню транслокації мікроорганізмів з просвіту кишечника слід починати вже під час оперативного втручання.
При вивченні мікрофлори перитонеального випоту хворих з ГТКН при запропонованій ранній біологічній ентеральній терапії (Рис. 2) мікробний пейзаж, був наступним: кількість біфідобактерій становила 0,9х102 куо/мл. (Р<0,05). Протягом наступних 6 годин їх кількість вірогідно збільшилась до 1,3х103+0,5х102 куо/мл. (Р<0,05). Вже на 12 годину досліджень їх кількість зменшилась у 10 разів - 1,7х102 куо/мл. (Р<0,05). У наступних часових проміжках біфідобактерії не висівалися. Під час втручання кількість лактобактерій становила 1,6х102 куо/мл, на цьому рівні цей показник тримався протягом 12 годин, на 24 годину цих мікроорганізмів не висівали.
Кількість кишкової палички на момент операції становила 1,5х102 куо/мл, але вже через шість годин цей показник зріс більш ніж у 10 разів - 2,3х103 +1,3х102 куо/мл. (Р<0,05). Через 12 годин зафіксовано десятикратне зменшення до 1,5х102+0,4х102 куо/мл. (Р<0,05). Починаючи з 24 годинного часового проміжку цей мікроорганізм не висівався.
Кількість умовно-патогенних ентеробактерій – клебсієл, ентеробактера, цітробактера вже під час втручання становила 1,3х102+0,4х102 куо/мл (P<0,05), протягом 6-12 годин цей показник підвищився до 1,7х103+1,2х102 куо/мл (P<0,05). У подальшому ці мікроорганізми не висівалися.
Патологічних мікроорганізмів під час втручання не висівали, а вже через 6 годин був висіяний гемолітичний стафілокок – 1,6х102 куо/мл (P<0,05), гемолітична кишкова паличка – 1,5х102+0,3х102 куо/мл (P<0,05). Синьо-гнійна паличка і фекальні стрептококи на цей момент не висівалися.
Через 12 годин після оперативного втручання отримали наступні результатти: кількість усіх патогенних мікроорганізмів – гемолітичного стафілококу і гемолітично кишкової палички залишалася на попередньому рівні, з’явився фекальний стрептокок - 0,9х102+0,3х102 куо/мл (P<0,05).
У подальших вивчаємих часових проміжках патогенних мікроорганізмів не висівали.
Таким чином, вже під час виконання оперативного втручання зафіксовано появу, як анаеробної, так і аеробної мікрофлори у перитонеальному випоті, а на 6-12 годину після втручання висіваються вже і патогенні мікроорганізми. Максимальна кількість усіх перерахованих мікроорганізмів зафіксована на 24 годину досліджень. Поява мікроорганізмів у перитонеальному випоті пояснюється транслокацією їх через скомпроментовану стінку товстої і тонкої кишки.
Протягом першої післяопераційної доби вдалося нормалізувати екосистему товстої кишки знищити патогенні мікроорганізми, які висівалися протягом 12 годин. Цього ефекту ми не спостерігали у попередній групі хворих не дивлячись на використання антибіотиків широкого спектру дії. Таким чином можна стверджувати про доцільність і обов’язкове призначення ранньої біологічної ентеральної терапії.
Таким чином проведене дослідження кількісного і якісного складу перитонеального випоту дає підставу стверджувати, що оперативне втручання при гострій тонкокишковій непрохідност повинно бути виконано у перші години після початку захворювання - коли практично не висівається патогенна мікрофлора, а кількісний і якісний спектр мікроорганізмів, які знаходяться у перитонеальному випоті можливо знищити шляхом усунення непрохідності і призначенням антибіотиків у комплексі з пробіотиками.
В лікувальну схему ведення хворих з ГТКН необхідно обов’язкове включення заходів запобігання мікробної транслокації в черевну порожнину, які проводяться на етапах перед- , інтра-, та післяопераційного періоду.
ВИСНОВКИ
В дисертаційній роботі представлені результати вирішення наукової задачі, яка полягала в підвищенні ефективності лікування та зниженн летальності хворих на гостру тонкокишкову непрохідність, які ґрунтуються на експериментальних дослідженнях по моделюванню гострої тонкокишково непрохідності, оригінальної передопераційної підготовки, інтраопераційно діагностики порушення бар’єрної функції кишечника та післяопераційного використання ранньої ентеральної терапії.
1. Розроблено модель гостро тонкокишкової непрохідності, яка максимально близька за клінічними, лабораторними і морфологічними проявами і перебігом до клініки, що підтверджено динамікою лабораторних, патоморфологічних і мікробіологічних змін у тонкій, товстій кишці та перитонеальному випоті тварин з цією патологією.
2. Отримані в експеримент результати доводять, що первинною ланкою інфікування черевної порожнини при розвитку гострої тонкокишкової непрохідності є транслокація мікроорганізмів з товстої кишки у черевну порожнину, яка відбувається на шосту годину від початку моделювання захворювання. Процес колонізації тонкої кишки патогенними та умовно-патогенними мікроорганізмами до моменту транслокації їх у черевну порожнину відбувається протягом більш тривалого терміну – 9 годин з моменту відтворення моделі гострої тонкокишкої непрохідності.
3. Запропонований метод передопераційної підготовки при гострій тонкокишковій непрохідності забезпечив зниження бактеріальної забрудненості умовно-патогенними мікроорганізмами Clostridіum spp. з 105 до 103, Escherichia з 108 до 103, Klebsiella spp. з 105 до 102, Enterococcus spp. з 106 до 103, підвищення кількості Bifidobacterium spp. з 103 до 109, Lactobacillium spp. з 103 до 107. Це суттєво зменшило ризик інфікування черевної порожнини шляхом транслокації мікроорганізмів з товстої кишки.
4. Розроблений, апробований в експерименті та впроваджений в клініку спосіб інтраопераційної діагностики порушень бар’єрної функції кишечнику дозволив виявляти місця найбільш нтенсивного бактеріального забруднення черевної порожнини для адекватного дренування, а спосіб інтраопераційного визначення герметичності швів міжкишкових анастомозів дозволив запобігти розвитку перитоніту.
5. Спосіб ранньої біологічно ентеральної терапії в клініці дозволяє знизити бактеріальну забрудненість тонкої кишки вже на 12-ту годину після оперативного втручання: Clostridsum spp. з 103 до 102, Escherichia spp. з 104 до 102, Klebsiella spp. з 104 до 102, Staphylococcus spp. з 105 до 102, Enterococcus spp. з 103 до 102, підвищити кількість Bifidobacterium spp. з 102 до 103, Lactobacillium spp. з 102 до 103, що суттєво зменшило транслокацію мікроорганізмів в черевну порожнину.
6. Летальність після операцій з приводу гострої тонкокишкової непрохідності за загальноприйнятою схемою лікування при роз’єднанні злук + інтубація кишечнику становила 4%, при роз’єднанні злук + інтубація кишечнику + виконання резекції кишки 23,5%. Використання в комплексному лікування запропонованих способів передопераційно підготовки, інтраопераційної діагностики порушень бар’єрної функції кишечнику та ранньої біологічної ентеральної терапії як стандарт ведення хворих на до-, нтра- та післяопераційному етапах дозволило уникнути післяопераційно летальності при веденні хворих без виконання резекції кишки, і знизити летальність при виконання резекції кишки в 4,4 рази до 5,5%.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Лігоненко О.В., Черная И.А., Дмитрук О.М., Жданов С.М. Вплив хірургічних ниток, модифікованих натрію сукцинатом і мексидолом, на морфометричні показники в паравульнарних тканинах кишечника//“Клінічна хірургія”. – 2006. - №11-12. С.26-27.
2. Лігоненко О.В., Чорна І.О., Жданов С.М. Використання пробіотиків в ранній ентеральній терапії при гострій тонкокишковій непрохідності //Актуальн проблеми сучасної медицини. – Полтава. – 2007. Т.7., Вип.. 1-2 (17-18). - С. 135-136.
3. Жданов С.М. Дослідження впливу пробіотиків на мікрофлору кишечника при моделюванн гострої тонкокишкової непрохідності. //Актуальні проблеми сучасної медицини. Полтава. – 2007. Т.7., Вип.. 3-4 (19-20). - С. 251-253.
4. Деклараційний патент 21676 А Україна 7 МПК А61В17/12. Спосіб моделювання гостро тонкокишкової непрохідності // Лігоненко О.В., Жданов С.М., Дмитрук О.М., Чорна І.О. Опубл. 15.03.07. –Бюл. - 2007. - № 3. – С.3-4.
5. Деклараційний патент 23899 А Україна 7 МПК А61В17/12. Спосіб профілактики мікробно транслокації з товстої кишки при гострій кишковій непрохідності//Лігоненко О.В., Жданов С.М., Дмитрук О.М., Чорна І.О. Опубл. 11.06.07. –Бюл. - 2007. - 8. – С.13-14.
6. Деклараційний патент 21677 А Україна 7 МПК А61В17/12. Спосіб інтраопераційно діагностики порушення бар’єрної функції кишечнику при гострій тонкокишковій непрохідності// Лігоненко О.В., Жданов С.М., Дмитрук О.М., Чорна І.О. Опубл. 15.03.07. –Бюл. - 2007. - № 3. – С.5-6.
7. Деклараційний патент 21675 А Україна 7 МПК А61В17/12. Спосіб інтраопераційного визначення герметичності швів міжкишкових анастомозів// Лігоненко О.В., Дмитрук О.М., Жданов С.М.Чорна І.О. Опубл. 15.03.07. –Бюл. - 2007. - № 3. – С.7-8.
8. Деклараційний патент України № 26831 А Україна 7 МПК А61В17/00. Спосіб ранньо біологічної ентеральної терапії при гострій тонкокишковій непрохідності// Лігоненко О.В., Жданов С.М., Дмитрук О.М., Чорна І.О. Опубл. 10.10.07. –Бюл. - 2007. - № 16. – С.21-22.
АНОТАЦІЯ
Жданов С. М. Комплексне лікування гострої тонкокишкової непрохідності з використанням ранньо ентеральної терапії.
Рукопис.
Дисертація на здобуття наукового ступеню кандидата медичних наук за спеціальністю 14.01.03 – хірургія. Національна медична академія післядипломної освіти ім. П.М. Шупика МОЗ України, Київ, 2008.
Дисертація присвячена вирішенню наукової задачі, яка полягала в підвищенні ефективності лікування та зниженні летальності хворих на гостру тонкокишкову непрохідність, що рунтуються на експериментальних дослідженнях по моделюванню гостро тонкокишкової непрохідності, оригінальної передопераційної підготовки, нтраопераційної діагностики порушення бар’єрної функції кишечника та післяопераційного використання ранньої ентеральної терапії.
Летальність після операцій з приводу гострої тонкокишкової непрохідності за загальноприйнятою схемою лікування при роз’єднанні злук + інтубація кишечнику становила 4%, при роз’єднанні злук + інтубація кишечнику + виконання резекції кишки 23,5%. Використання в комплексному лікування запропонованих способів передопераційно підготовки, інтраопераційної діагностики порушень бар’єрної функції кишечнику та ранньої біологічної ентеральної терапії як стандарт ведення хворих на до-, нтра- та післяопераційному етапах дозволило уникнути післяопераційно летальності при веденні хворих без виконання резекції кишки, і знизити летальність при виконання резекції кишки в 4,4 рази до 5,5%.
Ключові слова: гостра тонкокишкова непрохідність, бактеріальна транслокація, комплексне лікування, рання ентеральна терапія.
АННОТАЦИЯ
Жданов С. Н. Комплексное лечение острой тонкокишечной непроходимости с использованием ранней энтеральной терапии.
Рукопись.
Диссертация на соискание научной степени кандидата медицинских наук по специальности 14.01.03 – хирургия. Национальная медицинская академия последипломного образования им. П.М. Шупика МЗ Украины, Киев, 2008.
Диссертация посвящена решению научной задачи, которая состояла в повышении эффективности лечения и снижения летальности больных острой тонкокишечной непроходимостью, которая основывается на экспериментальных исследованиях по моделированию острой тонкокишечной непроходимости, оригинальной предоперационной подготовки, интраоперационной диагностики нарушения барьерной функции кишечника и послеоперационного использования ранней энтеральной терапии.
Полученные в эксперименте результаты доказывают, что первичным звеном инфицирования брюшной полости при развитии острой тонкокишечной непроходимости является транслокация микроорганизмов из толстой кишки в брюшную полость, что происходит на шестой час от начала моделирования заболевания. Процесс колонизации тонкой кишки патогенными и условно-патогенными микроорганизмами до момента транслокации их в брюшную полость происходит в течении более продолжительного периода – 9 часов с момента моделирования острой тонкокишечной непроходимости.
Предложенный метод предоперационной подготовки при острой тонкокишечной непроходимости с использованием воды с рН-5,5 и пробиотика линекса обеспечил быстрое очищение и уничтожение патогенной и условно-патогенной микрофлоры кишки. Это существенно уменьшило риск инфицирования брюшной полости путем транслокации микроорганизмов из толстой кишки.
Способ ранней биологической энтеральной терапии в клинике при острой тонкокишечной непроходимости позволяет снизить бактериальную обсемененность тонкой кишки на 12-й час после оперативного вмешательства: Clostridsum spp. с 103 до 102, Escherichia spp. с 104 до 102, Klebsiella spp. с 104 до 102, Staphylococcus spp. с 105 до 102, Enterococcus spp. с 103 до 102, и повысить количество Bifidobacterium spp. с 102 до 103, Lactobacillium spp. с 102 до 103.
Летальность после операций по поводу острой тонкокишечной непроходимости по общепринятой схеме лечения при разъединении спаек + интубация кишечника составляла 4%, при разъединении спаек + интубация кишечника + выполнение резекции кишки 23,5%. Использование в комплексном лечении предложенных способов предоперационной подготовки, интраоперационной диагностики нарушений барьерной функции кишечника и ранней биологической энтеральной терапии как стандарта ведения больных на до-, интра- и послеоперационном этапах позволило избежать послеоперационной летальности при ведении больных без выполнения резекции кишки, и снизить летальность при выполнении резекции кишки в 4,4 рази до 5,5%.
Ключевые слова: острая тонкокишечная непроходимость, бактериальная транслокация, комплексное лечение, ранняя энтеральная терапия.
SUMMARY
Zhdanov S. M. Complex treatment of acute small bowel obstruction with applying of early enteral therapy. – Manuscript.
Thesis for a Candidate of Medical Sciences degree by Speciality 14.01.03 – Surgery. National P.L. Shupyk Medical Academy of Post-graduate Education, Ministry of Public Health of Ukraine, Kyiv, 2008.
The dissertation is devoted to the increasing of treatment efficacy and to reducing of lethality in patients with acute bowel obstruction. The approaches in solving this intricate question are based on the experimental studying simulating acute small bowel obstruction, a novel preoperative preparation, intraoperative diagnostics of barrier bowel dysfunction, and early post-operative enteral therapy.
Lethal outcomes of the operations for acute small bowel obstruction performed in accordance to the conventional scheme of adhesion removal + bowel intubation averaged out 4%. When the operations included adhesion removal + bowel intubations + bowel resection the lethality increased to 23.5%. The applying of proposed preoperative preparation, intraoperative diagnostics of barrier bowel dysfunction, and early biological entreat therapy as a standard of patients management at pre-, intra-, and post-operative periods allowed to avoid post-operative lethal outcomes when managing patients who had been not subjected to bowel resection, and to reduce lethality when the procedure of bowel resection had been performed in 4.4 times up to 5.5%.
Key words: acute small bowel obstruction, bacterial translocation, complex treatment, early enteral therapy.
Свідоцтво державного комітету телебачення і радіомовлення України Серія ДК №1691 від 17.02.2004р.
![]()
Підписано до друку 08.01.2008 р. Форма 60x901/16.
Папір офсетний. Умовн. друкар. арк. 0,9. Тираж 100. Заказ 22 . Редакційно-видавничий відділ вищого державного навчального закладу України Української медичної стоматологічної академії”
36024, м. Полтава, вул. Шевченка, 23
© 2009 База Рефератов