
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Оксиген і сульфур
Реферат: Оксиген і сульфур
 |
Реферат
з Хімії
на тему:
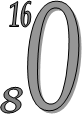
p=16; p=8
e=16; 1S2 2S2 2p6 3S2 3p4 — Електронна Формула — 1S22S22p4 e=8
n=16 n=8
Підготували: Карапенко Р.
Колот А.
Дніпропетровськ - 2006
Оксиген
КИСЕНЬ (лат. Oхygenіum), O, хімічний елемент з атомним номером 8, атомна маса 15,9994. У періодичній системі елементів Менделєєва розташований у другому періоді в групі VІ.
Природний кисень складається із суміші трьох стабільних нуклідів з масовими числами 16 (домінує в суміші, його в ній 99,759 % по масі), 17 (0,037%) і 18 (0,204%). Радіус нейтрального атома кисню 0,066 нм. Конфігурація зовнішнього електронного шару нейтрального не збудженого атома кисню 2 s 2 р 4. Енергії послідовно онізації атома кисню 13,61819 і 35,118 Ев, спорідненість до електрона 1,467 Ев. Радіус іона О2-при різних координаційних числах від 0,121 нм (координаційне число 2) до 0,128 нм (координаційне число 8). У з'єднаннях виявляє ступінь окислювання -2 (валентність ІІ) і, рідше, -1 (валентність І). По шкалі Полінга электронегативність кисню 3,5 (друге місце серед неметалів після фтору ).
У вільному виді кисень - газ без кольору, запаху і смаку.
Історія відкриття
Історія
відкриття кисню, як і азоту, зв'язана з вивченням, що продовжувалися кілька
століть, атмосферного повітря. Про те, що повітря по своїй природі не
однорідний, а включає частини, одна з яких підтримує горіння і подих, а інша -
ні, знав ще в VIII столітт
китайський алхімік Мао Хоа, а пізніше в Європі - Леонардо Да Вінчі.
У 1665 англійський натураліст Р. Гук писав, що повітря складається з
газу, що міститься в селітрі, а також з неактивного газу, що складає велику
частину повітря. Про те, що повітря містить елемент, що підтримує життя, у 18
столітті було відомо багатьом хімікам. Шведський аптекар і хімік Карл Шееле
почав вивчати склад повітря в 1768. Протягом трьох років він розкладав
нагріванням селітри (KNO3, NaNO3) і інші речовини й
одержував "вогненне повітря", що підтримує подих і горіння. Але
результати своїх досвідів Шееле обнародував тільки в 1777 році в книзі "Хімічний
трактат про повітря і вогонь". У 1774 англійський священик
натураліст Дж. Прістлі нагріванням "паленої ртуті" (оксиду
ртуті Hg) одержав газ, що підтримує горіння. Будучи в Парижі, Прістлі, що не
знав, що отриманий їм газ входить до складу повітря, повідомив про сво
відкриття А. Лавуазьє й іншим ученим. До цього часу був відкритий
азот. У 1775 Лавуазьє прийшов до висновку, що звичайне повітря складається з
двох газів - газу, необхідного для подиху і підтримуючого горіння, і газу
"протилежного характеру" - азоту. Лавуазьє назвав підтримуючий
горіння газ oxygene - "утворюючий кислоти" (від грецьк. oxys - кислий
gennao - народжую; звідси і російська назва "кисень"), тому що він
тоді вважав, що всі кислоти містять кисень. Давно уже відомо, що кислоти
бувають і безкисневими, але назва, дана елементу Лавуазьє, залишилося незмінною.
Протягом майже півтора століть 1/16 частина маси атома кисню служила одиницею
порівняння мас різних атомів між собою і використовувалася при чисельній
характеристиці мас атомів різних елементів (так називана киснева шкала атомних
мас).
Поширення в природі
Кисень - найпоширеніший на Землі елемент, на його частку (у складі різних з'єднань, головним чином силікатів), приходиться близько 47,4% маси твердої земної кори. Морські і прісні води містять величезна кількість зв'язаного кисню - 88,8% (по масі), в атмосфері зміст вільного кисню склада 20,95 % (по обсязі). Елемент кисень входить до складу більш 1500 з'єднань земної кори.
Одержання
В даний час кисень у промисловості одержують за рахунок поділу повітря при низьких температурах. Спочатку повітря стискають компресором, при цьому повітря розігрівається. Стиснутому газу дають остудитися до кімнатно температури, а потім забезпечують його вільне розширення. При розширенн температура газу різко знижується. Охолоджене повітря, температура якого на кілька десятків градусів нижче температури навколишнього середовища, знову піддають стиску до 10-15 МПа. Потім знову відбирають теплоту, що виділилася. Через кілька циклів "стиск-розширення" температура падає нижче температури кипіння і кисню, і азоту. Утвориться рідке повітря, що потім піддають перегонці (дистиляції). Температура кипіння кисню (-182,9°C) більш ніж на 10 градусів вище, ніж температура кипіння азоту (-195,8°C). Тому з рідини азот випаровується першим, а в залишку накопичується кисень. За рахунок повільної (фракційної) дистиляції вдається одержати чистий кисень, у якому зміст домішки азоту складає менш 0,1 об'ємного відсотка.
Ще більш чистий кисень можна одержати при електроліз водяних розчинів лугів (NaOH чи KOH) чи солей кисневмісних кислот (звичайно використовують розчин сульфату натрію Na2SO4). У лабораторії невеликі кількості не дуже чистого кисню можна одержати при нагріванні перманганату калію KMn4:
![]() 2KMn4 = K2Mn4 + Mn2 + O2.
2KMn4 = K2Mn4 + Mn2 + O2.
Більш чистий кисень одержують розкладанням пероксиду водню Н2O2 у присутності каталітичних кількостей твердого діоксида марганцю Mn2:
![]() 2Н2O2 = 2Н2O + O2.
2Н2O2 = 2Н2O + O2.
Кисень утвориться при сильному (вище 600°C) прожарюванн нітрату натрію NaNO3:
![]() 2NaNO3 =2NaNO2 + O2,
2NaNO3 =2NaNO2 + O2,
при нагріванні деяких вищих оксидів:
![]() 4Cr3= 2Cr2O3 + 3O2;
4Cr3= 2Cr2O3 + 3O2;
![]() 2Pb2 = 2Pb + O2;
2Pb2 = 2Pb + O2;
![]() 3Mn2 = Mn3O4 + O2.
3Mn2 = Mn3O4 + O2.
Раніше кисень одержували розкладанням Бертолетової солі KCl3 у присутності каталітичних кількостей диоксида марганцю Mn2:
![]() 2KCl3 = 2KCl + 3O2.
2KCl3 = 2KCl + 3O2.
Однак бертолетова сіль утворить вибухові суміші, тому для одержання кисню в лабораторіях тепер не використовують. Зрозуміло, зараз нікому в голову не прийде використовувати для одержання кисню прожарювання оксиду ртуті Hg, тому що кисень, що утвориться в цій реакції, забруднений отрутними парами ртуті.
Джерелом кисню в космічних кораблях, підвідних човнах т.п. замкнутих приміщеннях служить суміш пероксиду натрію Na2O2 супероксиду калію KO2. При взаємодії цих з'єднань з вуглекислим газом звільняється кисень:
![]() 2Na2O2 + 2CO2 = 2Na2CO3
+ O2,
2Na2O2 + 2CO2 = 2Na2CO3
+ O2,
![]() 4K2 + 2CO2 = 2K2CO3 + 3O2.
4K2 + 2CO2 = 2K2CO3 + 3O2.
Якщо використовувати суміш Na2O2 і K2, узятих у молярному відношенні 1:1, то на кожен моль поглиненого з повітря вуглекислого газу буде виділятися 1 моль кисню, так що склад повітря не буде змінюватися за рахунок поглинання при подиху кисню і виділення CO2.
Особливості будови молекули O2
Атмосферний кисень складається з двохатомних молекул. Міжатомне відстань у молекулі O2 0,12074 нм. Молекулярний кисень (газоподібний і рідкий) - парамагнітна речовина, у кожній молекулі O2 знаходиться по 2 неспарених електрони.
Енергія дисоціації молекули O2 на атоми досить висока і складає 493,57 кдж/моль.
Фізичн хімічні властивості
При нормальних умовах щільність газу кисню 1,42897 кг/м3. Температура кипіння рідкого кисню (рідина має блакитний колір) -182,9°C. При температурах від -218,7°C до -229,4°C існує твердий кисень з кубічними ратами (модифікація), при температурах від -229,4°C до -249,3°C - модифікація з гексагональними ґратами і при температурах нижче -249,3°C - кубічна -модифікація. При підвищеному тиску і низьких температурах отримані й інш модифікації твердого кисню.
При 20°C розчинність газу O2: 3 ,1 мл на 100 мл води, 22 мл на 100 мл етанолу, 23,1 мл на 100 мл ацетону. Існують органічн фторовмісні рідини (наприклад, перфторбутилтетрагідрофуран), в яких розчинність кисню значно вища.
Висока міцність хімічного зв'язку між атомами в молекулі O2
призводить до того, що при кімнатній температурі газоподібний кисень
хімічно досить малоактивний.
У природі він повільно вступає в перетворення при процесах гниття. Крім того,
кисень при кімнатній температурі здатний реагувати з гемоглобіном кров
(точніше з залізом ІІ гема), що забезпечує перенос кисню від органів подиху до
нших органів.
З багатьма речовинами кисень вступає у взаємодію без нагрівання, наприклад, з
лужними і лужноземельними металами (утворяться відповідні оксиди типу Lі2O,
CaО і інші, пероксиди типу Na2O2, BaО 2 та ін.
супероксиди типу KО 2, RbО 2 та ін.), виклика
утворення іржі на поверхні сталевих виробів.
Без нагрівання кисень реагує з білим фосфором, з деякими альдегідами й іншими
органічними речовинами.
При нагріванні, навіть невеликому, хімічна активність кисню різко зростає. При підпалюванні він реагує з вибухом з воднем, метаном, іншими пальними газами, з великою кількістю простих і складних речовин. Відомо, що при нагріванні в атмосфері кисню чи на повітрі багато простих і складних речовин згоряють, причому утворюються різні оксиди, наприклад:
![]() S+O2 = SO2
S+O2 = SO2
![]() С + O2 = СО2
С + O2 = СО2
![]() 4Fe + 3O2 = 2Fe2O3
4Fe + 3O2 = 2Fe2O3
![]() 2Cu + O2 = 2Cu
2Cu + O2 = 2Cu
![]() 4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
![]() 2H2S + 3O2 = 2H2O + 2SO2
2H2S + 3O2 = 2H2O + 2SO2
Якщо суміш кисню і водню зберігати в скляній судині при кімнатній температурі, то екзотермічна реакція утворення води
![]() 2Н2 + O2= 2Н2O + 571 кДж
2Н2 + O2= 2Н2O + 571 кДж
протікає вкрай повільно; з розрахунку, перші крапельки води повинні з'явитися в судині приблизно через мільйон років. Але при внесенні в судину із сумішшю цих газів Платини чи Палладія (що грають роль каталізатора), а також при підпалюванні реакція протікає з вибухом.
З азотом N2 кисень чи реагує при високій температурі (близько 1500-2000 C), чи при пропущенні через суміш азоту і кисню електричного розряду. При цих умовах оборотно утвориться оксид азоту (ІІ):
![]() N2 + O2 = 2NO
N2 + O2 = 2NO
Утворений NO потім реагує з киснем з утворенням бурого газу (диоксида азоту):
![]() 2NO + O2 = 2NO2
2NO + O2 = 2NO2
З неметалів кисень прямо ні при яких умовах не взаємодіє з галогенами, з металів - зі шляхетними металами: Сріблом, Золотом, Платиною й н.
Бінарні сполуки кисню, у яких ступінь окислювання атомів кисню дорівнює -2, називають оксидами (колишня назва - окисли). Приклади оксидів: оксид вуглецю (ІV) CO2,оксид сірки (VІ) SO3, оксид міді (І) Cu2O, оксид алюмінію Al2O3, оксид марганцю (VІІ) Mn2O7.
Кисень утворює також сполуки, у яких його ступінь
окислювання дорівнює -1. Це - пероксиди (стара назва - перекиси), наприклад,
пероксид водню Н2O2, пероксид барію ВаО2,
пероксид натрію Na2O2 і інші. У цих сполуках міститься
пероксидне угруповання —O—O—.
З активними лужними металами, наприклад, з калієм, кисень може утворювати також
супероксиди, наприклад, KО2 (супероксид калію), RbО2
(супероксид рубідію). У супероксидах ступінь окислювання кисню -1/2. Можна
відзначити, що часто формули супероксидів записують як K2O4,
Rb2O4 і т.д.
Із самим активним неметалом фтором кисень утворить з'єднання в позитивних ступенях окислювання. Так, у з'єднанні O2F2 ступінь окислювання кисню +1, а в з'єднанні O2F - +2. Ці з'єднання належать не до оксидів, а до фторидам. Фториди кисню можна синтезувати тільки непрямим шляхом, наприклад, діючи фтором F2 на розведені водян розчини КОН.
Застосування кисню
Застосування кисню дуже різноманітно. Основна кількість одержуваного з повітря кисню використовуються в металургії. Кисневе (а не повітряне) дуття в домнах дозволяє істотно підвищувати швидкість доменного процесу, заощаджувати кокс і одержувати чавун кращої якості. Кисневе дуття застосовують у кисневих конвертерах при переділі чавуна в сталь. Чистий кисень чи повітря, збагачене киснем, використовується при одержанні і багатьох інших металів (міді, нікелю, свинцю й ін.). Кисень використовують при різанн зварюванні металів. При цьому застосовують "балонний" кисень. У балоні кисень може знаходитися під тиском до 15 Мпа. Балони з киснем пофарбовані в блакитний колір.
Рідкий кисень - потужний окислювач, його використовують як компонент ракетного палива. Просочені рідким киснем такі матеріали, як деревн опилки, вата, вугільний порошок та ін. (ці суміші називають оксиліквітами ), використовують як вибухові речовини, застосовувані, наприклад, при прокладц доріг у горах.
Біологічна роль кисню
Кисень в атмосфері Землі почав накопичуватися в результат
діяльності первинних фотосинтезуючих організмів, що з'явилися, імовірно,
близько 2,8 млрд. років тому. Вважають, що 2 млрд. років тому атмосфера вже
містила близько 1% кисню; поступово з відбудовної вона перетворювалася в окисну
приблизно 400 млн. років тому придбала сучасний склад. Наявність в атмосфер
кисню в значній мірі визначило характер біологічної еволюції. Аеробний (за
участю О2) обмін речовин виник пізніше анаеробного (без участі O2),
але саме реакції біологічного окислювання, більш ефективні, чим древн
енергетичні процеси шумування і гліколізу, постачають живі організми
здебільшого необхідної їм енергії. Виключення складають облігатні анаероби,
наприклад, деякі паразити, для яких кисень є отрутою.
Використання кисню, що володіє високим окислювально-відновним потенціалом, як
кінцевого акцептор електронів у ланцюзі дихальних ферментів, привело до
виникнення біохімічного механізму подиху сучасного типу. Цей механізм
забезпечує енергією аеробні організми.
Кисень - основний біогенний елемент, що входить до складу
молекул усіх найважливіших речовин, що забезпечують структуру і функції кліток
- білків, нуклеїнових кислот, вуглеводів, ліпідів, а також безліч
низькомолекулярних сполук. У кожній рослині чи тварині кисню набагато більше,
ніж будь-якого іншого елемента (у середньому близько 70%).
М'язова тканина людини містить 16% кисню, кісткова тканина - 28.5%; усього в
організмі середньої людини (маса тіла 70 кг) міститься 43 кг кисню. В організм
тварин і людини кисень надходить в основному через органи подиху (вільний
кисень) і з водою (зв'язаний кисень). Потреба організму в кисні визначається
рівнем (інтенсивністю) обміну речовин, що залежить від маси і поверхні тіла,
віку, статі, характеру харчування, зовнішніх умов і ін.
Невеликі кількост кисню використовують у медицині: киснем (з так званими кисневими подушками) дають якийсь час дихати хворим, у яких утруднений подих. Потрібно, однак, мати на увазі, що тривале вдихання повітря, збагаченого киснем, небезпечно для здоров'я людини. Високі концентрації кисню викликають у тканинах утворення вільних радикалів, що порушують структуру і функції біополімерів. Подібною дією на організм володіють і іонізуючі випромінювання. Тому зниження вмісту кисню (гіпоксія) у тканинах і клітках при опроміненні організму іонізуючою радіацією має захисну дію - так називаний кисневий ефект. Цей ефект використовують у променевій терапії: підвищуючи вміст кисню в пухлині і знижуючи його зміст у навколишніх тканинах підсилюють променеву поразку пухлинних кліток і зменшують ушкодження здорових. При деяких захворюваннях застосовують насичення організму киснем під підвищеним тиском - гіпербаричну оксигенацію.
Сульфур
Хімічні властивості
Хімічна активність сірки також доволі висока. При нагрівання вона реагує майже з усіма елементами.
1. Взаємодія з металами.
![]() 2Cu + S = Cu2S
2Cu + S = Cu2S
2. Взаємодія з неметалами.
![]() S + O2 = SO2↑
S + O2 = SO2↑
![]() H2 + S = H2S ↑
H2 + S = H2S ↑
Застосування. Найбільша маса сірки і природних сульфідів витрачається на вироблення сульфатної кислоти.
Оксиди сульфуру
Сульфур утворює два
кислотні оксиди: оксид сульфуру (IV) SO2 і оксид сульфуру (VI) SO3.
Оскид сульфуру (IV) SO2 (діоксид
сульфуру, сірчастий газ) – це безбарвний важкий газ (у 2,2 раза важчий за
повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко
розчиняється у воді (в 1л води при 200С розчиняється 43 л SO2.
Застосування. Найважливіша галузь застосування оксиду сульфуру (IV) SO2 – це виробництво сульфатної кислоти H2SO4.
Фізіологічна дія. Оксид сульфуру (IV) SO2 токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей.
Вплив на навколишн середовище. Діоксид сульфуру SO2 один з основних забрудників повітря, він отруює навколишнє середовище.
Звідки ж береться діоксид сульфуру SO2 у повітрі?
Природним джерелом SO2 є окислення сірководню H2S атмосферним киснем й озоном:
![]() 2H2S + 3O2 = 2SO2
+ 2H2O
2H2S + 3O2 = 2SO2
+ 2H2O
![]() H2S + O3 = SO2
+ H2O
H2S + O3 = SO2
+ H2O
Діоксид сульфуру SO2, потрапляючи у повітря, викликає утворення “кислотних дощів”, шкідливих для усього живого.
Оксид сульфуру (IV) SO3 (триоксид сульфуру) – безбарвна рідина, яка за температури, нижчої від 170С, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже легка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки. Зберігають його у запаяних скляних посудинах.
Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
![]() SO3 + H2O = H2SO4
SO3 + H2O = H2SO4
Застосовується оксид сульфуру (IV) SO3 у виробництві сульфатної кислоти H2SO4. У лабораторній практиці він використовується як водовбирний засіб.
Сульфатна кислота
Сульфатна кислота H2SO4 (безводна, 100%-ва) – важка безбарвна оліїста рідина. Густина концентрованого розчину (w(H2SO4) = 98%) за стандартних умов 1,84 г/см3. вона нелегка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у вод супроводжується виділенням великої куль ості теплоти, що може призвести до закипання води і розбризкування кислоти.
Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот:
ü Зміна кольору індикатора.
ü Дисоціація кислоти.
І ступінь H2SO4 D Н+ + HSO -4 – гідрогенсульфат-іон
ІІ ступінь HSO –4 D Н+ + SO -24 – сульфат-іон.
ü Взаємодія з основами.
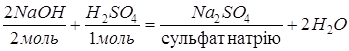
![]()
ü Взаємодію з оксидами металів.
MgO + H2SO4 = MgSO4 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ü 5. Взаємодія з солями.
Na2CO3 + H2SO4 = Na2SO4 + CO2# + H2O
2KNO3 + H2SO4 = K2SO4 + 2HNO3#
ü 6. Взаємодія з металами.
Mg + H2SO4 = MgSO4 + H2#
Zn + H2SO4 = ZnSO4 + H2#
Fe + H2SO4 = FeSO4 + H2#
Застосування сульфатної кислоти і сульфатів
Сульфатна кислота є важливим продуктом хімічної промисловості. Вона у великих кількостях застосовується у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, у металургії в процесі добування міді. Нікелю, урану та інших металів. Використовується також як осушувач газів.
Серед сульфатів велике практичне значення мають мідний і залізний купороси CuSO4 ® 5H2O i FeSO4 ® 7H2O.
Чесна Сірка і Нечиста Сила
«ПОРТРЕТ»
Сульфур незвичайний хімічний елемент. Ще на зорі цивілізації він ввійшов до міфів священних обрядів. На Близькому Сході, а пізніше в християнській Європі сірку вважали речовиною пекла; запах палаючої сірки став ознакою диявола.
Але
елемент № 16 — це не тільки містика. Він брав участь у природних катаклізмах
біохімічних процесах, його вивчали хіміки й металурги, використовували лікарі,
садівники, ткачі, сукновали, капелюшники. У наш час сірчана кислота стала
однією з головних речовин хімічної промисловості.
Деякі способи застосування сірки чисті, гуманні й шляхетні, інші мимовол
нагадують про диявола й нечисту силу.
Що ж особливого в цьому шістнадцятому елементі, чому його згадують у творах містиків, художній літературі й навіть у Біблії?
Почасти це пов'язано з поширенням Сульфуру в природі, почасти — із його хімічними властивостями. Сульфуру дуже багато в земній корі — 0,05 % за вагою. Подекуди в Середземномор'ї і на Близькому Сході сірки повнісінько в ґрунті в самородному вигляді. Сірка (жовтий камінь) там зазвичай утворювалася при відновленн сульфатів бактеріями. Особливо багато жовтого каменю було на Сицилії, там його добувають із давнини до наших днів. Домішки бітумів, карбонатів, сульфатів, глини іноді надавали йому незвичайного кольору, аж до червоного, бурого і чорного.
Поблизу від вулканів зустрічаються жовті натіки, кірки й кристали сірки. Елемент виривався з надр у вигляді сірководню, при окислюванні якого виділявся у вільному вигляді. Жителі Апеннін і Балкан, Малої Азії і Близького Сходу добре знали про ядучі випаровування, що виходили із землі в деяких місцях. їх можна було, наприклад, спостерігати поблизу Неаполя, де розташовані Флегрейські поля накопичення валів, тріщин, провалів. Часом їх застеляють дим і сірчистий газ. Вважалося, що там олімпійські боги боролися з гігантами.
Сульфур також входить до складу нафти, асфальту, бітуму. При горінні цих речовин поширювався характерний запах, за яким безпомилково впізнавали сірку. До речі, усупереч поширеній думці, пахне не сам Сульфур, а його сполуки: сірчистий газ, сірководні й меркаптани, відомі своїм смородом. У вологому повітрі здрібнена сірка окислюється й перетворюється на сірчистий газ. Саме його мали на увазі, коли говорили про запах сірки.
ВИНУВАТИЦЯ НЕЩАСТЬ
В сторії стосунків сірки й людей були темні сторінки. Виділяючись із вулканів вулканічних тріщин, сульфур оксид, або сірководень, траплялося, вбивав тисяч нещасливих. Це трапилося з давньогрецьким ученим Плінієм Старшим, що загинув під час виверження Везувію, і з безліччю інших людей.
Багато шкоди завдавали домішки сірки: псували метали, знижуючи їхню міцність. І тому з давнини до наших днів одне з головних завдань металургів — очистити руду від домішок сірки.
Металургія
в давнину була оточена таємницею. І пізніше, у середні віки, ковалі були
особливими людьми, їх вважали кимсь на зразок чаклунів. А на початку нашої ери
зі спроб удосконалити метали виникла алхімія. Багато сульфідів блищать, мов
метали. Серед них пірит, залізний колчедан (FeS2), халькозин, або мідний блиск (CuS2), халькопірит,
або мідний колчедан (CuFeS2). Шість із семи металів, відомих древнім, зустрічаються у вигляд
сульфідів. Можливо, алхіміки вважали ці руди недосконалими металами, у яких
одна цінна якість — блиск і немає іншої — ковкості.
Однак з них шляхом випалу й відновлення можна було одержати справжні метали.
Оскільки при прожарюванні на повітрі з них виділявся сірчистий газ, алхіміки
могли визнати сірку складовою частиною будь-якої руди і будь-якого металу,
навіть золота.
Сіркою називали «горюче начало» металів, адже при випалюванні вона вигорала.
Іншою складовою частиною, що відповідає за ковкість, вважали ртуть.
Перш християни уникали язичеської мудрості й ставилися до алхіміків вороже. Можливо, вони приписували недоступне їм знання підступам нечистої сили. Пізніше церква примирилася з алхімією, однак під час переходу від феодалізму до капіталізму хні стосунки знову зіпсувалися. Налякані інквізицією люди, у тому числі й освічені, знову почали вважати алхімію підозрілим, чаклунським заняттям, і не дивно, що вони пов'язували її з підступом диявола.
На жаль, свідоме використання сірки принесло не менше лиха, ніж її випадкова участь у людських справах. Найгіршими словами можна згадати чорний порох. Мільйони убитих людей, зруйновані фортеці й міста, катастрофи на порохових заводах, поневолення народів, і, між іншим, винищування багатьох видів тварин ось рахунок, який можна висунути його користувачам. Чим не диявольське зілля? Саме так і називали його в Європі, як тільки він там з'явився, що, однак, не заважало нарощувати виробництво чорного пороху.
На рахунку іприту жертв менше, але його застосування в XX столітті як бойово отруйної речовини злякало громадськість європейських країн. Цю сполуку, схожу за запахом на гірчицю (через це її Ще називали гірчичним газом), уперше випустили на ворога німецькі війська. 12 липня 1917 року біля бельгійського міста Іпр хмари отруйного газу покрили англо-французькі частини. Чи міг подумати академік Зелінський, який відкрив у 1886 році дихлордіетилсульфід, що синтезована ним сполука одержить назву іприт і стане причиною загибелі й каліцтв 40 тисяч людей тільки в Першій світовій війні? Що мільйони снарядів з цією речовиною скинуть у Балтійське море або відправлять на склади, де вони будуть поступово руйнуватися, загрожуючи новими катастрофами?
Не до таких страшних, але все-таки неприємних наслідків призводило спалювання сірки разом із корисними копалинами Коли почалася промислова революція кочегари почали годувати вугіллям ненаситні топки, сульфур оксид разом із димом вилітав у трубу.
До
тих самих наслідків призводило і спалювання нафти, і видобуток самої сірки,
коли її виварювали з породи.
І тільки кілька десятиліть тому вчені з'ясували, що сірчистий газ не просто
забруднює повітря, але багато його перетворюється на кислотні дощі, які гублять
рослини. При цьому особливо страждають хвойні ліси.
У темних справах були помічені не тільки сам Сульфур та двоокис, але також сірководень. Цей газ виділяється з тріщин поблизу вулканів і утворюється при гнитті органічних залишків, які завжди містять Сульфур. І хоча він чимало попрацював у хімічних лабораторіях, де з його допомогою проводили якісний аналіз металів і їхніх солей, сморід і отруйність створили йому досить погану репутацію.
Ще один прояв сірки може посісти хоч і скромне, але цікаве місце в цьому
списку. Відьми, чаклуни, маги тощо, трапляється, спалюють волосся ворога або
замовника. При цьому утворюється сірчистий газ, адже у волоссі молекули білка
кератину скріплені атомами Сульфуру.
НА СТОРОЖІ ЧИСТОТИ
Не
слід пов'язувати сірку з витівками нечистої сили. Відповідно до Біблії, сам
Господь використовував її для покарання грішників на землі, у Содомі й Гоморрі,
під землею, у пеклі.
Мабуть, саме тому в ХШ—XVII століттях у Європі, яка марила дияволом, нечисту силу пов'язували із
запахом сірки. Люди теж із незапам'ятних часів застосовували сірку приблизно з
цією ж метою Одіссей, наприклад, винищивши ненависних кандидатів на руку
Пенелопи, знищував сам їхній дух, спалюючи сірку. Сіркою язичницькі жерц
обкурювали храми під час церемоній. Можливо, вони здогадувалися, що в такий
спосіб можна припинити поширення заразних хвороб. Мабуть, і ця процедура
зіграла свою роль у приписуванні нечистій силі запаху сірки, адже для перших
християн язичницькі жерці були слугами диявола. Як би там не було, такий спосіб
дезінфекції щасливо дожив до початку XX століття. Лікарі, щоправда, зазначали, що він
допомагає не при будь-якій інфекції, зате досить зручний, а іноді (наприклад,
при знищенні збудників холери на поверхні предметів) і цілком надійний.
У медицині сірка знайшла безліч інших застосувань. її часто використовували у вигляді мазі при шкірних захворюваннях. Великий філософ, лікар Авіценна в «Каноні медицини» наводить рецепти не менше двох десятків ліків, до складу яких входить сірка. Ртутним ефіопом (чорним меркурій сульфідом) кіновар'ю (червоним меркурій сульфідом) арабські медики лікували шкірн хвороби, а купрум і цинк сульфідом — очні. Великий лікар середньовіччя Парацельс вважав, що лихоманка й чума виникають від надлишку в організмі Сульфуру. Правда, він розумів під нею не елемент, а якесь міфічне начало: якщо воно було в природі (макрокосмі), воно повинно було входити і до складу людини (мікрокосму).
Дерматологи дотепер виписують препарати сірки для лікування корости грибкових захворювань. «При взаємодії сірки з органічними речовинами утворюються сульфіди та пентатіонова кислота, які характеризуються протимікробною протипаразитною дією», — пише з цього приводу авторитетний медичний довідник. До речі, саме цю мазь варила в каструльці булгаковська героїня, відьма Гелла, нею вона лікувала хворе коліно Воланда.
Атоми Сульфуру входять до складу величезної кількості ліків, перерахувати які неможливо. Найвідоміші серед них — сульфаніламідні препарати. Вони зв'язуються з одним із ферментів, що виробляється мікроорганізмом, й інгібують його, тобто не дають ферментові захоплювати з цитоплазми параамінобензойну кислоту й синтезувати фолієву. У результаті так мікроорганізми гинуть. Подібні препарати застосовують і у ветеринарії.
Сірка
допомагає боротися з комахами, кліщами і хворобами рослин, які викликає та ж
сама «погань»: бактерії й гриби.
Мелену й колоїдну сірку, вапняно-сірчаний відвар протягом тривалого часу
використовували для захисту рослин від грибкових захворювань: борошнистої роси,
гнилизни, парші, плямистості. Не було забутим і давнє обкурювання.Сполуками
Сульфуру консервували плоди й овочі, захищали кораблі від обростання
рибальські мережі від гниття. Порошком сірки знешкоджують пролиту ртуть.
Нарешті, сірка допомагає наводити чистоту в буквальному значенні: сульфатна група входить до складу молекул синтетичних миючих засобів.
СУЛЬФУР В ОРГАНІЗМІ - ВНУТРІШНІЙ ОХОРОНЕЦЬ
У нашому організмі теж є кілька сполук Сульфуру, призначених для захисту, насамперед — для знешкодження агресивних сполук, що утворюються при окислюванн органічних речовин. Входить Сульфур і до складу коферменту А однієї з ключових сполук в обміні білків, жирів і вуглеводів. Саме він спрямовує реакції, у ході яких із цих речовин утворюється енергія. А оскільки енергія потрібна для боротьби з будь-якими шкідливими впливами, чи то віруси, чи бактерії або отрути, кофермент А можна вважати важливим борцем за здоров'я організму і його внутрішню чистоту.
Сульфур входить до складу безлічі сполук усередині нас і ззовні. Серед них є отрути та протиотрути, речовини агресивні й захисні, причетні до чистоти й пов'язані з нечистотами. Колись сірку вважали знаряддям кари для грішників, міткою нечистої сили, містичним началом металів. У наші дні відомості про отруйність пестицидів, що містять Сульфур, із науки перекочовують у міфи індустріально епохи. Історія продовжується.
Додаток:Поняття про алотропію.
Хімічн елементи у вільному стані існують у формі простих речовин. Так, елемент Оксиген утворює дві прості речовини – кисень О2 та озон О3.
Озон. Якщо на кисень подіяти електричним розрядом, то з’являється характерний запах свіжості – утворюється газоподібний озон:
Кисень поглинає енергію і перетворюється на озон, а озон самовільно розкладається, утворюючи кисень.
Обидв прості речовини – кисень О2 і озон О3 – утворені одним тим самим хімічним елементом – Оксигеном, а властивості у них різні.
Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою, називається алотропією, а сам прості речовини – алотропними формами (модифікаціями).
Властивості кисню й озону.
| Властивост простих речовин | Прості речовини | |
| кисень | озон | |
| Агрегатний стан за стандартних умов | Газ | Газ |
| Колір | Безбарвний | Синій |
| Запах | Без запаху | Різкий, своєрідний |
|
Розчинність (у 100 об’ємах Н2О при 200С) |
3 об’єми | 49 об’ємів |
| Густина газу за н.у. | 1,43 г/л | 2,14 г/л |
| Температура кипіння |
-1930С |
-1120С |
| Температура плавлення |
-2190С |
-1920С |
| Фізіологічна дія | Неотруйна | Дуже отруйний |
| Хімічні властивості | Окисник | Дуже сильний окисник |
| Реакційна здатність | Висока | Дуже висока |
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральний масел; як дезинфікуючий засіб у медицині; як окисник ракетного палива.
Проте буває й інша причина алотропії – різна структура кристалів. З таким типом алотропії можна ознайомитися на прикладі сірки.
Сірка за стандартних умов – крихка кристалічна речовина жовтого кольору. Погано проводить теплоту і не проводить електричного струму. У воді не розчиняється краще розчиняється в деяких розчинниках (у сірковуглеці CS2, бензині, етері та ін.).
І в розчинах, і в кристалах сірка складається з циклічних молекул S8, які за формою нагадують корону. Але в кристалах ці молекули можуть бути упаковані по-різному.
Якщо молекули розташовані щільно, утворюється алотропна форма ромбічна сірка. Менш щільне упакування молекул спричинює виникнення іншої алотропної форми моноклінної сірки.
Якщо сірку розплавити і швидко охолодити, утворюється ще одна алотропна форма: пластична сірка – коричнева губоподібна маса.
Властивості ромбічної і моноклінної сірки
| Властивості простих речовин | Сірка | |
| ромбічна | моноклінна | |
| Колір | Лимонно-жовтий | Блідо-жовтий, майже безбарвний |
| Густина | 2,07 г/л | 1,96 г/л |
| Температура плавлення |
112,80С |
119,30С |
© 2009 База Рефератов