
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Производство алюминия
Реферат: Производство алюминия
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУ СПО БРАТСКИЙ ИНДУСТРИАЛЬНЫЙ ТЕХНИКУМ
РЕФЕРАТ
На тему: Производство алюминия”
Выполнила:
студентка гр. МЦ – 03
Черкасова К.С.
Проверил:
Щиколдин Николай Викторович
Братск – 2008.
Содержание
1. Состав и свойства электролита
2. Строение криолито – глиноземных расплавов
3. Плотность алюминия электролита
4. Электропроводность КГР
5. Поверхностное натяжение
6. Давление насыщенного пара
7. Напряжение разложения
8. Механизм электролиза КГР
9. Анодный эффект положительные и отрицательные действия
10. Расчет производительности электролизера, выходы по току, выходы по энергии удельного расхода электроэнергии. Влияние различных факторов на выход по току
11. Технологические параметры катодного узла
1. Состав и свойства электролита
В электрохимическом ряду Al занимает место среди наиболее отрицательных Me поэтому его нельзя выделить из водных расплавов.
До настоящего времени единственной солью до получения Al является криолит Na3 Al F6.
1. Криолит (Na3 Al F6) – 75 - 90 %.
2. Глинозем (Al2 O3) – 1 - 10 %.
![]() 3. Al F3 – 5 – 12 %.
3. Al F3 – 5 – 12 %.
4. Ca F2 – 4 – 6 % неболее ∑ 8-10%
5. Mg F2 – 6 %
К электролиту алюминиевых электролизеров предъявляют требования:
1. В расплавленном состоянии должен хорошо растворяться Al2 O3.
2. Температура плавления при растворении Al2O3 не должна быть намного выше, чем температура плавления Al.
3. Плотность должна быть ниже, чем у Al.
4. Должен быть жидкотекучим, что способствуют легкому удалению анодных газов, быстрому выравниванию состава электролита по всему объему ванны, уменьшению потерь Al в результате запутывания корольков Me в расплаве.
5. Должен быть электропроводным.
6. Упругость насыщенного пара компонентов электролита должна быть по возможности более низкой.
7. Не должна быть широскопичным.
8. Все материалы, поступающие на электролиз, должны иметь минимальное содержание примесей, более электроположительных, чем Al (Fe; Si; Cu и другие) поскольку эти примеси почти полностью переходят в Me и загрязняют его.
9. Не должен химически взаимодействовать с футеровкой электролиза.
Криолит Na3 Al F6 – комплексная соль, состоящая из второв натрия и Al (3 NaF AlF3). Температура плавления примерно 1010 0 C.
AlF3 имеет кристаллическую решетку, в узлах которой находятся октаэдрические полы Al F6-3 , соединенные общими полами F. В решетке реализуется значительная доля ковалентных связей, что является причиной малой ее прочности. – Al F3 – возгоняется без плавления, имеет высокое давление насыщенного пара.
Al F3 – самый летучий компонент, широскопичный, подвержен гидролизу влагой, содержащейся в атмосферном воздухе.
Другие компоненты – NaF, CaF2, MgF2, NaCl и LiF – являются чистополлыми соединениями, они плавятся без разложения и устойчивы к действию влаги.
Для производства Al применяют высшие сорта Al2O3, содержание оксидов Fe и Si которых составляет 0,03 и 0,08 % и 0,02 – 0,2 %.
Технический глинозем содержит две полиморфные модификации – £ и j
£ - характеризуется высокой плотностью кристаллической решетки, большой химической стойкостью и твердостью 25 – 30 % £ Al2O3.
j – имеет менее плотную решетку, очень гигроскопична и химически активна – 65 – 70 % j Al2O3.
В результате нагрева, начиная с 9500С происходит полиморфное превращение j в £.
При большом содержании £ - Al2O3 затруднено растворение Al2O3 в криолите, а при меньшем его содержании возрастает гигроскопичность Al2O3.
Электролит содержит в небольших количествах некоторые другие вещества, образующиеся за счет примесей, вносимых с сырьем или вводимых специально для улучшения физико-химических свойств расплава (CaF2MgF2; NaCe; LiF).
Криолитовое отношение (КО) – это молекулярное отношение NaF/AlF3.
Для чистого криолита КО = 3. Электролиты содержащие избыток NaF и КО > 3, называются щелочным, имеющие избыток AlF3 и КО < 3, называются кислыми. Нормальный электролит – кислый, но в некоторые периоды эксплуатации электролизеров он м/б щелочным.
Промышленные электролиты содержат небольшой избыток AlF3.
На заводах КО обычно поддерживают 2,6 – 2,8.
Избыток F ведет к снижению to промышленности электролита.
Два раза в неделю берут пробы на КО, в лаборатории делают анализ, и по данным анализа корректируют состав электролита фтористым алюминием (AlF3).
2. Строение криолито – глиноземных расплавов
Расплавы Na F – AlF3. Зависимости электропроводности кристаллических NaF и Na3Al6 от температуры отличаются характерной особенностью: электропроводность криолита оказывается на 1-2 порядка выше, чем для кристаллического NaF; при 565 0С, когда происходит полиморфное превращение и увеличиваются расстояния между ионами Na+ и F-, на политерме электропроводимости криолита имеется скачек.
Структура криолита в твердом состоянии характеризуется высокой степенью разупорядоченности: ионы Na+, находящиеся в межузлиях кристаллической решетки, особенно при т выше 5650С, обладают большой подвижностью, обеспечивая высокую проводность криолита.
Еще до т. плавления криолита в твердом состоянии происходит термическая диссоциация криолитовых комплексов:
AlF6-3 = AlF4- + 2F-
При переходе через точку плавления эта диссоциация усиливается еще в большей степени, однако определенная концентрация криолитовых комплексов остается в расплаве, что и определяет наличие максимумов на диаграммах плотности и вязкости.
Хиолит Na5AL3F14 в твердом состоянии имеет слоистую решетку, образованную октаэдрами AlF6-3. При плавлении происходит распад этого соединения. Над расплавом хиолита пар состоит из криолита и тетрафторалюмината натрия. Это означает, что и в расплаве существуют ионные группировки, отвечающие этим соединениям, (комплексные ионы AlF6-3 и AlF4-).
Тетрафторолюминат натрия NaAlF4 имеет кристаллическую решетку, в узлах которой находятся ионы Na+ и октаэдры связи между этими ионами в значительной степени имеют ковалентный характер.
В жидком состоянии NaAlF4 довольно устойчив, что подтверждается азеотропностью данного соединения (в равновесии состав жидкости и пара над NaAlF4 одинаков).
Таким образом, расплавы системы NaF – AlF3 состоят из ионов: Na+, F-, AlF6-3 и AlF4-. Комплексные ионы AlF63- AlF4- имеют динамическую природу: возникая в одном месте, они распадаются в другом, и их следует рассматривать как временные упорядоченности ионов F- вокруг Al3+.
Расплавы системы Na3 AlF6-3Al2 O3. В данной системе расплава криолит растворяет оксиды, в отличие от других си тем. Предполагается, что растворение глинозема в криолите связано с обменом ионами F- и О2- между анионами AlF6-3расплавленного криолита и решеткой глинозема. Катионы Al3+, принадлежащие криолиту, вырывают своим сильным полем анионы О2- из решетки глинозема. В результате этого обмена целостность кристаллической решетки глинозема нарушается и глинозем растворяется.
Таким образом растворителем” глинозема и других оксидов в криолите является ион Al3+, входящий в криолитовые комплексы AlF6-3и AlF4-.
В результате обмена F- на О2- в окружении ионов Al3+ происходит образование новых оксифторидных комплексов типа AlOFx1-x, где х = 2-5. Простейший из таких комплексов AlOF2. Образование его можно представить схемой:
Na3 AlF6 + 3Al2 O3 = 3Na Al2 O3.
По данной реакции на каждую молекулу глинозема образуется три новых оксифторидных иона AlOF2-.
Растворение глинозема в криолите сопровождается заметным взаимодействием криолита и глинозема. Объяснение этого состоит в том, что оксофторидные комплексы не имеют строго определенного состава: по мере роста концентрации растворенного глинозема строения оксифторидных комплексов усложняется, соотношение количеств ионов фтора и кислорода в них понижается. При больших концентрациях Al2 O3 в заэвтектической области, по-видимому, образуются сетки из алюминий-кислородных ионов с включенными в них ионами фтора. Вязкость таких расплавов резко увеличивается.
При равновесии кристаллизации происходит разрушение комплексов, и криолит кристаллизируется отдельно от глинозема. При закалке образуется твердый раствор глинозема в криолите.
Таким образом, глинозем, вводимый в криолитовый расплав, вступает в взаимодействие с криолитовыми комплексами и образует оксофторидные комплексы переменного состава. Расплав состоит из ионов: Na+, F-, AlF63-, AlF4-, AlOFхх-1.
3. Плотность Al и электролита
В твердом виде 2,95г/ м3; Al – 2,7г/см3; Al2O3 – 3,9г/см3. В расплавленном состоянии плотность Al примерно на 10% выше, чем криолито-глиноземного расплава, что вполне достаточно для его разделения. Плотность криолита и Al в расплавленном состоянии зависит от температуры:
- для Al: £ = 2,382 – 0,000273 (t 6590).
- для криолита: £ = 2,112 – 0,00093 (t 10000).
Добавки к криолиту NaF; AlF3; Al2O3 снижают плотность расплава. С повышением температуры плотность криолито-глиноземного расплава, как и чистого криолита понижается.
Для расплава, содержащего 5% Al2O3 при 9600C плотность равняется 2,1 г/см3, плотность Al – 2,3 г/см3.
Плотность Al с повышением температуры понижается медленнее, чем плотность криолито-глиноземного расплава. При понижении температуры плотность криолита, Al2O3, Al увеличивается не в одинаковой степени. Так как у криолита это происходит быстрее, при снижении температуры может наступить такой момент, когда плотности Me и электролита будут близки и произойдет их перемешивание. При этом Me может всплыть на поверхность, что нарушит процесс электролиза.
4. Электропроводность КГР
Электропроводность важное свойство электролита. Это свойство зависит от структуры расплава, поскольку перенос тока обусловлен движением ионов, их природой и взаимодействием между ними. Для электролиза важно иметь наиболее электропроводные электролиты, так как повышение электропроводимости позволяет увеличить плотность тока без нарушения теплового равновесия электролизера, то есть, интенсифицировать процесс электролиза.
Наиболее высокой электропроводностью обладает чистый Na F. Удельная электропроводность электролита падает с возрастанием содержания Al F3, подчиняясь линейной зависимости.
Удельная электропроводимость Na F при t = 10000C = 4,46 ом см -1, криолит = 2,67 ом 40% Al F3 = 2,01 ом
Удельная электропроводимость криолито-глиноземного расплава является линейной функцией содержания Al2 O3.
При содержании Al2 O3 в криолите от 2 до 15% удельная электропроводность расплава уменьшается от 2,6 до 1,9 ом см. При расчетах пользуются обратной величиной удельным сопротивлением. Для расплава с 2% Al2 O3 при t0 = 10000C удельное сопротивление: P = 1/2,6 = 0,385 ом см.
Электропроводность Al зависит от содержания в нем примесей. Чем выше сортность Al, тем больше электропроводность. С повышением температуры расплавов электропроводность увеличивается. Промышленный электролит кроме основного состава всегда имеет взвесь – частиц угольной пены. Это частицы, попавшие в электролит в результате неполного окисления анода.
Несмотря на то, что уголь имеет электропроводимость на три порядка выше, чем электролит, наличие угольных частиц приводит к уменьшению электропроводимости электролита.
Кроме угольных частиц м/б взвеси Al2O3 – они не проводят ток и снижают электропроводимость расплава.
Считается, что в среднем промышленные электролиты имеют электропроводимость на 5% меньше, чем расплавы из чистых компонентов.
5. Поверхностное натяжение
Свойство слоев жидкости на границе с газом, другой жидкостью или с твердым телом, отличаются от свойств ее в глубине. Это обуславливается различными силами взаимодействия между частицами внутри жидкости и между частицами, составляющие другие фазы.
Поверхностное натяжение это избыток свободной энергии в поверхностном слое жидкости на границе раздела двух фаз, отнесенной к единице площади поверхности (длина / см2). При электролизе криолита – глиноземных расплавов представляет интерес поверхностное натяжение на границах; расплав – газ; Me – газ; расплав – Me, а так же смачиваемость твердых углеродистых материалов криолита глиноземных расплавов и Me.
Наибольшим поверхностным натяжением на границе с газовой фазой обладает Na F – 199,8 дни / см2 при t = 10000С.
С повышением Al F3 поверхностное натяжение понижается, и для криолита оно составляет 145,5 дни / см2, а для смеси с 50% Al F3 – 86,3 дни / см2. Поверхностное натяжение не зависит от содержания Al2O3 в расплаве. Поверхностное натяжение металлического Al при t = 10000C более, чем в три раза выше, чем криолита.
Поверхностное натяжение особенно важно для практики электролиза, для уяснения таких явлений как смачивание электролитом угольной футеровки, образование и поведение пузырька газа на поверхности угольного анода, всплывание частиц угольной “пены”.
Поверхностное натяжение можно определить посредствам ряда методов из которых наиболее приемлемым является метод максимального давления газа в пузырьке. Зависимость поверхностного натяжения от t0C обычно выражается прямой линией. Чем выше t0C, тем ниже поверхностное натяжение.
При t0 электролиза натяжения для алюминия составляет 459 м Н/м.
6. Давление насыщенного пара
Зависимость давления насыщенного пара веществ от состава расплава дает важную информацию о термодинамических свойствах этих веществ. Величины давления пара имеют практическое значение – позволяют подобрать электролиты, обладающие меньшей летучестью, что важно для уменьшения потерь ценных составляющих электролита и загрязнения окружающей среды вредными парами фтористых соединений и продуктами их гидролиза.
Давление пара криолито-глинозенмых расплавов измеряют методами точек кипения и уноса. Первый метод позволяет определить суммарное давление пара. Второй метод позволяет определить парциальные давления компонентов расплава. Наибольшей упругостью паров, из компонентов электролита алюминиевой ванны, обладает фтористый Al. Он же, имеет самую низкую температуру кипения.
Разная упругость паров компонентов электролита обуславливает различную их летучесть при электролизе. Обладающий наибольшей упругостью паров фтористый Al является наиболее летучим компонентом электролита. Преимущественное улетучивание Al F3 при электролизе приводит к потерям его и к изменению состава электролита. С повышением температуры летучесть электролита и, следовательно, его потери увеличиваются.
Добавки Ca F2 и Mg F2 снижают летучесть электролита. При электролизе криолито-глинозенмых расплавов, содержащих Na Ce, в газообразных продуктах электролиза появляется хлористый H, который образуется в результате реакции:
Al F3 + 3Na Ce = Al Ce3 + 3Na F
2Al Ce3 + 3H2O = Al2O3 + 6H Ce
Образующийся Al Ce3 частично возгоняется и под действием влаги воздуха разлагается во второй реакции.
При увеличении содержания Al2 О3 в системе триолит-глинозем давление насыщенных паров всех компонентов системы понижается. При t0 = 10000C и содержании 15% Al2 O3 в криолите сумма паров всех компонентов составляет 3,62 мм. рт. ст. что в два раза ниже давления пара криолита.
Давление насыщенного пара Al при t = 9500C - 9700C незначительно.
Al под слоем электролита практически не испаряется.
7. Напряжение разложения
Напряжение разложения это наименьшая величина внешней электродвижущей силы, приложенной к электродам электролизера, при которой начинается длительный электролиз. При инертном аноде напряжение разложения глинозема по реакции:
Al2O3 ↔ 2Al + 1 1/2O2
составляет 2,19 В. При угольном аноде напряжение разложения Аl2O3 по реакции:
2Al2O3 + 3C ↔ 4Al + 3CO2, составляет1,167 В и по реакции: Al2O3 + 3C ↔ 2Al + 3CO
напряжение разложения составляет 1,034 В.
Экспериментальные значения напряжения разложения, полученные на промышленных электролизерах в результате изменения обратной электродвижущей силы составляют 1,37-1,78 В.
При промышленных анодных плотностях тока около 1 А/см2 о. э. д. с. находятся в пределах 1,4-1,8 В. Величина о. э. д. с. и перенапряжение растет с увеличение плотности тока и уменьшается с повышение температуры и увеличением активности углеродистого материала анода. Величины обратимых напряжений разложения других компонентов электролита – AlF3, NaF, MgF2, CaF2 значительно выше напряжения разложения глинозема и соответственно равны 3,97; 4,37; 4,61; и 5,16 В.
8. Механизм электролиза криолито-глинозенмых расплавов (КГР)
В расплаве электролита присутствуют ионы (+) и (-).
Na+; AlF3(-3) AlF4(-); Al+3,
F(-) Ca+2 Mg+2; O2-2,
Al2O3 ↔ 2Al++1 ½ О2 –
Со и СО2
В то же время при взаимодействии Со и СО2
При электролизе ток переносит всеми ионами, но в соответствии с величиной разряда потенциалов на электроде будут разряжаться
ионы Al и O2
катод Al+3 + 3e → Al
анод 2O-2 4e + C → CO2 60%
анод C + CO2 = 2CO 40%
Катодный процесс представляется разрушением оксифторидных анионов с выделением алюминия и обогащением прикатодного слоя ионами. В прикатодном слое накапливаются ионы, необходимые для образования фтористого натрия и алюминия натрия.
В нормально работающем промышленном электролизе электролит постоянно находится в движении. Он циркулирует за счет конвективных потоков, движения анодных газов и катодного металла. В этом движении электролит перемешивается, и избыток фтористого натрия и алюминия натрия в прикатодном слое и фтористого алюминия в прикатодном слое исчезает, восстанавливается первоначальный состав электролита:
6NaF + Na3AlO3 + 4AlF3 ↔ 3Na3AlF6 + Al2O3.
Однако электролит постепенно обедняется глиноземом. Конечным результатом процесса является расходование 1 моля глинозема.
При электролизе алюминия параллельно с основным процессом идут побочные (на катоде, на аноде), которые осложняют нормальный ход электролиза, снижается выход алюминия, повышается расход электроэнергии, снижается стойкость футеровочных материалов и другое.
Побочный процесс на катоде осложняется двумя явлениями: растворением алюминия и выделением на катоде натрия. Растворимость алюминия в электролите увеличивается с повышением температуры электролита и содержания в нем фтористого натрия. Растворенный алюминий в процессе электролиза переносится к аноду и к поверхности электролита, где он окисляется анодными газами и кислородом воздуха:
3AlF+3CO2=AlF3+3CO+Al2O3;
3AlF+3CO=AlF3+C=Al2O3.
Эти реакции обуславливают потерю алюминия при электролизе, обогащение анодных газов окисью углерода и появления в электролите очень мелких частиц углерода.
Другое осложнение катодного процесса – это разряд катионов Na+, который всегда содержится в алюминии при его производстве. Количество выделившегося натрия зависит от криолитового отношения (КО) электролита. При снижении КО с 3 до 2,5 содержание натрия снижается в 2,5 раза. При температуре электролита выше 10000С каждые 100С приводят к росту содержания натрия на 0,001%. Содержание натрия увеличивается также во время анодных эффектов.
Таким образом, чтобы обеспечить минимальный разряд натрия и наибольший выход алюминия, необходимо поддерживать низкую температуру электролита (955-9600С),- КО=2,6-2,8 и не допускать большего числа анодных эффектов.
Существуют и другие побочные процессы: анодный эффект, образование в ванне карбонада алюминия Al4C3, также различные примеси, которые попадают с сырьем в электролизер (окислы железа, кремния, кальция, титана, сульфаты, фосфаты и т.д.).
9. Анодный эффект положительные и отрицательные действия
Периодически возникающий искровой анодный разряд, наблюдаемый на аноде при электролизе криолито-глиноземного расплава, называется анодным эффектом. На практике называют - «вспышками». Вспышки возникают при снижении концентрации глинозема в электролизе от 1 – 1,5%. При этом рабочее напряжение на электролизе резко поднимается – с 4,2-4,3 до 25-30 В.
Поскольку анодный эффект связан с обеднением электролита глиноземом, то добавка новой порции глинозема и перемешивание электролита быстро устраняет анодный эффект и восстанавливается нормальный ход электролиза в пределах нормы 4,3-4,5V.
Возникновение анодного эффекта происходит из-за ухудшения смачиваемость подошвы анода расплавленным электролитом вследствие уменьшения содержания глинозема:
Al2O3 в электролите до 1-1,5%.
Когда электролит хорошо смачивает анод, газообразные продукты электролиза не могут удержаться на подошве анода и выделяются из электролиза в виде пузырьков. С уменьшением содержания глинозема в электролите отрыв пузырьков от подошвы затруднен, что увеличивает сопротивление и на электролизере И- увеличивается с 4,5 V до 25-30 V. Мелкие пузырьки сливаются в большие и оттесняют электролит от подошвы анода, постепенно образуя сплошную газовую прослойку между анодом и электролитом. В результате этого плотность тока на тех участках, где еще идет ток, резко возрастает, увеличивается сопротивление прохождению электрического тока, возрастает напряжение на ванне и возникает анодный эффект.
Анодный эффект бывает:
тусклые – до 15V
средние – до 15-25V
ясные – 25 и вышеV
Анодный эффект играет положительную и отрицательную роль в электролизе Al.
Положительная роль анодного эффекта дает возможность контролировать нормальную работу электролизера.
Допустимая чистота (А.Э.) 0,8-1,0 а.э. в сутки. Считается я, что при возникновении анодного эффекта полируется подошва анода, очищается от неровностей, от пены, растворяется осадок на подине.
Отрицательная роль анодного эффекта это потери Al. При каждом анодном эффекте сгорает 1кг. наработанного металла, перерасход электроэнергии при А.Э. расходуется 150-160 кВч., дополнительный расход фторсырья, дополнительный расход анодной массы. Несет ущерб – 5,2$. Происходит перегрев электролита, увеличиваются потери фторсолей в результате испарения.
С увеличением плотности тока возможность возникновения анодного эффекта возрастает. Анодную плотность тока, при повышении которой наступает анодный эффект называют критической (d кр).
Величина критической плотности тока зависит от многих факторов: фтористый натрий улучшает смачиваемость, поэтому с увеличением содержания его в электролите критическая плотность тока возрастает. Также, плотность тока возрастает при увеличении содержания глинозема. При повышении температуры электролита смачиваемость анода также улучшается. Добавки в электролит фтористого кальция и фтористого магния понижают критическую плотность тока, способствуют учащению вспышек.
Анодные эффекты, которые не удается ликвидировать обычными способами, и которые продолжаются до нескольких часов, называются негаснущими. Они возникают из-за появления, не растворенного глинозема в электролите, которые ухудшают смачиваемость угольного анода. Негаснущие эффекты возникают чаще всего во время выливки или сразу после выливки алюминия из ванн, работающих на сильно кислом электролите и с низким его уровнем, с большими глиноземистыми осадками на подине и длинными подовыми настылями, уходящими под анод.
10. Расчет производительности электролизера. Расчет выхода по току. Расчет выхода по энергии. Расчет удельного расхода электроэнергии. Влияние различных факторов на выход по току
Как известно, количество алюминия (обозначим Рт), которое теоретически может быть получено в процессе электролиза за определенный промежуток времени t, определяется по закону Фарадея.
Рт = 0,336 гр * I * t
0,336 гр электрохимический эквивалент равен количеству граммов алюминия полученного на катоде при прохождении силы тока в 1А в течении одного часа.
На практике же вследствие некоторых утечек тока и вторичных процессов (в частности, растворения алюминия в электролите и последующего взаимодействия растворения алюминия с анодными газами) количество получаемого алюминия (обозначим Рп) всегда меньше этой величины.
Отношение количества металла, фактически полученного при электролизе, к его теоретически ожидаемому количества за то же время называют выходом по току. Выход по току обозначают
ήт = Рф / Рт * 100%.
Выход по току при получении алюминия на мощных электролизерах с верхних токоподводом обычно составляет 0,82-0,85 (82-85%). Зная выход по току и силу тока на серии, можно рассчитать суточную производительность электролизера по формуле
P = 8,04 * l * ήт / 1000 кг/ сутки.
Например, производительность электролизера на силу тока 160 000 А и при выходе по току 0,82 в сутки составит:
Р = 8,04 * (160 000 * 0,82) / 1000 = 1055 кг.
Выход по току – один из основных показателей, определяющих количество произведенного алюминия и расход электроэнергии на его получение. По этому показателю судят о качестве всей работы электролизного цеха, корпуса, бригады и электролизера.
По фактической величине выхода по току видно, что 15-18% от теоретического количества получаемого алюминия теряется.
К основным причинам непроизводительного расхода электроэнергии и снижению выхода по току относятся:
- утечки электрического тока в землю (при нарабатывании алюминия, ток проходит через электролит одного электрода ванны к другому, но некоторая часть проходит, не участвуя в электролизе, что называется утечками тока).
- утечки в результате технологических нарушений (потеря тока через конус на подошве анода при контакте его с зеркалом металла. Куски анода, скопление угольной пены в междуполюсном пространстве).
- электролиз окислов кремния, железа, меди и других, более электроположительных, чем алюминий, элементов. (эти примеси, при попадании в электролит с сырьем повышают расход электроэнергии и загрязняют алюминий).
- снижение выхода по току в следствие растворения его в электролите и последующего взаимодействия растворенного алюминия с анодными газами и кислородом воздуха.
На величину этих потерь и на величину выхода по току оказывают влияние следующие факторы:
- температура электролита;
- межполюсное расстояние;
- плотность тока;
- состав электролита;
- качество обслуживание электролизеров.
На практике часто пользуются показателем расхода электроэнергии, называемым выходом по энергии. За выход по энергии принимают количество алюминия, полученное на каждый киловатт-час затраченной электроэнергии (ήэн = г/кВч = 0,336 * ήT / Vср * 103), т. е. выход по энергии прямопропорционален выходу по току и обратно пропорционален среднему напряжению на ванне.
Удельный расход электроэнергии
W = V cp * 103 / 0,336 * ήт кВч/т
V ср – среднее напряжение, чем оно больше , тем больше расход электроэнергии.
Vср = Vраб + ∆Иаэ + ∆И корпусной шинковки.
Расход электроэнергии W может быть определен как частное от деления количества затраченной электроэнергии на полученное при этом количестве Al.
A = Y * V * t * 10-3
P = 0,336 * Y * t * ήт * 10-6
W = Y * V * t * 10-3 / 0,336 * Y * t * ήт * 10-6 =
= V * 10-3 / 0,336 * ήт = H1 * 3 *10-3 / 0,336 * 88% =
= 4300 / 0,336 * 0,88 = 4300/ 29,568 = 14 543кВч/т, при 4,5 = 15219 кВч/т
11. Технологические параметры катодного узла электролизера
t 0 С электролита – 965 (+- 40)
![]() КО – 2,4-2,5.
КО – 2,4-2,5.
Ca F2 – 4 – 6 % неболее ∑ %10-8
Mg F2 – 4-6%
Уровень Ме 38-42 см. в зависимости от глубины шахты
Уровень электролита 118 (+-2) см.
ФРП (форма рабочего пространства настыль к горнисаж)
L настыли 1-1,5 Ир = 4,3-4,5V
Nт на промышленных электролизерах прежде всего чувствуется к изменению температуры электролита.
Считается что при увеличении t 0 С на 100 С снижается Nт на 3%.
Температура электролита зависит от количества тепла, выделяется в единицу времени (приход тепла) а отдача тепла электролитом за этот же период- это расход тепла.
При определенном рабочем U и температуре электролита на электролизере устанавливается тепловое равновесие.
При нарушении теплового равновесия температура электролита, или резко повышается или резко понижается. Большая часть тепла выделяется в слои электролита и зависит от его удельного сопротивления и междуполюсного расстояния. Поэтому регулированием междуполюсного расстояния можно легко уменьшить или увеличить приход тепла в электролизере и расход электроэнергии, т. к. сопротивление электролита в междуполюсном зазоре прямопропорционально изменению U раб. При увеличении междуполюсного зазора- увеличивается напряжение на электролизере.
В МПР расходуют более 75% электроэнергии. От МПР зависит:
t0 электролита, расход электроэнергии.
ήт – выход по току.
Величина МПР от конструктивных и технологических параметров электролизера. На промышленных электролизерах оно составляет 5-6 см. При снижении МПР на 0,5 см напряжение уменьшается на 0,15 V, ήэ на 500кв ч/т.
Оптимизация технологического состояния достигается путем воздействия на величину МПР за счет перемещения анода индивидуально на катод электролизера командами системы АС УТП.
Каждому электролизеру подбирают установочный рабочий U, которые задаются в систему АС УТП, а затем эта система периодически проверяет его на электродах (обегает электроды через два часа и устраняет отклонения).
Уровни и объемы Ме и электролита.
Количество Ме и электролита в шапке ванны оказывает заметное влияние на состояние технологического процесса и зависит от:
1) Конструктивных размеров (шахты, ванны).
2) От ФРП, т. к. конструктивные размеры шахты ванн, ФРП достаточно стабильно, то объем Ме и электролита определяются по высоте их столбов в шахте по их уровню.
| глубина шахты см | 54-56 | 53-54 | 51-52 | 49-50 | 47-48 | 45-46 |
|
целевой уровень Ме см под выливку |
45 | 43 | 41 | 40 | 39 | 38 |
На каждом электролизере устанавливается целевой уровень Ме в зависимости от глубины шахты.
Замеры глубины шахты электролизера
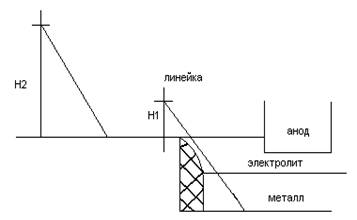
H = H2 – H1
Порядок выполнения операции:
1) Пробить корку электролизера ломом в центре сторон электролизера от шины (длина лома – 2м.).
2) Очистить поверхность электролита в летке от кусков корки и Al2O3 огарком гасильного шеста (длина огарка – 1,5м.).
3) Закрепить уровень на ломе на расстоянии 15-20мм. от верхнего конца лома.
4) Ввести лом в расплав и установить его на чистую от настыли подину.
5) Установить мелиск уровня в центральном положении путем перемещения корпуса уровня в вертикальную плоскость и зафиксировать зажимом.
6) Измерить металл линейкой от верхнего конца лома до вентиляционной решетки Н.
7) Извлечь лом из расплава.
8) Установить пол на горизонтальную поверхность пола, конец уровня с пола перемещают в вертикальной плоскости до установки мениска уровня в центральном положении.
9) Измерить линейкой расстояние от верхнего конца лома до пола (Н2).
10) Произвести расчет глубины шахты электролизера Н=Н2-Н1
Замеры уровня Ме и электролита
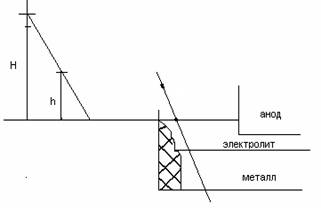
Н – уровень расплава
h - || - Me
H – h -|| - электролита
1) Первые пять операции аналогичны как при измерении шахты.
6) Извлечь лом.
7) Установить лом на горизонтальную поверхность пола, конец лома с уровнем перемещения в вертикальной плоскости до установленного мелиска уровня в центральном положении.
8) Измерить расстояние от пола до верхней корочки расплава (Н) уровень всего расплава.
9) Измерить расстояние от пола до границы Ме / на ломике корочка Ме - темная, а верхняя часть h – светлая.
10) Уровень электролита определяется расчетным путем H –h.
U р = ∆U анод + ∆U электролите + Н р + ∆U падина катода + ∆U аминов электролизера
Это составляющая раб. U.
U ср. = ∆U р + ∆U а э + ∆U корпус ошиновки.
1. Янко Э.А., Лозовой Ю. Д. Производство алюминия в электролизерах с верхним токоподводом. М., Металлургия., 1976.
2. Терентьев В.Г., Школьников Р.М., Гринберг И.С., Черных А.Е., Зельберг Б.И., Чалых В.И.- И.: Папирус-АРТ, 1998.
3. Лекции.
© 2009 База Рефератов