
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Учебное пособие: Будова атомів металів
Учебное пособие: Будова атомів металів
«Будова атомів металів»
Серед безлічі матеріалів, здавна відомих людин широко використовуваних нею у своєму житті й діяльності, метали завжди посідали особливе місце: і в назвах епох (золотого, срібного, бронзового, залізного віку), на які греки поділяли історію людства; і в археологічних знахідках металевих виробів (куті мідні прикраси, сільськогосподарські знаряддя); і в повсюдному використанні металів і сплавів у сучасній техніці.
Метали — найпоширеніші в природі елементи. Причина цього — в особливих властивостях металів, що вигідно відрізняють їх від інших матеріалів і роблять у багатьох випадках незамінними. Вони складають один із класів конструкційних матеріалів, що характеризується визначеним набором властивостей:
«металевий блиск» (гарна відбивна здатність);
пластичність;
висока теплопровідність;
висока електропровідність.
З позиції хімії метали (їх близько 80) — це елементи, атоми яких складаються з позитивно зарядженого ядра, навколо якого на різній відстані обертаються негативно заряджені електрони, утворюючи певн електронні оболонки. Зовнішня електронна оболонка металів містить невелику кількість електронів (1...2). Сила притягування ядра атома щодо зовнішніх (валентних) електронів значною мірою компенсується електронами внутрішніх оболонок. Тому атоми металів досить легко втрачають зовнішні електрони перетворюються на позитивно заряджені іони. Вільні електрони легко пересуваються в усіх напрямках між утвореними позитивно зарядженими іонами, нагадуючи рух частинок газу («електронний газ»). Існування водночас нейтральних та іонізованих атомів і вільних електронів є підставою для уявлень щодо особливого типу міжатомного зв'язку, притаманного тільки металам, — металевого. У металі постійно відбувається обмін електронами між нейтральними й онізованими атомами, завжди є певна кількість електронів, що на даний момент не належать якомусь з атомів. Якщо створити у металі різницю потенціалів, рух електронів набуде певного напрямку і виникне електричний струм. Наявністю вільних (колективізованих) електронів пояснюють існування спільних для всіх металів властивостей (пластичність, непрозорість, блиск, високі електро- теплопровідність), а їх кількість визначає різний ступінь «металевості» окремих металів.
Метал як хімічний елемент може бути компонентом, тобто речовиною, яка утворює систему і входить до складу сплавів з двох або кількох елементів.
Кожний метал (речовина) може перебувати у трьох агрегатних станах: газоподібному, рідкому і твердому.
У газоподібному металі відстань між атомами (частинками) велика, сили взаємодії є малими й атоми хаотично пересуваються у просторі й відштовхуються один від одного. У газоподібному стані атоми мають більшу кінетичну енергію.
У рідкому стані атоми (частинки) зберігають лише так званий близький порядок, тобто в об'ємі закономірно розташована невелика кількість атомів, а не атоми всього об'єму. Близький порядок є нестійким.
Будова рідких металів і сплавів певною мірою вплива на формування деяких особливостей їх будови в твердому стані, що ма експериментальні підтвердження за допомогою сучасних методів досліджень використовується при розробленні технології виплавки і твердіння сплавів.
Рідкі метали, як і кристалічні, характеризуються близькими значеннями густини, тому їх об'єднують під назвою конденсованих фаз. Вони суттєво відрізняються від металевого газу. Кристалічний метал характеризується далеким порядком розташування атомів, тобто повністю закономірне розміщення атомів у просторі спостерігається на великих відстанях від окремо взятого (даного атома). В рідкому металі впорядковане розташування спостерігається тільки в найближчому оточенні певного атома, тому будова рідкого металу характеризується наявністю близького порядку.
Властивості металів зумовлює їх атомна будова кристалічна структура. Залежно від будови і властивостей метали об'єднують у різні групи. За загальною і найпоширенішою класифікацією метали поділяють на дві групи: чорні й кольорові (рис. 1.1). До чорних металів належать залізо та його сплави (сталь, чавун), а до кольорових — решта металів.
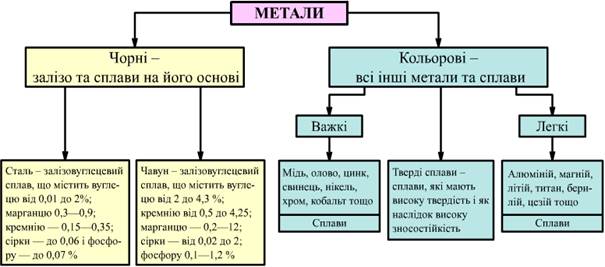
Рис. 1.1 Загальна класифікація металів
За класифікацією О. П. Гуляєва чорні метали мають темно-сірий колір, вищі температури плавлення, значну твердість і густину, здатні до поліморфних перетворень (окрім Ni). Серед них розрізняють:
залізні — Fe, Co, Ni, Mn;
тугоплавкі — температура плавлення яких вища за температуру плавлення заліза (понад 1539 °С) — W, Mo, Re, Nb, Ti, V, Cr;
уранові — актиніди;
рідкісноземельні (РЗМ) — La, Ce, Nd, Pr та інші.
У техніці використовується понад 90 % чорних металів.
До кольорових належить решта металів. Характерним для них є забарвлення (червоне, жовте, біле), висока пластичність, низька твердість, відносно низька температура плавлення, відсутність поліморфізму. Типовим представником групи кольорових металів є мідь і сплави на її основ (бронза, латунь). Серед кольорових металів розрізняють:
легкі (Мg, Ве, Аl, Ті), які мають малу густину;
легкоплавкі (Zn, Cd, Hg, Sn, Pb, Bi, Tl, Sb) з температурою плавлення, нижчою від заліза;
тугоплавкі (W, Мо, Nb, Та) з температурою плавлення вищою, ніж у заліза;
благородні (Аg, Аu, Рt) з високою стійкістю проти корозії;
уранові (актиніди), які використовуються в атомній техніці;
рідкісноземельні (РЗМ) — лантаноїди;
лужні (Na, К, Zn) — у вільному стані майже не застосовуються.
Кольорові метали додають до складу легованих сталей сплавів для поліпшення їхньої структури та властивостей, а також використовують для виготовлення різноманітних виробів.
КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Назвіть характерні властивості металів.
2. У яких агрегатних станах може перебувати кожний метал?
3. Як класифікуються метали?
4. Чи належать метали до конструкційних матеріалів?
5. Скільки металів у періодичній системі Д. І. Менделєєва?
6. Які характерні властивості чорних металів за класифікацією О. П. Гуляєва?
7. Які характерні властивості кольорових металів за класифікацією О. П. Гуляєва?
8. Назвіть типових представників групи кольорових металів.
9. Назвіть благородні кольорові метали.
«Атомно-кристалічна будова металів»
Під атомно-кристалічною структурою розуміють взаємне розташування атомів (іонів) у реальному кристалі. Залежно від будови (розташування атомів) тверді тіла поділяють на аморфні та кристалічні.
Аморфн тіла характеризуються хаотичним розташуванням атомів, тому, зберігаючи постійну форму, вони не мають певних (критичних) температур плавлення та кристалізації. Залежно від зовнішніх умов їхні властивості змінюються поступово. Аморфний стан металів реалізується за умов інтенсивного охолодження під час кристалізації.
За звичайних умов тверднення метали у твердому стані мають кристалічну будову. Для кристалічного стану характерним є певне закономірне розташування у просторі. Кожен атом (іон) у кристалі оточений визначеною кількістю найближчих атомів (сусідів), розташованих на однаковій відстані від нього.
З погляду внутрішньої будови вони мають неоднаковий ступінь упорядкованості структурних частинок — іонів, атомів, молекул. В аморфних тілах (каніфоль, скло, смола) спостерігається близький порядок розміщення частинок, який поширюється лише в межах кількох міжатомних відстаней. У кристалічних тілах, до яких належать ус метали, упорядковане розміщення характерне для як завгодно віддалених частинок. Тому говорять, що там спостерігається далекий порядок. Таке правильне, регулярне розміщення частинок у твердому тілі, що характеризується періодичною повторюваністю у всіх трьох вимірах, утворює просторову (кристалічну) ґратку (рис. 1.2).
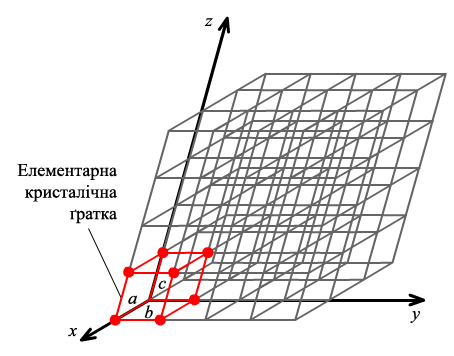
Рис. 1.2. Схема кристалічної ґратки: a, b, c періоди ґратки
До основних параметрів кристалічних ґраток належать:
елементарна комірка — це найменша кількість (комплекс) атомів, яка при багаторазовому повторі у просторі дозволяє побудувати просторові кристалічну ґратку певно системи;
відрізки, що дорівнюють відстаням до найближчих атомів (іонів) по координатних осях у тривимірному просторі, позначають літерами а, b, с;
кути між цими відрізками позначають α, β, γ співвідношення відрізків і кутів визначає форму комірки;
період або параметр ґратки дорівнює довжині ребра комірки у напрямку головних осей кристалічної ґратки. Параметри вимірюють у нанометрах (нм), ангстремах (Å);
координаційне число (К) характеризує щільність пакування ґратки, визначає кількість найближчих і рівновіддалених атомів у певній кристалічній ґратці. Координаційне число простої кристалічної ґратки позначають К6 (літера означає тип ґратки, цифра — кількість атомів), об'ємоцентричної кубічної — К8; гранецентрично кубічної — К12; гексагональної — Г6; гексагональної щільного пакування — Г12;
базис це кількість атомів (іонів), які належать до однієї комірки;
атомний радіус — половина відстані між центрами найближчих атомів у кристалічній ґратц певної кристалічної системи;
коефіцієнт компактності — це відношення об'єму, який займають атоми (іони), до всього об'єму комірки цього типу.
Якщо якесь тіло становить один кристал, його називають монокристалом (від грецьк. один, єдиний). Однак практично всі металеві вироби, що зустрічаються в машинобудуванні, складаються з величезної кількості кристалів (зерен різно форми і розмірів, дендритів), і тому їх називають полікристалами (від грецьк. численний). Властивості полікристалічних матеріалів значною мірою залежать від форми і розмірів кристалів, проте їхня внутрішня будова є настільки ж закономірною, як у монокристалів.
Для характеристики атомно-кристалічної структури твердих тіл користуються поняттям елементарної комірки. Це найменший комплекс структурних частинок, багатократне пересування якого у просторі повністю відтворює будову кристалу.
Просторове розташування атомів у кристалічному тілі залежить від природи металу, характеру міжатомних зв'язків, температури, тиску. Прагнення атомів до найщільнішого розміщення приводить до значної кількості комбінацій їх взаємного розташування. Серед промислових металів найпоширенішими є утворення трьох основних типів кристалічних ґраток (рис. 1.3): об'ємоцентричної кубічної (ОЦК), гранецентричної кубічної (ГЦК) і гексагональної щільного пакування (ГЩП).
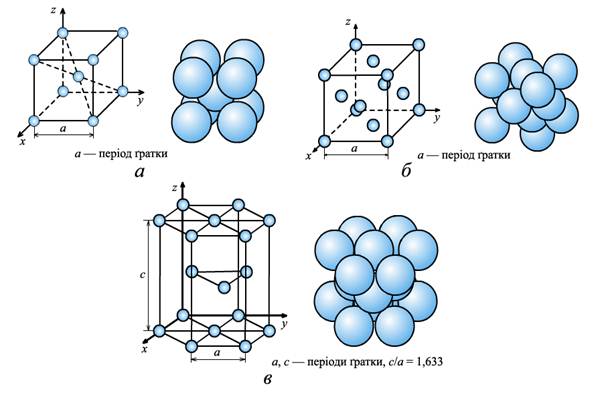
Рис. 1.3. Елементарні кристалічні ґратки: а — об'ємоцентричний куб; б гранецентричний куб; в — гексагональна щільного пакування
В об'ємоцентричній кубічній ґратці атоми розташовані у вершинах куба й один атом у центрі куба. Таку кристалічну ґратку мають P, K, Na, Li, Tiβ, Zrβ, Ta, W, V, Feα, Cr, Nb, Ba й інші метали. У гранецентричній кубічній ґратці атоми розташовані у вершинах куба і в центрі кожної грані. Кристалічну ґратку такого типу мають Саα, Се, Srα, Th, Pb, Ni, Ag, Au, Pd, Pt, Ir, Feγ, Cu й інші метали.
Гексагональну ратку щільного пакування мають Mg, Tiα, Cd, Re, Os, Ru, Zn, Coβ, Be, Caβ й інші метали. Атоми у ГЩП-ґратці розташовані у вершинах і центрі шестигранних основ призми та три атоми — у середній площині призми.
Багато металів і деякі технічно важливі неметали кристалізуються у різних кристалічних ратках залежно від таких зовнішніх умов, як температура і тиск, їх називають алотропними модифікаціями, а таке явище поліморфізмом. Низькотемпературну модифікацію позначають α, а високотемпературні — β, γ, δ тощо. Кожна модифікація має свій температурний інтервал існування. Внаслідок поліморфного перетворення утворюються нові кристалічні зерна іншої форми та розміру, тому таке перетворення називають перекристалізацією.
При поліморфних перетвореннях змінюється не лише тип кристалічної ґратки, але й властивості металу, при цьому властивості змінюються стрибкоподібно. Так, ОЦК-ґратка α-заліза при 911 °С перетворюється в ГЦК-ґратку γ-заліза, яка може розчинити значно більшу кількість вуглецю, ніж α-ґратка. Феромагнітні властивості має тільки α-залізо, але не в усій сфері свого існування, оскільки температура Кюрі становить 770 °С. Усе це має важливе значення для виробництва й обробки сталі. В інших елементах поліморфні перетворення супроводжуються змінами механічних, теплових, електричних, оптичних, хімічних властивостей.
Ус кристалічні тіла анізотропні, що передбачає різницю властивостей у різних напрямках. Анізотропія яскраво виражена лише в монокристалах. У полікристалічних матеріалах, наприклад зливках, з великою кількістю хаотично орієнтованих кристалів вона не має чітко вираженого характеру, оскільки властивості їх у різних напрямках усереднюються. Про такі матеріали говорять, що вони ізотропні. Аморфні тіла, які мають невпорядковану насиченість атомами, у різних напрямках також є ізотропними. Проте у структурі металу іноді може створюватися переважаюча орієнтація кристалів, тоді він стає анізотропним. Прикладом анізотропності може бути текстура листового металу, що з'являється під час його обробки тиском. Тоді його міцність, теплові, електричні, магнітн та інші властивості вздовж і поперек прокатки неоднакові і можуть значно різнитися. У багатьох випадках це небажано, але іноді створюється навмисно з метою поліпшення експлуатаційних характеристик. Таким чином, структура металів сплавів визначає їх механічні й технологічні властивості, особливо під час термічної обробки, експлуатації виробів при високих і низьких температурах. Тому її вивчення має надзвичайно велике значення для практики. Матеріал для закріплення знань
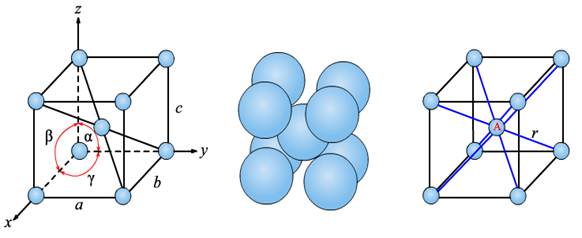
Рис. 1.4. Ґратка об'ємоцентрична кубічна (Mo, W, V, Feα): r найменша відстань до сусідніх атомів
Таблиця 1.1 Характеристики об'ємоцентричної кубічної ґратки
| Параметр | Значення |
| Кути між осями | α = β = γ = 90° |
| Період ратки | a = b = c |
| Кількість атомів на чарунку | n = 2 |
| Координатне число | Z = 8 |
| Коефіцієнт компактності | K = 0,68 |
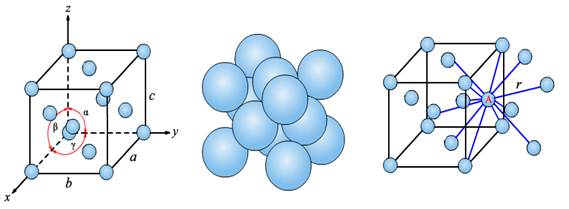
Рис. 1.5. Ґратка гранецентрична кубічна (Al, Cu, Au, Ag, Feγ): r — найменша відстань до сусідніх атомів
Таблиця 1.2 Характеристики гранецентричної кубічної ґратки
| Параметр | Значення |
| Кути між осями | α = β = γ = 90° |
| Період ратки | a = b = c |
| Кількість атомів на чарунку | n = 4 |
| Координатне число | Z = 12 |
| Коефіцієнт компактності | K = 0,74 |
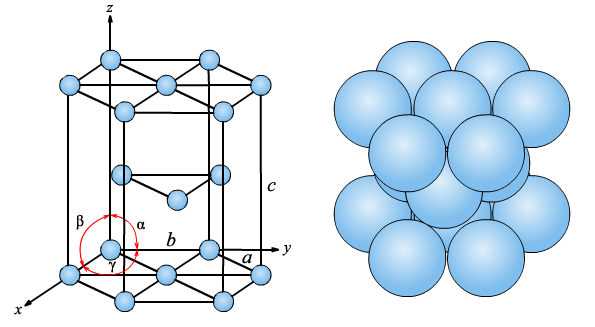
Рис. 1.6 Ґратка гексагональна щільного пакування (Mg, Coα, Zn, Tiα, Cd)
Таблиця 1.3 Характеристики гексагональної щільноупакованої ґратки
| Параметр | Значення |
| Кути між осями | α = β = 90°, γ = 90° |
| Період ратки | a = b, c/a = 1,633 |
| Кількість атомів на чарунку | n = 6 |
| Координатне число | Z = 12 |
| Коефіцієнт компактності | K = 0,74 |
КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
1. На які групи залежно від будови поділяються тверді тіла?
2. Що таке аморфні тіла?
3. Що таке кристалічні тіла?
4. Наведіть приклади аморфних тіл.
5. Наведіть приклади кристалічних тіл.
6. Що таке просторова кристалічна ґратка?
7. Назвіть основні параметри кристалічних ґраток.
8. Як типи кристалічних ґраток характерні для металів?
9. Що таке поліморфізм металів?
10. Анізотропія й ізотропія, що це?
«Дефекти кристалічної будови металів»
З рідкого розплаву можна виростити монокристали. Їх, як правило, використовують у лабораторіях для вивчення властивостей тієї чи іншої речовини.
Метали сплави, отримані у звичайних умовах, складаються з великої кількост кристалів, тобто мають полікристалічну будову. Ці кристали називаються зернами, мають неправильну форму і по-різному орієнтовані в просторі. Кожне зерно ма власне орієнтування кристалічних ґрат, відмінне від орієнтування сусідніх зерен, унаслідок чого властивості реальних металів усереднюються, і явище анізотропії не спостерігається.
У кристалічних ґратах реальних металів наявні різні дефекти (недосконалості), що порушують зв'язки між атомами і впливають на властивості металів. Розрізняють такі структурні дефекти:
точков малі у всіх трьох вимірах;
лінійн малі у двох вимірах і як завгодно протяжні в третьому;
поверхнев малі в одному вимірі.
Одним з поширених недоліків кристалічної будови є наявність точкових дефектів: вакансій, дислокованих атомів і домішок (рис. 1.7).
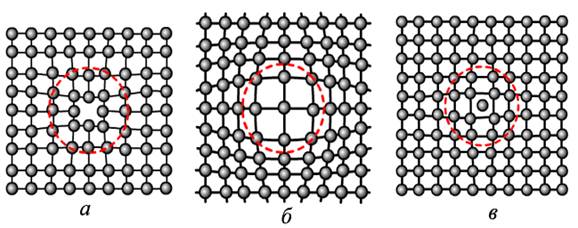
Рис. 1.7. Точкові дефекти: а — вакансія; б домішковий (чужорідний) атом; в — дислокований атом
Вакансія відсутність атомів у вузлах кристалічних ґрат, «дірки», що утворилися в результаті різних причин: при переході атомів із поверхні в навколишн середовище чи з вузлів ґрат на поверхню (границі зерен, порожнечі, тріщини тощо), у результаті пластичної деформації, при бомбардуванні тіла атомами чи частинками високих енергій (опромінення в циклотроні чи нейтронне опромінення в ядерному реакторі). Концентрація вакансій значною мірою визначається температурою тіла. Скупчення багатьох вакансій може призвести до утворення пор порожнеч.
Дислокований атом — це атом, що вийшов із вузла ґрат і зайняв місце в міжвузлі. Концентрація дислокованих атомів значно менше, ніж вакансій, оскільки для їх утворення необхідні істотні витрати енергії. При цьому на місці атома, що перемістився, утвориться вакансія.
Домішков атоми завжди присутні в металі, оскільки практично неможливо виплавити хімічно чистий метал. Вони можуть мати розміри, більші чи менші розмірів основних атомів, і розташовуються у вузлах ґрат чи міжвузлях.
Точков дефекти викликають незначні перекручування ґрат, що може привести до зміни властивостей тіла (електропровідність, магнітні властивості), їхня наявність сприяє процесам дифузії та здійсненню фазових перетворень у твердому стані.
Основними лінійними дефектами є дислокації. Дислокація — це дефекти кристалічної будови, що являють собою лінії, уздовж і поблизу яких порушене характерне для кристала правильне розташування атомних площин.
Дислокац впливають не лише на міцність і пластичність, але й на інші властивост кристалів. Зі збільшенням щільності дислокацій змінюються оптичні властивості, підвищується електричний опір металу. Дислокації збільшують середню швидкість дифузії в кристалі (рис. 1.8), прискорюють старіння й інші процеси, зменшують хімічну стійкість, тому в результаті обробки поверхні кристала спеціальними речовинами в місцях виходу дислокацій утворюються ямки.
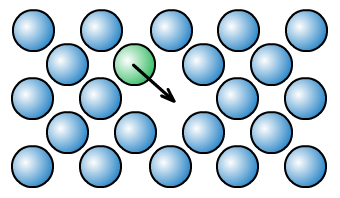
Рис. 1.8. Схема дифузії в кристалі
Поверхнев дефекти виникають на границях зерен, фрагментів і блоків (рис. 1.9).
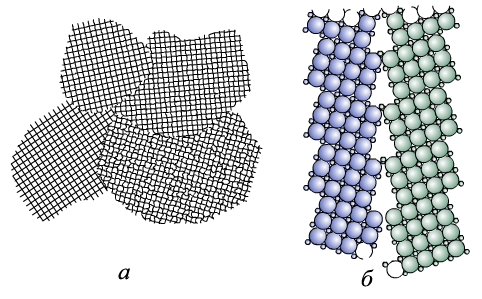
Рис. 1.9. Границі зерен: а — схема полікристалічного тіла; б — схема будови границі зерна
Розміри зерен складають до 1000 мкм. Границя між зернами являє собою тонку, в 5—10 атомних діаметрів, поверхневу зону з максимальним порушенням порядку в розташуванні атомів.
КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Що таке зерна?
2. Назвіть групи дефектів (недосконалостей) кристалічних граток.
3. Що належить до точкових дефектів?
4. Що таке вакансія?
5. Що таке дислокований атом?
6. Що таке домішковий (чужорідний) атом?
7. До зміни яких властивостей металів можуть призвести точкові дефекти?
8. Як дефекти належать до лінійних?
9. До зміни яких властивостей металів призводить дислокація?
10. Де виникають поверхневі дефекти?
«Кристалізація металів»
Кристалізацією називають перехід металів з рідкого стану в твердий (кристалічний). Відбувається вона внаслідок переходу системи з термодинамічно нестійкого стану в термодинамічно стійкий стан, тобто зі стану з більшою енергією у стан з меншою вільною енергією або термодинамічним потенціалом, коли вільна енергія кристала є меншою від вільної енергії рідкої фази.
Енергетичний стан системи прийнято характеризувати вільною енергією. Вільною енергією називається частина повної енергії речовини, яка обернено змінює свою величину при зміні температури, поліморфних перетвореннях, плавленні. З підвищенням температури величина вільної енергії зменшується. Зміну вільної енергії рідко твердої речовини показано на рис. 1.10.

Рис. 1.10 Зміна вільної енергії рідкого і твердого металу залежно від температури
При рівноважній температурі Тпл величини вільної енергії металу в рідкому твердому стані рівні; метал в обох станах перебуває у рівновазі. При температурі вище Тпл стійкішим є рідкий метал, який має менший запас вільно енергії, а нижче цієї температури стійким є твердий метал. Процес кристалізац розвиватиметься в тому випадку, якщо рідкий метал охолодити нижче температури Тпл.
Температура, за якої практично починається процес кристалізації, називається фактичною температурою кристалізації Тк.
Різниця
між рівноважною температурою Тпл і фактичною температурою Тк називається
ступенем переохолодження ΔТ: ![]() (1.1)
(1.1)
Процес переходу металу з рідкого стану у твердий можна описати за допомогою кривих у координатах температура — час.
На рис. 1.11 показані криві охолодження, які характеризують процес кристалізац чистих металів при охолодженні з різною швидкістю V. При дуже повільному охолодженні ступінь переохолодження малий і при температур кристалізації на кривій з'являється горизонтальна ділянка (зупинка у падінн температури), утворення якої пояснюється виділенням прихованої теплоти кристалізації.
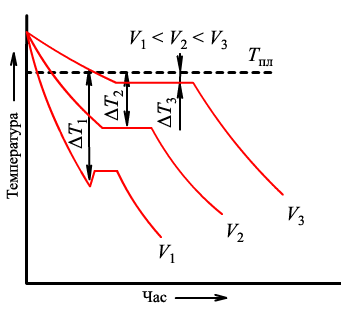
Рис. 1.11. Криві охолодження чистого металу
Під час плавлення відбувається поглинання теплоти, яка витрачається на підвищення енергії атомів, тобто на «руйнування» кристалічної ґратки металу. Ця теплота називається прихованою. У процесі кристалізації відбувається зворотне виділення енергії у вигляді прихованої теплоти кристалізації, яка компенсує тепло, що відводиться в оточуюче середовище, і затримує падіння температури.
З збільшенням швидкості охолодження ступінь переохолодження збільшується (криві 2 3) і процес кристалізації відбувається при температурах, які є значно нижчими, ніж рівноважна температура кристалізації.
Ступінь переохолодження залежить від природи і чистоти металу. Чим чистіший метал, тим при більшому ступені переохолодження виникають зародки твердих кристалів.
Процес кристалізації складається з двох стадій:
утворення центрів кристалізації (зародків кристалів);
розростання кристалів навколо цих центрів.
Схематично процес кристалізації показаний на рис. 1.12. При переохолодженні металу нижче температури Тпл у багатьох ділянках рідкого металу утворюються стійкі, здатн збільшуватися кристалічні зародки, які називають критичними зародками. Поки їх оточує рідина, кристали ростуть вільно і можуть мати правильну геометричну форму. Однак при зіткненні зростаючих кристалів їх правильна форма порушується, оскільки на ділянках контакту зростання граней припиняється. Кристал росте лише в тому напрямку, де він стикається з рідиною. Наслідком є те, що зростаюч кристали, які мають спочатку геометрично правильну форму, після тверднення набувають неправильної зовнішньої форми. Їх називають зернами, або кристалітами (рис. 1.13).

Рис. 1.12 Схема процесу кристалізації металу

Рис. 1.13. Мікроструктура заліза: а — зерна заліза; б — зерно заліза
Швидкість процесу кристалізації визначається двома величинами: швидкістю зародження центрів кристалізації і швидкістю росту кристалів.
Під швидкістю зародження центрів кристалізації розуміють кількість зародків, як виникають за одиницю часу в одиниці об'єму. Під швидкістю росту кристалів розуміють швидкість збільшення лінійних розмірів кристала за одиницю часу.
Кількість центрів кристалізації і швидкість росту кристалів залежать від ступеня переохолодження. Як видно з рис. 1.14, кількість зародків і швидкість їх зародження при рівноважній температурі кристалізації дорівнює нулю. При збільшенні ступеня переохолодження вони зростають і досягають максимуму. При великих ступенях переохолодження кількість центрів кристалізації і швидкість росту дорівнюють нулю, оскільки при низьких температурах дифузійна рухомість атомів є зменшеною, а тим самим є зменшеною і здатність системи до перетворення.
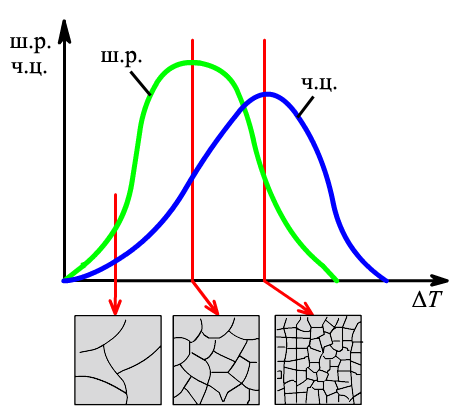
Рис. 1.14 Швидкість росту кристалів (ш.р.) і швидкість зародження центрів кристалізації (ч.ц.) залежно від ступеня переохолодження
Величина зерна. Чим більше центрів кристалізації і менше швидкість їх росту, тим дрібніші зерна металу.
При невеликій швидкості переохолодження кількість зародків є малою, а швидкість великою. За цих умов отримаємо крупне зерно. Зі збільшенням ступеня переохолодження кількість зародків зростає більшою мірою, ніж швидкість їх росту, і розмір зерна у металі зменшується.
Величина зерна металу значною мірою впливає на механічні властивості. Чим дрібніше зерно металу, тим вище його міцність, в'язкість і пластичність. На розмір зерна впливають температура нагрівання і розливання рідкого металу, його хімічний склад і наявність у ньому домішок.
Модифікування рідкого металу. Для отримання дрібного зерна в рідкий метал вводять спеціальн домішки (модифікатори), які, не змінюючи хімічного складу металу, поліпшують механічні властивості сплаву. Так, для сталі модифікаторами є Аl, V, Ті; для алюмінію — Ті, V, Zr; для чавуну — Мg. Нерідко роль модифікаторів відіграють хімічні елементи, які утворюють тугоплавкі сполуки, що кристалізуються в першу чергу. Ці сполуки (карбіди, нітриди, оксиди) виділяються у вигляді найдрібніших частинок і є зародками кристалів, що виникають під час твердіння. Наприклад, під час модифікування алюмінієвих сплавів як модифікатори використовують Ті, V, Zr, для сталі — Аl, V, Ті, для чавуну — Мg, феросиліцій, силікокальцій, Аl.
Будова металевого зливка. У процесі затвердіння кристали металу можуть мати різну форму залежно від швидкості охолодження, характеру й кількості домішок. Найчастіше утворюються дендрити (від грецьк. дендрон дерево). Спочатку виникають осі першого порядку (довгі гілки), потім перпендикулярно до них ос другого порядку, далі перпендикулярно до осей другого порядку утворюються ос третього порядку тощо. У кінцевому підсумку кристали набувають форми дендритів (рис. 1.15).

Рис. 1.15. Схема дендритів
Будову зливка складають три основні зони (рис. 1.16).
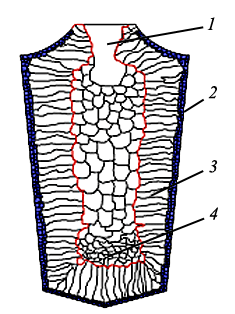
Рис. 1.16. Схема будови сталевого зливка за Д. К. Черновим: 1 усадкова раковина; 2 — зона дрібних рівновісних кристалів; 3 — зона стовбчастих кристалів; 4 — зона крупних рівновісних кристалів
Зона 1 — зовнішня дрібнозерниста кірка, що складається з дрібних дезорієнтованих кристалів — дендритів. При першому зіткненні зі стінками виливниці (металево форми) виникає значний перепад температур, що спричиняє переохолодження з утворенням великої кількості центрів кристалізації. У результаті кірка набува дрібнозернистої будови.
Зона 2 — зона стовбчастих кристалів. Тут перепад температур різко зменшується і, відповідно, знижується ступінь переохолодження сплаву.
Зона 3 — зона рівноважних кристалів. У центрі зливка вже немає певного напрямку віддачі теплоти. Тому кристали ростуть рівномірно у всіх напрямках. Зародками кристалів тут виступають дуже дрібні включення.
Під час охолодження об'єм металу зменшується (дає усадження), тому у верхній частині зливка утворюються порожнини: усадочна раковина і усадочна пухкість.
Залежно від складу сталі, розмірів зливка й умов охолодження ці зони можуть змінюватися навіть зникати, але загальний характер будови зливка під час кристалізац залишається.
Наприклад, у невеликих зливках і виливках у металеві форми, особливо при заливанн перегрітого металу, зона стовпчастих кристалів стає великою і може зайняти весь переріз зливка, навіть до центру. Зона таких кристалів має велику густину, оскільки в ній мало газових бульбашок, раковин. У той же час на ділянках стику стовпчастих кристалів метал має понижену міцність, і під час обробки тиском (кування, прокатування тощо) на цих ділянках можуть виникати тріщини. Тому для малопластичних металів, у тому числі й для сталі, ріст стовпчастих кристалів небажаний. І навпаки, для отримання щільнішого зливка у пластичних металів (наприклад, міді та її сплавів) бажаним є поширення зони стовпчастих кристалів по всьому об'єму зливка; внаслідок високої пластичності таких сплавів руйнування зливка під час обробки тиском не відбувається.
Поліморфн алотропні перетворення у металах (перекристалізація). Багато металів, залежно від температури, можуть існувати в різних кристалічних формах або, як кажуть, модифікаціях. Унаслідок поліморфного (алотропного) перетворення кристалічн ратки одного типу перебудовуються на кристалічні ґратки іншого типу, іншо форми й іншого розміру. Поліморфні перетворення спостерігаються не у всіх металів, але в найважливіших вони існують.
Термодинамічною передумовою поліморфних перетворень є зменшення вільної енергії. Перехід з однієї кристалічної форми в іншу відбувається за постійної температури (критичні точки) і супроводжується виділенням теплоти при охолодженні й поглинанням теплоти при нагріванні. Для цього переходу, як і при кристалізац з рідкої фази, потрібне переохолодження (або перегрів) відносно рівноважно температури, щоб виникла різниця вільних енергій.
У твердому металі, на відміну від рідкого, можливе досягнення дуже великого переохолодження.
Поліморфн перетворення здійснюються шляхом утворення зародків та їхнього росту в результаті переходу атомів зі старої модифікації у нову. Зародки ново модифікації найчастіше виникають на межах зерен вихідних кристалів або в зонах з підвищеним рівнем вільної енергії. Поліморфне перетворення супроводжується стрибкоподібною зміною всіх властивостей металу — механічних, фізичних, хімічних.
Модифікацію, що існує при найнижчій температурі, позначають грецькою літерою α, при дещо вищій — β, ще вищій — γ тощо.
КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Що таке кристалізація металів?
2. Що таке ступінь переохолодження?
3. З яких двох стадій складається процес кристалізації?
4. Що таке кристаліти?
5. Якими величинами визначається швидкість процесу кристалізації?
6. Як можна отримати дрібніше зерно металу?
7. На які властивості металів впливає величина зерна?
8. Що вводять до рідкого металу для отримання дрібного зерна?
9. Що таке дендрити?
10. Назвіть основні зони будови зливка.
11. Що таке поліморфні, алотропні перетворення у металах?
© 2009 База Рефератов