
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Ассоциации иммуногенетической системы HLA с развитием туберкулеза
Курсовая работа: Ассоциации иммуногенетической системы HLA с развитием туберкулеза
Федеральное агентство по образованию РФ
Государственное образовательное учреждение
высшего профессионального образования
Курсовая работа по иммунологии
на ТЕМУ: "Ассоциации иммуногенетической системы HLA с развитием туберкулёза"
Челябинск 2006
СОДЕРЖАНИЕ
Введение
Глава 1. Физиологическая роль главного комплекса гистосовместимости человека
Глава 2. Ассоциация туберкулёза с различными генетическими факторами
Глава 3. Персистентные бактериальные инфекции: интерфейс патогена и иммунная система хозяина
3.1 Персистентные микобактериальные инфекции
3.2 Выживание микобактерий
3.3 Выживание внутри макрофагов
3.4 Иммунный ответ на персистирующие микобактерии
Глава 4. CD-1 и CD-1-рестриктированные Т-клетки при инфекциях, вызванных внутриклеточными бактериями
4.1 Атигенпрезентующие молекулы
4.2 Презентация микобактериальных липидов группой I CD1 молекул
4.3 Внутриклеточная локализация CD1 молекул
4.4 Рецептор для транспорта АГ
4.5 CD1d и NКТ-клетки при инфекциях
4.6 αGalCer специфически активирует CD1d iNКТ-клетками
Глава 5. Отличительные частоты генотипа цитокинов среди канадских аборигенов и кавказских популяций
Глава 6. Ассоциация туберкулёза со специфичностями гена HLA-DR-B1 в различных регионах Тувы
Глава 7. Распределение антигенов комплекса HLA у больных туберкулёзом и здоровых лиц в татарской популяции
Заключение
Приложения
Список литературы
ВВЕДЕНИЕ
Туберкулез является проблемой мирового масштаба. По данным ВОЗ, одна треть населения мира инфицирована Mycobacterium tuberculosis. В 1998 году было зарегистрировано 8 млн. новых случаев клинического туберкулеза и 1,9 млн. смертей от заболевания. Ожидается, что к 2010 году в мире будет около 1 млрд. вновь инфицированных, более 200 млн. заболевших, а 70 млн. – умрет от туберкулеза. В России ежегодно инфицируется около 9 тыс. детей (что на порядок выше, чем в других развитых странах), а число больных в 1997 г. по сравнению с 1991 г. возросло в 2,5 раза.
Следует отметить, что не все индивиды после контакта с M. tuberculosis становятся инфицированными. Клинические признаки туберкулеза проявляются только у 10 % инфицированных. В настоящее время стало понятно, что развитие инфекции M. tuberculosis и клинический туберкулез обусловлено сложным взаимодействием между биологическими свойствами самого инфекционного агента, средовыми факторами и физиологической индивидуальностью человека.
У большинства людей сразу же после инфекции M. tuberculosis развивается эффективный иммунный ответ, ограничивающий распространение агента. Менее 10 % инфицированных, у которых развивается заболевание, имеют идентифицируемые факторы риска, такие как диабет, СПИД, пожилой возраст. У остальных заболевших развитие туберкулеза, по-видимому, обусловлено комплексных взаимодействием генетических и средовых факторов.
Для каждой популяции мира были обнаружены свои особенности в частотах антигенов HLA и характерные для данной популяции ассоциации с восприимчивостью (или резистентностью) к туберкулёзу лёгких. Поэтому задачей моей курсовой было исследование источников литературы по данной теме и сравнение результатов, полученных в разных опытах.
Глава 1. Физиологическая роль главного комплекса гистосовместимости человека
Регуляция иммунного ответа является одной из основных физиологических функций организма. Эта функция принадлежит генам главного комплекса гистосовместимости человека. При этом следует принять во внимание, что само это название отражает скорее историю открытия данной генетической системы, чем ее основную функцию. Дело в том, что история открытия первых продуктов генов главного комплекса гистосовместимости человека, называемых антигенами HLA (от Human leucocyte antigens), связана именно с появлением и развитием трансплантационной иммунологии, когда возникла необходимость подбора тканесовместимых пар донор и реципиент. Сегодня же мы знаем, что роль системы HLA в отторжении трансплантата является лишь одной из частных физиологических функций этой системы, а основная же ее функция — это регуляция иммунного ответа. В 80-x голах даже дискутировался вопрос о переименовании системы HLА в главный комплекс генов иммунного ответа человека, но учитывая, что старое историческое название давно укоренилось среди иcследователей, решено было не менять его.
По современным представлениям система HLA. обеспечивая регуляцию иммунного ответа, осуществляет такие важнейшие физиологические функций, как взаимодействие всех иммунокомпетентных клеток организма, распознавание своих и чужеродных, в том числе измененных собственных, клеток, запуск и реализацию иммунного ответа и в целом обеспечивает выживание человека как вида в условиях экзогенной и эндогенной агрессии [19].
Все многообразие указанных функций обеспечивается строением главного комплекса гистосовместимости.
Система HLA, открытая более 40 лет назад, по-прежнему остается одной из самых сложных, наиболее хорошо изученных и вместе с тем загадочных генетических структур в геноме человека.
Представления о строении системы HLA развивались и развиваются в течение всего периода ее изучения, однако, за последние годы произошел качественный скачок в развитии этой проблемы. Раньше, когда основным объектом исследовании могли служить только белки — антигены HLA, представления о комплексе генов HLA могли формироваться в основном на анализе косвенных данных, включающих изучение антигенов HLA в популяциях, в семейном анализе, реакциях, субстратом которых были антигены HLA, и т. д. Теперь благодаря развитию молекулярной генетики и иммунохимии появилась возможность не только проводить тонкий анализ антигенов HLA, но и изучить сами гены HLА.
![]() Прежде чем перейти к
непосредственному описанию строении генов HLA, следует отметить, что
внедрение в исследования системы HLA молекулярно-генетических методов не только
позволило конкретизировать представления о системе HLA, но и значительно
расширило представления о ее полиморфизме, при этом были открыты многие новые
аллели классов I, II и III, и общее количество только известных специфичностей HLA
классов I
и II увеличилось более чем в
6 раз. Аллельные варианты HLA классов I и II входят в несколько генетических локусов, Так, в
классе I имеется 3 локуса HLA: А, В и С. Также к антигенам HLA класса относятся гены
локуса MIC - МНС class I chain-related genes (MIC-A и MIC-B). Антигены MIC обладают способностью
связывать пептиды и другие короткие лиганды. В настоящее время неясно, являются
ли MIС-антигены
более древними либо, напротив, происходят от типичных антигенов класса I.
Прежде чем перейти к
непосредственному описанию строении генов HLA, следует отметить, что
внедрение в исследования системы HLA молекулярно-генетических методов не только
позволило конкретизировать представления о системе HLA, но и значительно
расширило представления о ее полиморфизме, при этом были открыты многие новые
аллели классов I, II и III, и общее количество только известных специфичностей HLA
классов I
и II увеличилось более чем в
6 раз. Аллельные варианты HLA классов I и II входят в несколько генетических локусов, Так, в
классе I имеется 3 локуса HLA: А, В и С. Также к антигенам HLA класса относятся гены
локуса MIC - МНС class I chain-related genes (MIC-A и MIC-B). Антигены MIC обладают способностью
связывать пептиды и другие короткие лиганды. В настоящее время неясно, являются
ли MIС-антигены
более древними либо, напротив, происходят от типичных антигенов класса I.
В последнее время обнаружено, что антигены MIC-A участвуют в активации взаимодействия ТсR-молекулы МНС в развитии T-клеточно-опосредованной цитотоксичиости и активности НК-клеток, тем самым, в частности, играя роль в обеспечении противоракового иммунитета.
В классе II основными локусами HLА являются DR, DQ и DP, а также открытые в более позднее время DM, LMP и ТАР. Три последних локуса обеспечивают такие важнейшие функции, как процессииг и экспрессия антигенов HLA на поверхности клеток. Класс III включает в себя гены, кодирующие факторы комплемента, фактор некроза опухолей и некоторые другие.
Физиологическая функция аллелей и кодируемых ими антигенов HLA, относящихся к различным классам HLA, в значительной степени различается. Так, антигены HLA классов I и II принимают участие во взаимодействии между иммунокомпетентными клетками в процессе иммунного ответа. Но антигенам класса I принадлежит также и физиологическая функция обеспечения взаимодействия между всеми другими ядросодержащими клетками организма, вплоть до взаимодействия нейрон-синапс. Тем самым с помощью системы HLA обеспечивается целостное функционирование не только иммунной системы человека, но и организма в целом [19].
Что касается обеспечения развития самого иммунного ответа, то роль антигенов системы HLA здесь первостепенна. Дело в том, что именно молекулы антигенов HLA обеспечивают презентацию, т. е. представление иммунодоминантных пептидов, являющихся продуктом внутриклеточного протеолиза чужеродных антигенов, против которых и будет индуцирован, а затем и разовьётся иммунный ответ. Этой функции антигенов системы НLA способствует само строение ее молекул, которое, несмотря на выраженное различие в структуре молекулы антигенов HLA классов I и II, позволяет образовать на внешнем ее конце так называемую пептидсвязывающую бороздку, в которой и удерживается представляемый для распознавания пептид.
Общим для антигенов классов I и II является следующее. Антиген представляющая клетка осуществляет свое специфическое взаимодействие, представляя пептид в контексте собственной HLA-молекулы, идентичной таковой на клетке, воспринимающей информацию. Именно за открытие этого феномена, названного феноменом двойного распознавания, Цинкернагель и Догерти получили Нобелевскую премию. Действительно, этот феномен явился ключевым моментом и понимании основ физиологической регуляции иммунного ответа. Антигены HLA класса II обеспечивают взаимодействие антигенпрезентирующей клетки с Т-хелпером, а антигены HLА класса I - с Т-эффектором/киллером. Помогают им в этом различные молекулы корецепторы — CD4 для Т-хелперов и CD8 для Т-киллеров. Естественно, что различным явится и эффект этого взаимодействия. Так, распознавание пептидов в контексте молекулы HLA класса II ведет к формированию популяции Тх1 и Тх2-клеток, одни из которых индуцируют развитие гуморального иммунного ответа, а другие, явятся необходимым компонентом в индукции Т-киллеров. Что же касается антигенов гистосовместимости класса I, то Т-киллер, индуцированный против иммунодоминантного пептида, экспрессированного на поверхности клеток-мишеней в контексте антигенов HLA класса I, идентичного таковым, экспрессированным на Т-киллере, уничтожит их.
Молекулы МНС класса I синтезируются в цитозоле клетки, где до появления соответствующего пептида находятся в связи с так называемым тирозин-калретикулиновым комплексом (рис. 1). После связывания с пептидом происходят высвобождение и транспорт молекул HLA на поверхность клеток с участием кодируемых МНС "пептидных насосов" ТАР (от транспортеров, ассоциированных с антигенным процессингом).
В 1993 г было показано, что гетеродимеры TAPI и ТАР2 участвуют в окончательной сборке молекул антигенов класса I и презентации ими эндогенных пептидов. Молекулы, кодируемые геном TAP2, находятся в неравновесном сцеплении с антигенами HLA-DR и между генами ТАР1 и ТАР2 имеется высокая частота рекомбинаций. Установлено, что некоторые мутации в районе генов HLA-TAP ведут к потере презентирующей функции антигенов гистосовместимости класса I. Вполне возможно, что с нарушением антигенпрезентирующей функции TАР может быть связан высокий уровень ассоциации между аллелями гена ТАР1 и предрасположенностью к развитию такого аутоиммунного заболевания, как инсулинзависимый сахарный диабет. В го же время имеется исследование о том, что один из аллелей ТАР 1-локуса, а именно R659Q, для которого характерен дефект транскрипции РНК, выявляется на клетках мелкоклеточного рака легких. Наконец, имеются данные о том, что при синдроме Луи-Бар, характеризующемся наличием "голых Т-лимфоцитов", нарушение экспрессии антигенов НLA класса I связано именно с гомозиготным состоянием аллелей гена ТАР2.
В отличие от молекулы класса I обе цепи молекулы МНС класса II синтезируются в эндоплазматическом ретикулуме, откуда после их временного соединения с третьей инвариантной цепью они транспортируются в эндоцитарный компартмент, где они или встречаются и затем связываются с пептидом, или же (если этого не произошло) деградируют в лизосомах (рис. 1). После связи с пептидом, заменяющим инвариантную цепь, молекулы МНС класса II переходят на клеточную мембрану. Вытеснение пептидом инвариантной цепи молекул HLA класса II обеспечивают белки, кодируемые также системой HLA и названные HLA-DM. Эти белки катализируют замену "временного" пептида инвариантной цепи на специфический пептид.
Как указывалось выше, в целом связь между молекулами HLA и пептидами имеет много общего для антигенов HLA классов I и II. Однако и здесь имеются серьёзные отличия.
![]() Так пептид удерживается в
связывающей складке молекулы HLA класса I как за счет связи его N- и С-концов с
определенным мотивом "аллель-специфического" участка МНС, так и за
счет связи боковых цепей пептида с боковыми карманами молекулы МНС. Длины
пептидов, связывающихся с молекулой HLA класса I, — 8—10 аминокислот.
Так пептид удерживается в
связывающей складке молекулы HLA класса I как за счет связи его N- и С-концов с
определенным мотивом "аллель-специфического" участка МНС, так и за
счет связи боковых цепей пептида с боковыми карманами молекулы МНС. Длины
пептидов, связывающихся с молекулой HLA класса I, — 8—10 аминокислот.
![]() Пептиды, связывающиеся с
молекулой HLA класса II, более гетерогенны - 9—25 аминокислот. Списывающая бороздка молекул HLА класса II в отличие от
класса I
"открыта" для связывания с двух сторон, что создает возможность
большего полиморфизма в связях HLA + пептид. Более того, в молекуле класса II зоны связывания могут
выходить даже за связывающую складку. Все это дает возможность
"аккомодации" более широкого спектра пептидов к молекулам HLA класса
II по сравнению с таковыми класса I.
Пептиды, связывающиеся с
молекулой HLA класса II, более гетерогенны - 9—25 аминокислот. Списывающая бороздка молекул HLА класса II в отличие от
класса I
"открыта" для связывания с двух сторон, что создает возможность
большего полиморфизма в связях HLA + пептид. Более того, в молекуле класса II зоны связывания могут
выходить даже за связывающую складку. Все это дает возможность
"аккомодации" более широкого спектра пептидов к молекулам HLA класса
II по сравнению с таковыми класса I.
Переход исследований HLA на молекулярно-генетический уровень позволил по-новому взглянуть на физиологическую функцию системы HLA. Так, молекулы МНС приобретают стабильную форму и соответствующую трехмерную конфигурацию только после того, как в связывающий сайт ее складки встраивается пептид. Только после этого молекула МНС способна мигрировать на поверхность клетки, где она готова выполнить свои функции. Удаление пептида из пептидсвязывающей структуры МНС, экспрессированной на клеточной мембране, нарушает ее трехмерную конфигурацию, лишая возможности функционировать, и ведет к распаду. Комплекс МНС + пептид является чрезвычайно стабильным, очищается и кристаллизируется в единой структуре. Этот комплекс остается на поверхности клетки в течение нескольких недель, что позволяет многим "проходящим" Т-клеткам сканировать представляемый собственной молекулой МНС пептид. Наконец, каждый пептид связывается (и удерживается в складке) с инвариантным участком, характерным для каждого из аллелей молекулы МНС и имеющим определенный мотив аминокислотных остатков, участвующий и таком связывании. Таким образом, в связь с конкретным пептидом вовлекаются конкретные же участки антигенов — аллельные варианты молекул МНС, что по сути и является основой генетического контроля иммунного ответа.
Имеющаяся в настоящее время возможность анализировать аминокислотные последовательности всех аллельных вариантов антигенов HLA, включая участки, определяющие их специфичность, а также структуру пептидов, определяющих специфичность различных чужеродных агентов, включая болезнетворные, позволяет заранее предсказать соответствие тех или иных иммунодоминантных пептидов тем или иным участкам молекулы МНС. Таким образом, можно заранее предсказать генетический ответ или его отсутствие на тот или иной агент.
В свою очередь это даст возможность не только заранее решить вопрос о том, ответит ли данный индивидуум на вакцинацию против того или иного болезнетворного агента, но и предсказать, насколько этот ответ будет физиологичен, а, следовательно, позволит прогнозировать возможность развития ряда заболеваний аутоиммунного генеза (например, ревматоидный артрит и инсулинзависимый сахарный диабет), в генезе которых, возможно, лежит также комплементарность иммунодоминантных пептидов инфекционных агентов конкретным эпитопам аллелей НLА.
Экстремальный аллельный полиморфизм системы HLA является "мощным механизмом вариабельности и естественного отбора" человека как вида и позволяет ему противостоять постоянно эволюционирующему множеству патогенов. Доказательством этому в историческом плане может служить почти полное вымирание целых народов (в частности, американских индейцев в период открытия Америки), обладающих - как мы точно теперь знаем - весьма низким по сравнению с другими этническими группами полиморфизмом системы HLA.
В последние годы стадо известно, что полиморфизм системы HLA. помимо ранее установленного межрасового и межэтнического различия, имеет также и внутриэтнические различия. Следует отметить, что молекулярно-генетический уровень генотипирования позволяет сегодня вплотную приблизиться к пониманию генетически обусловленной физиологической резистентности человека к определенным заболеваниям на популяционном уровне.
Генам главного комплекса гистосовместимости, помимо вышеописанной физиологической функции генетического контроля специфического иммунного ответа, принадлежит ещё ряд важнейших физиологических функций. Описанию одной из них (генетическому контролю качества иммунного ответа) была посвящена работа, недавно опубликованная в Российском физиологическом журнале им. И. М Сеченова. Речь идет об ассоциированном с системой HLA контроле активности различных субпопуляций иммунокомпетентных клеток, что и свою очередь существенным образом сказывается на конечном уровне, т е. на качестве иммунного ответа человека. При этом, естественно, следует помнить, что эта функция является "вторичной" и реализуется только в случае, если организм человека генетически способен отвечать на данный агент. Предпосылкой развития данного направления можно считать предположение, выдвинутое W. Bodmer и J. Bodmer еще в 1978 г. о том, что на формирование HLA-профиля европеоидной популяции в значительной степени оказали влияние имевшие место в средние века эпидемии таких заболеваний, как чума, оспа, холера и т д. В результате этого среди выживших оказался значительный процент людей с определенными HLA-генотипами, в первую очередь с генотипом HLA-A1 В8 DR3 [10]. Этот генотип, как предположил W. Bodmer, обеспечивает более высокую резистентность к инфекционным заболеваниям и является на сегодняшний день генетическим маркером европеоидной популяции. Следует отметить, что это предположение было подтверждено на примере недавних вспышек брюшного тифа в Суринаме, когда среди выживших европеоидов значительный процент составили лица с гаплотипом HLA-A1 В8 DR3. Одновременно с этим W. Bodmer высказал справедливое предположение, что реализации этого эффекта могла быть связана только с ассоциациями между конкретными HLA-спецнфичностями и HLA-гаплотипами и иммунным ответом. Учитывая тот факт, что с одними и теми же гаплотипами HLA оказалась связана устойчивость к самым различным инфекционным агентам, логично было предположить, что подобного рода ассоциация с HLA может быть связана не только с самой генетически обусловленной отвечаемостью к конкретному инфекционному агенту, но и с теми звеньями иммунного ответа, которые принимают участие в его реализации, т. е. в конечном эффекте. Именно это в настоящее время и подразумевается под качеством иммунного ответа.
К настоящему времени достаточно хорошо известно, что между отдельными HLA-специфичностями и HLA-гаплотипами существуют положительные и отрицательные ассоциации с теми или иными показателями иммунного статуса, как то количество и функциональная активность клеток CD4+ CD8+, ЕКК, фагоцитирующей функции нейтрофилов и т. д. Следует, однако, отметить, что абсолютное число работ в этом направлении ранее выполнялось при изучении кавказоидной популяции.
В последние годы удалось показать, что ассоциированные с HLA показатели иммунного статуса могут различаться а разных этнических группах. Примером этого может быть исследование ассоциаций между отдельными параметрами иммунного статуса и HLA-специфичностями в двух этнических группах — русские (кавказоиды), буряты (ориенты).
Следует отметить, что исследование данной физиологической функции системы НLA, несмотря на то что оно стало развиваться относительно недавно, является весьма перспективным как в фундаментальном аспекте — в плане установления молекулярных механизмов указанных ассоциаций, так и в практическом, поскольку это направление имеет значение в плане прогноза возможности неблагоприятных воздействий (в том числе техногенных) окружающей среды на представителен различных этнических групп [19].
Глава 2. Ассоциация туберкулёза с различными генетическими факторами
Туберкулез вызывается микобактериями туберкулеза, медленно растущими кислотоустойчивыми бациллами. Воскоподобная клеточная стенка микобактерий, которая состоит из нескольких гликолипидов, таких как липоарбиноманнан и фосфоинозитолманнозид и длинной цепочки жирных кислот (50-80 атомов углерода) ответственны за медленный рост, кислотоустойчивость, устойчивость ко многим обычным антибиотикам и дезинфектантам. Отдельные вирулентные факторы не были описаны, но это может измениться, так как недавно был расшифрован геном микобактерий туберкулеза. Вдобавок, усилия должны быть направлены на определение функциональной нагрузки генома и белков Mycobacterium tuberculosis. Это связано с тем, что срочно необходима вакцина лучшая, чем ВЦЖ с её низкой эффективностью. Данная вакцина должна достигнуть сильного цитотоксического и воспалительного Т-клеточного ответа для уничтожения туберкулезных бацилл.
Понимание важной роли генетических факторов в развитии туберкулеза пришло в первую очередь из эпидемиологических и близнецовых исследований. Так, в нескольких работах было показано, что степень устойчивости к M. tuberculosis у человека коррелируется с регионом его происхождения – предки более предрасположенных к заболеванию индивидов чаще всего происходил из областей, где туберкулез не распространен. Кроме того, частота клинического туберкулеза особенно высока во время эпидемий в популяциях, ранее не встречавшихся с данной инфекцией, в частности, у американских и канадских индейцев.
Опубликованы исследования генов, ответственных за предрасположенность к туберкулезу у человека. Так, у жителей Камбоджи была показана ассоциация аллеля HLA-DQB1*0503 II с заболеванием. Во многих популяциях предрасположенность к проказе ассоциирована с HLA-DQB2. С проказой ассоциирован также полиморфизм в области промотора гена TNFA.
Показано, что с туберкулезом связаны три точечные замены в гене белка, связывающего маннозу (MBL). Причем частота этих вариантов была достаточно высока как у европеоидов, так и у африканцев и австралийских аборигенов.
В последнее время получены доказательства связи туберкулеза с полиморфизмом гена рецептора к витамину D (VDR). Показаны ассоциации с туберкулезом полиморфизма генов, кодирующих интерлейкин-1β (ILIB) и его рецепторный антагонист (ILIRA). Ведутся исследования также и других генов, рассматриваемых как кандидаты на роль генов предрасположенности к туберкулезу, исходя из их функции (NOS2, TLR, NAT2, GST) [1].
Вместе с тем существуют четкие причинно-следственные отношения между редкими менделирующими иммунодефицитами по Т-клеткам или фагоцитам и тяжелыми формами туберкулеза. Пациенты с такими заболеваниями в значительной степени чувствительны к инфекции не только M. Tuberculosis, но и другими микроорганизмами.
На основании имеющихся на сегодняшний день данных сформулировано предрасположение о непрерывном спектре генетического контроля предрасположенности к туберкулезу у человека: моногенные формы – варианты с эффектом главного гена (олигогенные формы) – полигенная подверженность. Прогресс в молекулярно-генетических исследованиях предрасположенности к заболеванию будет, вероятно, возможен только при комплексном анализе. Возможно, на всех уровнях генетического контроля участвует один ген, имеющий редкие мутации, ответственные за менделирующие тяжелые фенотипы, относительно редкие варианты, обусловливающие основной эффект, и распространенные в популяциях полиморфизмы, в умеренной степени определяющие риск развития заболевания [8].
Поиск такого гена (генов) на сегодняшний день актуальная задача. Кроме того, важным представляется изучение функционального полиморфизма известных генов-кандидатов туберкулеза в популяциях различного этнического состава с разной частотой заболевания.
Глава 3. Персистентные бактериальные инфекции: интерфейс патогена и иммунная система хозяина
Персистентные бактериальные инфекции включают в себя M. tuberculosis, Salmonella enterica и др., которые являются значительной проблемой для здоровья населения. Увеличивается количество лекарственно-устойчивых штаммов M. tuberculosis и S. typhi. M. tuberculosis и S. typhi вызывают заболевания, часто ассоциированные с HIV инфекцией.
Когда патогенный микроорганизм впервые инфицирует своего хозяина, обычно происходит драматическая активация врожденного и адаптивного иммунного ответов, что приводит к проявлению симптомов болезней. Адаптивная иммунная система хозяина обычно очищает организм от внедрившегося патогенна. Хотя некоторые патогенные бактерии способны поддерживать инфекционный процесс у млекопитающих даже при развитии воспаления, специфических антимикробных механизмов и сильного адаптивного иммунного ответа; в дальнейшем развивается персистентная инфекция. Микобактерии туберкулеза вызывают длительную инфекцию и могут служить причиной острых или хронических заболеваний; они также могут бессмысленно персистировать и реактивироваться в дальнейшем [3].
Персистентная колонизация бактериями происходит без видимых клинических проявлений. Хотя даже при отсутствии клинических симптомов инфекция несет некоторый риск для хозяина. Индивиды, зараженные микобактериями туберкулеза, рискуют при реактивации патогенна заразиться активной формой туберкулеза, которая опасна для жизни. Длительная персистенция бактерий в привилегированной нише хозяина макрофагальной вакуоли – вызывает несколько фундаментальных биологических вопросов. Например, каков репликативный и метаболический статус бактерии во время бессимптомной персистенции, и как им так долго удается избежать действия иммунного ответа хозяина. Сейчас начинают понимать бактериальные и факторы хозяина, которые вовлечены во взаимодействие патоген-хозяин в течение персистирующей инфекции.
Возможность вызывать персистирующие инфекции – фундаментальный аспект взаимодействия между многими различными вирусными, бактериальными патогенами и их хозяином-млекопитающим.
3.1 Персистентные микобактериальные инфекции
Патогенные микобактерии вызывают некоторые длительные инфекционные заболевания у их хозяев. M. Tuberculosis вызывают туберкулез, одно из самых древних известных человеческих заболеваний, этими бактериями по различным оценкам инфицирована треть населения Земли. Первоначальное заражение микобактериями ведет к репликации инициального сайта инфекции в легких. Это сопровождается бацилемией, во время которой наибольшее число бактерий рассеиваются в нелегочных органах региональных лимфатических узлах. Мигрируют M. Tuberculosis внутри ДК. Адаптивный иммунный ответ и ограничение бактериального роста происходит после их диссеминации, чему способствует доставка бактерий в лимфоидные органы. У многих инфекционный процесс заканчивается после инициации адаптивного иммунного ответа. Хотя у некоторых организм никогда полностью не очищается от патогена. При персистентном заражении люди могут стать носителями на многие годы и даже в течение всей жизни. Существует риск, что бессимптомная инфекция перейдет в высококонтагиозный, клинически активный и потенциально опасный для жизни болезненный статус, известный как реактивация туберкулеза. Риск перехода в клинически активную форму очень велик после инициации инфекции, часто это происходит у иммунологически компромиссных индивидов (новорожденных, людей старческого возраста и инфицированных ВИЧ).
3.2 Выживание микобактерий
Персистирующие микобактерии находятся в гранулемах. Хотя точная локализация живых патентных микобактерий во время персистирования остается спорной. Бактерии часто находят в макрофагах внутри гранулем, которые формируются в ответ на персистенцию внутриклеточных патогенов (рис. 2). Туберкулезные гранулемы человека и мышей состоят из организованной коллекции макрофагов, Т-лимфоцитов, некоторых В-лимфоцитов, дендритных клеток, фибробластов. Считается, что гранулемы начинаются с агрегацией мононуклеарных фагоцитов, которые окружают индивидуальные инфицированные макрофаги. Данные макрофаги становятся активированными и в некоторых случаях макрофаги сливаются в гигантские клетки, которые также формируются в ответ на другие персистирующие инфекции, в частности, вирусные. Т-лимфоциты и другие иммунные клетки также участвуют в процессе образования гранулемы. Развивающееся поражение закрывается окружающими эпителиальными тканями, которые имеют плотные интердигитированные клеточные мембраны, формирующие оболочку, похожую на молнию и соединяющую соседние клетки. В центре гранулемы обычно находится очаг казеозного некроза – участок клеточных осколков. Как микобактерии выживают внутри данного поражения в течение многих лет? Одна из гипотез гласит, что персистентные бактерии находятся в нерепликативной стадии или имеют низкий уровень репликации в центре казеозного очага. Доказательство того, что у человека персистентные бактерии в дремлющем состоянии, в результатах культурирования и окрашивания пораженных тканей пациентов, подвергшихся химиотерапии. Это, возможно, является ошибкой при культивировании. Альтернативная гипотеза того, как постоянный бактериальный груз поддерживается, состоит в том, что существует баланс между бактериальной репликацией и действием иммунной системы.
3.3 Выживание внутри макрофагов
Патогенные микробактерии инициируют длительную инфекцию, внедряясь в макрофаги и предотвращая нормальное созревание фагосом. Возможность микобактерий реплицироваться и/или выживать в макрофагах играет существенную роль в персистенции in vivo. Это черта, с помощью которой различают патогенные и непатогенные штаммы.
Инфицированные макрофаги становятся главными резервуарами микобактерий. Были описаны случаи распространения патогенна внутри макрофагов. Микобактерии вмешиваются в созревание фагосом, блокируя слияние образовавшихся фагосом с эндосомами и лизосомами и изменяя мембранные протеины, которые в норме способствуют образованию фаголизосом. Также у патогенных микобактерий выработался механизм, который позволяет им персистировать в макрофагальных фаголизосомах. Исследования показали, что внутри гранулем лягушки ≈ 60 % интактных бактерий вида М.marinum, которые близки к M. tuberculosis. Уровень фаголизосомального слияния коррелирует с уровнем макрофагальной активации. Микобактерии имеют два механизма адаптации к интрамакрофагальному выживанию: ограничение фаголизосомального слияния или адаптация к фаголизосомальным условиям.
В последних публикациях сказано, что микобактерии имеют временные и иммунно-опосредованные различия в генной экспрессии в активированных in vitro и в макрофагах, изолированных от инфицированных тканей. Последние исследования показали различные выживания микобактерий в типе 1 (ИЛ23-продуцирующие) и типе 2 (ИЛ10-продуцирующие) макрофагов. Иммунный статус макрофагов имеет важную роль в персистенции микобактерий. ИФНγ – критический компонент иммунитета при туберкулезе, он активирует инфицированные макрофаги, что приводит к ингибированию репликации микобактерий. Важность данной молекулы в контроле микобактериальных инфекций доказывается открытием ИФНγ-связанных генетических мутаций, при которых появляется предрасположенность к туберкулезу. ИФНγ индуцирует экспрессию NO-синтетазы 2 (NOS2) и недавно идентифицированного NOS2-независимого, 47 кДа гуанозин-3-фосфат протеина LRG-47; оба пути важны в контроле интрацеллюлярной репликации микобактерий. Хотя часть бактерий всё равно способна выживать в макрофагах, возможно, благодаря механизмам ингибирования STAT-1 опосредованного ИФНγ транскрипционного ответа и/или супрессии секреции ИЛ12 – провоспалительного цитокина, который способствует усилению продукции ИФНγ [5].
3.4 Иммунный ответ на персистирующие микобактерии
Пока мало известно об иммунных механизмах, которые вовлечены в ответ против персистирующих микобактерий. В последних работах с использованием методов молекулярных отпечатков было показано повторное заражение иммуннокомпетентных людей новыми штаммами M. Tuberculosis. Это доказывает, что иммунитет к туберкулезу может быть неполным и что повторное заражение играет немаловажную роль.
Роль адаптивного иммунного ответа при персистенции микобактерий очень важна. Есть некоторые свидетельства, что CD8+ Т-клетки секретируют большую часть ИФНγ. Во время острой фазы болезни большую часть ИФНγ продуцирует CD4+ Т-клетки, доказывая различную активацию Т-лимфоцитов в эти фазы инфекционного процесса. В дополнение к продукции ИФНγ активные CD8+ Т-клетки контролируют персистентные инфекции.
Продукция иммунносупрессорных цитокинов, таких ИЛ10 и ТФРβ, была описана у людей с активным туберкулезом и повышение продукции ИЛ10 в легких у мышей с хронической микобактериальной инфекцией. Это свидетельствует о том, что ИЛ10 может способствовать реактивации хронического туберкулеза.
Глава 4. CD-1 и CD-1-рестриктированные Т-клетки при инфекциях, вызванных внутриклеточными бактериями
Гликолипид-специфичные, CD-1a-, b-, c- зависимые цитотоксические Т-клетки вовлечены в ответ организма против туберкулеза (рис. 3). Молекулы CD-1 презентуют микобактериальные гликолипиды из различных внутриклеточных участков зараженной клетки. Во время микробной инфекции CD-1d-зависимые натуральные киллеры быстро продуцируют цитокины и выполняют регуляторную функцию [23].
Участие главного комплекса гистосовместимости (МНС) в Т-клеточном ответе было показано на вирусных системах, но его важность в бактериальных инфекциях и в ответе против простейших бесспорно. МНС-II-рестрикрированные CD8+ Т-клетки играют важную роль в защите организма против бактерий и простейших, тогда как МНС-I-рестриктированные CD8+ Т-клетки важны в случаях вирусных инфекций. Первые Т-клеточные популяции выполняют хэлперную функцию, выделяются цитокины для активации макрофагов и/или В-клеток, тогда как последующие, главным образом, действуют, убивая зараженные клетки хозяина. Во время некоторых бактериальных инфекций вместе с обычными CD4+ и CD8+ Т-клетками также есть необычные Т-клетки для содействия в достижении устойчивости: это Тγδ-лимфоциты, которые распознают фосфолипиды и Тαβ-лимфоциты, которые контролируются неклассическими МНС и МНС-похожими молекулами. Т-клетки, контролируемые CD-1 молекулами и противодействующие бактериальным гликолипидам, также являются необычными Т-клетками.
4.1 Атигенпрезентующие молекулы
В цитоплазме белки разрушаются протеазами. Образовавшиеся пептиды затем трансформируются в эндоплазматическом ретикулуме специальными транспортными молекулами так называемыми транспортерами переработанного антигена (ТАР). В эндоплазматическом ретикулуме эти пептиды затем обрезаются для упаковки в щель, сформированную первым и вторым доменом тяжелой цепи МНС-I. После ассоциации с β2 микроглобулином (β2m), комплекс МНС-I- β2m транспортируется на клеточную поверхность, где презентует пептиды для CD8+ Т-клеток. Молекула МНС-II состоит из двух тяжелых цепей: α-цепь и β-цепь, первые домены обоих цепей образуют щель, в которую загружается пептид в поздних эндосомально-лизомальных отделах. Пептиды, которые презентуются молекулами МНС-II, образуются в эндосомально-лизомальной системе под действием протеаз (таких как аспарагинилпептидаза, катепсины). Благодаря большому полиморфизму молекул МНС, каждая обладает уникальным гаплотипом. Это гарантирует то, что огромное множество антигенных пептидов будет презентовано и исключает возможность, что какой-то патоген избежит распознавания Т-клетками. Различные антигенные пептиды выбираются разными видами МНС. В противоположность классическим молекулам МНС неклассические МНС-Ib и CD-1 не обладают полиморфизмом. Поэтому антигенные лиганды, презентуемые данными молекулами Т-клеткам, должны быть более устойчивыми [24].
До недавнего времени считалось, что Т-клетки оказывают влияние на пептидный антиген, тогда как В-клетки могут распознавать протеины сахара, гликолипиды, нуклеиновые кислоты и другие виды антигенов. Эта теория была подвергнута сомнению, когда обнаружили, что CD-1 молекулы презентуют гликолипидные антигены Т-клеткам (рис. 4). Есть два вида молекул CD-1 CD-1a, CD-1b CD-1c из первой группы, CD-1d из второй группы. Обе группы презентуют антиген в человеческом организме и в организме некоторых млекопитающих, таких как кролик. У мыши антиген презентуют только молекулы СD-1 из второй группы. CD-1 молекулы похожи на молекулы МНС-I тем, что они состоят из α-цепочки, включающей три домена, которые нековалентно связаны с β2m. Анализ кристаллической структуры CD-1d показал, что α-цепочка формирует щель между первым и вторым доменами, которая уже и глубже, чем у молекул МНС 1-го класса. CD-1 антиген-связывающая щель не способна формировать водородные связи с пептидным антигеном как это делает молекула МНС 1-го класса, но хорошо подходит для гидрофобного взаимодействия. В добавок к кортикальным тимоцитам, группа I СD-1 молекул первая экспрессируется в дендритных клетках (ДК), которые являются важнейшими антигенпрезентующими (АПК) для Т-клеток. Группа II CD1 молекул наоборот, в основном находится на эпителиальных клетках, кортикальных тимоцитах и гепатоцитах, но они тоже могут быть экспрессированы на АПК таких, как ДК, макрофагах и β-клетках. При микобактериальной инфекции in vitro возрастает экспрессия CD1d молекул на поверхности мышиных ДК и макрофагов [23].
4.2 Презентация микобактериальных липидов группой I CD1 молекул
Исследования, проведенные Порцелли, Бреннер, Кроненберг и Модлин доказали, что CD1a, CD1b, CD1c молекулы презентуют микобактериальные гликолипиды клеточной стенки. Микобактерии обладают клеточной стенкой, богатой гликолипидами, что очень важно для их устойчивости. Было доказано, что CD1 молекулы первой группы презентуют на Тαβ-клетках гликолипиды фосфоиннозитолманнозиды (PIM), липоарабиноманнан, (LAM) миколовые кислоты и гексозо-1-фосфоизопреноиды. Не было идентифицировано ни одного бактериального антигена, презентуемого CD1 молекулами второй группы.
CD1d-рестриктированные клетки имеют уникальный фенотип. Они экспрессируют на поверхности CD3 комплекс также хорошо, как и маркеры для NK, NK1-клеток. Более того, они экспрессируют высоко специфичный ТКР репертуар, включающий Vα14Jα281 комбинацию у мыши и гомологичную Vα24JαQ у человека. Поэтому считается, что NK Т-клетки похожи. Этот факт также подтверждается тем, что они реагируют с αGalCer.
4.3 Внутриклеточная локализация CD1 молекул
Фагоцитированный макрофагами бактериальный патоген попадает в фагосому, которая затем проходит через несколько стадий. Главные шаги, которые проходит фагосома:
1.Ранняя эндосомальная стадия, на которой фагосома сближается и трансферрином.
2.Поздняя эндосомальная стадия, на которой фагосома закисляется до оптимальной для лизосомальных ферментов pH.
3.Фагосома, в которой идет внутриклеточноке "пищеварение".
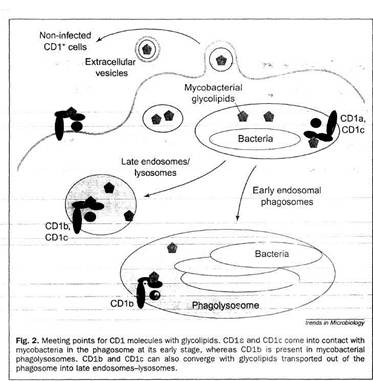
Микобактерии мешают созреванию фагосом, хотя механизм этого пока еще не известен. Микобактериальные фагосомы не до конца закислены, но бактерии получают доступ к трансферрину, который является главным депо железа не только для клеток хозяина, но и для микобактерий. Трансферрин и его рецептор двигаются вдоль ранней переработанной эндосомы, отдает готовое железо и затем возвращается на клеточную поверхность. Показано, что микобактериальные гликолипиды в самом деле нагружаются на CD1 молекулы в течении микобактериальной инфекции, эти молекулы могут быть найдены в компартментах. Внутриклеточная локализация CD1 молекул и микобактерий, покрывающих их была анализирована с помощью конфокусной сканирующей лазерной микроскопии дендритных клеток зараженного человека. При использовании различных внутриклеточных меркеров было найдено, что три CD1 молекулы первой группы локализованы в клетки по-разному. CD1а молекула по распределению похожа на МНС первого класса и точно также экспрессирована на клеточной поверхности. Кроме того, CD1а молекула была локализована на ранних рециклирующих эндосомах положительных для GT-Pase ARF6 и для гранул Бирбека клеток Лангерганса. CD1b и CD1c молекулы были найдены в поздних эндосомально-лизосомальных везикулах. Данные компартменты также служат как "доки" для разгрузки пептидов в МНС молекулы второго класса. В противопоставление CD1b, CD1с молекула обильно презентуется на плазматической мембране и в Tf-лабильных ранних эндосомах. Кроме того, было найдено, что многочисленные гликолипиды, включая LAM и PIM, отщепляются от микобактерий внутри фагосом и транспортируются из фагосомы в поздние эндосомы и лизосомы. CD1b и CD1с молекулы были также обнаружены в этих компартментах. CD1с молекулы могут также взаимодействовать с микобактериальными гликолипидами, потому что в зараженных клетках они были обнаружены в микобактериальных фагосомах, задержанных на ранней стадии активации [24].
CD1b молекулы были первоначально найдены в зрелых фаголизосомах. Как ранее было показано, созревание фагосом сопровождается потерей жизнеспособности микобактериями, поэтому эти фаголизосомы скорее всего состоят из нежизнеспособных микобактерий. Дальнейшие эксперименты показали, что зараженные клетки хозяина отщепляют гликолипиды, которые могут быть поглощены дендритными клетками, лежащими в их окрестности. Данные открытия объясняют транспорт антигенных гликолипидов из макрофагов в ДК, или из главных хозяйских клеток к главным АПК, экспрессирующим CD1 молекулы, в эксперименте in vitro. Предварительные данные свидетельствуют, что внутриклеточные везикулы различных размеров, такие как экзосомы и апоптические пузырьки, принимают участие в данном транспорте. Во время микобактериальной инфекции экспрессия на поверхности молекул МНС первого и второго класса и CD1b нерегулируема.
4.4 Рецептор для транспорта АГ
Маннозо-мембраные рецепторы (PPR) играют роль в понимании (распознавании) и презентации очищенного LAM с помощью CD1b. Этот R был идентифицирован в ранних эндосомах, но не в микобактериальных фагосомах, что доказывает его участие в распознавании чистых гликолипидов. РРR CD14 связывает не только липополисахариды грам "-" бактерий, но также некоторые микобактериальные гликолипиды. Этот R путешествует через фагосомы и поздние эндосомы-лизосомы зараженных микобактериями макрофагов. Отсюда следует, что CD14 может принимать участие в транспорте гликолипидов из фагосом в другие внутриклеточные компартменты. Так как CD14 экспрессируется только на макрофагах, то дендритные клетки, несущие CD1 молекулу, должны использовать другие R, для транспорта гликолипида. Предполагается, что гликолипиды транспортируются из зараженных макрофагов в незараженные ДК для презентации, а также, что CD14 может принимать участие в транслокациях гликолипида внутри макрофага. Как было показано для LAM, гликолипиды могут встраиваться в мембрану хозяйской клетки и мигрировать вдоль фосфолипидного бислоя. В фагосомах CD1 может принимать гликолипиды из депо. Здесь загрузка CD1а и CD1с (но не CD1b) независима от низкого рH. Расщепленные микобактериальные гликолипиды могут быстро связываться с экспрессированными на клеточной поверхности молекулами CD1 с помощью механизма экстрацеллюлярной загрузки – этот процесс постулирован для CD1а и, возможно, CD1с.
Считается, что загружающие гликолипиды в CD1 молекулы могут включать шаперон-подобные молекулы для облегчения связывания половины гидрофобного липида с гидрофильной антиген-связывающей щелью. Также исследуется, какие микобактериальные гликолипиды нуждаются в переработке до того, как они будут связаны и презентованы молекулами CD1. было показано, что презентация гликолипида молекулами CD1b (но не CD1а) включает в себя транспорт гликолипидов в лизосомальные компартменты. Более того, эндосомально путешествующие CD1b, CD1с и CD1в молекулы содержат YXXZ эндосомально-целевую последовательность (Z содержит большую гидрофобную часть цепочки). Этот целевой мотив помогает ассоциации CD1 молекул с адапторным протеином (АР) их корректной внутриклеточной сортировке. При мутации данной последовательности отменяется презентация антигена молекулой CD1b. Кислая среда внутри лизосом может облегчить расщепление антиген – связывающий щели CD1 и обрезанию гликолипидов лизосомальными гликозидазами и липазами. Действительно, при проведении экспериментов с меченными радиоактивными атомами микобактериями было доказано, что микобактериальные гликолипиды ферментативно изменяются на их пути из фагосом.
Антиген-связывающая щель CD1 молекул, возможно, связывает две гидрофобные цепочки жирных кислот гликолипидов, тогда как гидрофильная углеводная часть высовывается для распознавания Т-клетками (рис. 4). Ферментативная модификация углеводной части может привести к дифференциации Т-клеточных эпитопов и, следовательно, к антигенной специфичности, несмотря на то, что CD1 молекулы неполиморфны. Ферментативная модификация жирных кислот может улучшить аккомодацию гликолипидов в щели CD1 молекул [23].
4.5 CD1d и NКТ-клетки при инфекциях
Знания о роли второй группы CD1 молекул и NКТ-клеток в антибактериальном ответе хозяина ещё ограничены. NКТ-клетки находятся первоначально в печени, где они продуцируют IL4 в ответ на лиганд ТКR. Стимуляция NКТ-клеток αGalCer индуцирует синтез ИЛ4 и ИФНγ, в результате иммунный ответ склоняется в сторону Тх2-типа. При инфекции, вызванной Mycobacteriym bovis, Bacille-Calmette Guerrin начальный интерлейкиновый взрыв NКТ-клеток модулирует продукцию ИФНγ. Это, возможно, достигается за счет индуцированного ВСG выделения ИЛ12. В самом деле, при выделении обоих цитокинов происходит сдвиг в сторону продукции ИФНγ. Введение анти-CD1 моноклональных антител приводит к незначительному улучшению течения листериоза. Параллельно увеличивается секреция ИФНγ, ИЛ17 и ТНФ, а секреция ТНФβ сильно снижается. Позже показана практическая роль ТНФβ в иммунной регуляции NКТ-клетками. Такое же анти-CD1 введение слегка усиливает туберкулез у мышей и снижает продукцию ИФНγ, ИЛ12 и ТНФ. Согласуется с этим то, что NКТ-клетки, контролируемые CD1, принимают участие в формировании гранулемы, индуцируемой микобактериальными гликолипидами, в частности РIМ. CD1 Knock out мыши, зараженные M. tuberculosis, не страдают от развивающегося туберкулеза по сравнению с диким типом мышей. Это различие может быть объяснено чрезмерностью иммунной системы, что способствует компенсации функций NKТ-клеток другими клетками у CD1 КО мышей. Или, возможно, что введение анти-СD1d АТ не только блокирует узнавание СD1 клетками NK, но также и заражение АПК. Интересен тот факт, что реагирующие клетки через CD1d и CD1c могут влиять на кальциевый наплыв в Т-клеточную линию, экспрессирующую СD1.
Регуляторную роль NКТ-клеток лучше всего демонстрируется на их роли в ЛПС-индуцированной реакции. Считается, что данная продукция ИФНγ является движущей силой ЛПС-индуцированного летального шока.
Хотя считалось, что быстрая продукция ИФНγ происходит NКT-клетками, но, возможно, что резидентные печеночные NКТ-клетки являются источником ИФНγ при ЛПС-индуцированной печеночной патологии. Было показано, что резидентные печеночные NКТ-клетки, ответственные за гепатотоксичность, активируются ИЛ-12, которая выделяется ЛПС-стимулированными Купферовскими клетками. Истощение NКТ-клеток возрастает при сопротивлении накоплению ИЛ-12 (ЛПС-индуцированная генерализованная реакция Шварумана). CD7 КО мыши с дефектом в продукции ИФНγ и сокращением числа резидентных печеночных NКТ-клеток устойчивы к ЛПС-индуцированному шоку. Порог активации NКТ-клеток бактериальными продуктами низок, поэтому возникает риск острой и тяжелой патологии, которая требует контррегуляции игибиторными цитокинами, такими как ИЛ-10 или ТФРβ. Такая чувствительность позволяет NКТ-клеткам быстро отвечать на проникновение микроорганизма, но несет риск возникновения чрезмерной реакции, приносящей вред хозяину. Интересно, что активация и экспансия NКТ-клеток не вызвана легким попаданием бактериальной флоры. Незараженные мыши содержат то же число NКТ-клеток, что их обычно выведенные сородичи.CD1а-, CD1b- и CD1с-зависимые Т-клетки убивают зараженные клетки – мишени перфорин-зависимым способом.
Они выделяют микробицидную молекулу, вместе с NKT-клетками гранулизин, которая способна убивать микобактерии также хорошо, как и другие патогенные бактерии, грибы и паразиты. Гранулизин не может добраться до патогенна, расположенного в фагосомах, поэтому зависит от кооперации с перфорином.
Открытие, что Т-клетки распознают липиды и гликолипиды, презентуемые CD1 белками, сильно расширило число потенциальных микробных антигенов, преследуемых иммунной системой во время инфекции. Способность CD1d и NКТ-клеток активировать врожденный и адаптированный иммунные ответы привела к идее, что эти клетки могут модулировать устойчивость к инфекционным агентам. В добавок, CD1d NКТ-клетки могут непосредственно внести вклад в резистентность хозяина, так как они выделяют множество эффекторных молекул, которые могут воздействовать на антимикробный эффект. Хотя многое было изучено о CD1d NКТ-клетках при использовании синтетического АГ α-галактозинцерамида (αGalCer), остается область, недостаточно изученная, о физиологии собственных и микробных антигенов, которые могут быть презентованы с помощью CD1d [24].
4.6 αGalCer специфически активирует CD1d iNКТ-клетками
Сложный αGalCer – синтетический гликолипид, основанный на связанных липидах, очищенных из морской губки, которой индуцировали регрессию опухоли. Танигичи и др. показали, что антиопухолевый эффект αGalCer зависит от iNКТ-клеток, что α-гликозилцерамид презентуется CD1d. Узнавание αGalCer - общая черта для мышиных и человеческих iNКТ-клеток. αGalCer связывается с очищенным CD1d белком в бесклеточных системах, в результате αGalCer/CD1d комплекс может активировать iNКТ клеточные гибридомы. Хотя их структура напоминает таковую из других CD1-презентуемых антигенов, α-гликозилцерамид не продуцируется клетками млекопитающих или патогенных микробов. Несмотря на это возможность активировать iNКТ-клетки сделала αGalCer необходимым реагентом для изучения iNКТ.
In vivo прием αGalCer имеет глубокие иммунологические последствия, которые опосредованы CD1d iNКТ-клетками; αGalCer-зависимая модуляция иммунного ответа не происходит у мышей, которые испытывают недостаток CD1d или iNКТ-клеток. Этот эффект включает активацию NК, В-клеток и Т-клеток в пределах 3-24 часов, которые детерминируются индукцией ранних маркерных клеток активации, таких как CD69 (В, Т и NК), CD80 и CD86 (В-клеток). Например, после введения αGalCer iNКТ-клетки активируют NК к продукции ИФНγ. αGalCer активированные iNКТ-клетки ингибируют дифференцировку Тх2. Распознавание iNКТ-клетками αGalCer, презентуемого ДК, ведет к CD40/CD40L-зависимой продукции ИЛ12 дендритными клетками. Таким образом, под влиянием iNКТ-клеток ДК созревают. Напротив, продукция ИЛ4 iNКТ-клетками зависит от ИЛ12. Таким образом, сложные взаимодействия и регулирующие сети обратной связи между АПК и iNКТ-клетками могут определять развитие иммунного ответа по Тх1 или Тх2-типу.
Вдобавок к этому эффекту на иммунный ответ, αGalCer оказывает влияние iNКТ-клетки непосредственно. В противоположность обычным Т-клеткам, распространения iNКТ-клеток были обнаружены после активации. Фактически после стимуляции анти-CD3 моноклональными антителами или αGalCer тяжело обнаружить iNКТ-клетки, потому что они подвергаются апоптозу [25].
Глава 5. Отличительные частоты генотипа цитокинов среди канадских аборигенов и кавказских популяций
Генетическое разнообразие, связанное с человеческим иммунным ответом, - ключевой фактор выживания индивидуумов и популяций в истории человечества. Разнообразие популяций в восприимчивости к болезням и сопротивлении было идентифицировано и связано с различиями в цитокине mRNA и уровнях экспрессии белков. Полиморфизмы в регуляторных областях генов цитокинов могут влиять на уровни транскрипции генов. Они были ассоциированы с восприимчивостью к аутоиммунным заболеваниям, таким как ревматоидный артрит, менингит и сепсис. Канадские аборигены имеют более высокую частоту полиморфизма цитокинов, что благоприятствуют низкой продукции TNFα, ИФНγ и ИЛ10 и высокой продукции ИЛ6 по сравнению с кавказским населением. Эволюция этого уникального генотипа цитокинового профиля может быть связана с адаптацией аборигенов к давлению отбора окружающей среды, в которой преобладают гельминты, паразиты и грибковые инфекции [22].
Инфекционные патогенны, такие как M. tuberculosis и RSV продолжают иметь разрушительный эффект в некоторых североамериканских популяциях. Например, в Канаде 43% из всех новых активных и рецидивных случаев туберкулеза происходят среди аборигенов, 37% случаев – среди индивидуумов иностранного происхождения и 20% - среди рожденных в Канаде, но не аборигенов. В то время как большинство изучений сфокусировано на социоэкономических различиях, небольшое внимание тратится на генетические различия, которые могут существовать среди человеческих популяций и регулировать качество иммунного ответа на данный патоген. Изучения инбредных мышей ясно демонстрируют, что генетический фон играет ключевую роль в определении качества цитокинового ответа (Тх1 против Тх2), который в свою очередь затрагивает способность хозяина уничтожать инфекционного агента.
С завершением проекта расшифровки генома человека стало очевидно, что полиморфизмы одного нуклеотида (SNPs) являются обычными и в зависимости от локализации могут затрагивать уровни транскрипции генов. В контексте иммунного ответа хозяина на инфекционного агента идентификация различий в цитокиновых SNPs профилях может иметь важные значения для сопротивления организма хозяина или восприимчивости к данному специфическому агенту. Текущее изучение описывает частоту SNPs, которая, как известно, коррелирует с дифференциальной экспрессией генов ИЛ6, ИЛ10, ТНФα, ИФНγ и ТФРβ в кавказской, канадских аборигенов и филиппинской когортах и постулирует, почему определенные цитокиновые SNPs профили могут развиваться на популяционном уровне.
В двух независимых опытах было найдено, что этнические популяции имеют статистическое различие в цитокиновых SNPs профилях. Вначале было замечено, что цитокиновые генотипы у североамериканских аборигенов и филиппинцев с ESRD имеют значительные различия по сравнению с кавказцами с конечной стадией данной почечной болезни. Во втором опыте, в который были вовлечены нормальные контрольные популяции кавказских индивидуумов и аборигенов, были подтверждены первоначальные наблюдения.
По сравнению с когортами аборигенов и филиппинцев, кавказцы поддерживают высокую частоту ТНФα и ИФНγ аллелей SNPs, чья фенотипическая экспрессия ассоциирована с увеличением продукции этих цитокинов. Противоположность кавказской когорте индивидуумы филиппинского происхождения имеют высокую частоту ИЛ6 аллели, ассоциированную с высокой продукцией данного цитокина. Аборигены поддерживают статистически высокую частоту аллеля "G" в ТНФα и поэтому имеют низкую продукцию этого цитокина по сравнению с кавказской когортой. Точно также аборигены поддерживают статистически высокую частоту аллеля "А" в ИФНγ, которая ассоциирована с низкой продукцией этого цитокина.
Кавказцы могут поддерживать Тх1 иммунный ответ, в то время как SNPs частоты в регионах промотеров цитокинов аборигенов и филиппинцев имеют тенденцию к поддержанию Тх2 иммунного ответа. Для объяснения данных генетических различий нужно учесть исторический контекст, в котором развивались популяции с их микробной средой [22].
Старая мировая кавказская популяция в течение последних 11 тысяч лет занималась охотой и собирательством. Для одних это включало одомашнивание растений и животных, оседание и последующая урбанизация. Эти изменения в пропитании и образцах поселения закончились глубокими изменениями в микробной среде Старого Света. С появлением сельского хозяйства и урбанизации так называемые "инфекции толпы" стали превалирующими, и эпидемии оспы, кори, чумы и туберкулеза распространялись по Европе [21]. С данными патогенами был связан высокий уровень смертности, что оказывало интенсивное селективное давление на популяцию. Например, учитывая высокую распространенность туберкулезной инфекции, ведущей к преждевременной смерти в Европе (примерно 18 столетие), выживали те индивидуумы, которые могли эффективно воздействовать на патоген с помощью гиперчувствительности замедленного типа. Этот тип ответа характеризовался высоким уровнем экспрессии цитокинов ТНФα и ИФНγ. Действительно, когда анти-ТНФα вводился пациентам с воспалением кишечника, то это ассоциировалось с возникновением или реактивацией туберкулеза, что подтверждает важную роль ТНФα как иммунного модулятора или нейтрализатора туберкулеза. Определенные SNPs в регионе промотера ТНФα были вовлечены в инфекционные болезни, такие как малярия.
Схожим образом ИФНγ имеет важную роль в защите организма хозяина от микобактерий, хотя продукция ИФНγ не может адекватно контролировать инфекцию без присутствия других цитокинов. До настоящего времени нет свидетельства от изучения популяций, что общие варианты в генах рецепторов к ИФНγ влияют на восприимчивость к туберкулезу. Были случаи инактивации мутаций в рецепторе к ИФНγ, которые были ассоциированы с чувствительностью к обычным непатогенным микобактериям. В пределах других цитокинов у животных моделей недавно было найдено, что экспрессия ИЛ6 макрофагами может препятствовать эффективному сдерживанию туберкулезной инфекции. При изучении кавказской популяции было замечено, что она поддерживает относительно высокую частоту SNPs цитокинов, что приводит к гиперчувствительности замедленного типа и низкому уровню экспрессии ИЛ6 по сравнению с другими когортами. Учитывая вышеупомянутую высокую распространенность туберкулеза в Европе с 1700 года до ранних 1900-х, когда была развита эффективная антимикробная терапия, можно объяснить цитокиновый SNPs профиль, наблюдаемый сегодня в кавказской популяции.
Популяции аборигенов Северной Америки испытали уникальный набор эволюционных давлений из-за их миграции через Берингов "Земной мост" (приблизительно 15-20 тысяч лет назад) и их изоляции от популяций Старого Света приблизительно с 1400 года нашей эры. Аборигены вели охотничий и собирательский образ жизни (это существовало и в Старом Свете), это способствовало диффузному расселению с низкой плотностью населения. Анализ патологий в человеческих скелетных останках древних аборигенов указывает, что паразитические грибковые инфекции и недоедания присутствовали у древних людей. Употребление сырого или недостаточно приготовленного мяса, условия жизни в зимнее время и определенные образцы поедаемых диких растений привели к тесному контакту этих людей с грибковыми инфекциями и паразитами и сделали их уязвимыми к сезонным авитаминозам. Микробная среда способствовала позитивной селекции Тх2 типа адаптивного иммунного ответа для выживания. Действительно, изучение семейств аборигенов Южной Америки во время инфекции Shistosoma mansoni подтвердили защитную роль Тх2 типа цитокинов: ИЛ4, ИЛ6, ИЛ13, - в защите против паразитической инфекции. Чрезмерная экспрессия Тх2 типа цитокинов (ИЛ6, ИЛ10) индуцирует гиперактивность В-клеток, которая характерна для системной красной волчанки. Полиморфизмы в промотерах регионов ТНФα, ИФНγ, ИЛ10 и ИЛ6 ассоциированы с дифференциальными уровнями экспрессии данных цитокинов. Сохранение данных полиморфизов популяции может привести к селективному преимуществу. В контексте существующих исследовании факт, что цитокиновый SNPs профиль у канадских аборигенов искажен в сторону высокой продукции ИЛ6 и относительно низкой ТНФα, ИФНγ, поддерживая концепцию низкой распространенности M. tuberculosis в данных популяциях до контакта с европейцами.
SNP частоты цитокинов филиппинцев похожи с аборигенами Северной Америки. Общее азиатское наследие популяции аборигенов и филиппинцев и их параллельные миграции из европейского континента более 12 тысяч лет назад могли привести к данному сходству.
Изучения инфекционных болезней среди популяции аборигенов сосредотачивались на социоэкономических факторах, способствующих устойчивости к заболеваниям или восприимчивости. В большинстве данных исследований генетические различия между популяциями признаны способствующими факторами в восприимчивости к болезням или в устойчивости. Хотя основания для данного генетического неравенства остаются в значительной степени неизведанными. Чувствительность к туберкулезу, например, в относительно изолированной Южной Америке высока. Хотя индивиды с высоким уровнем питания и социоэкономическим статусом одинаково подвержены опасностям заболевания, как индивиды с низким уровнем питания и социоэкономическим статусом. Предполагается, что высокий уровень продукции антител и Тх2-опосредованной активации у южноамериканцев конкурирует с Тх1-опосредованной защиты, необходимой для эффективной борьбы против инфекционных болезней, таких как туберкулез. Популяции североамериканских аборигенов в Манитобе имеют самую высокую сферу действия туберкулеза относительно других местных популяций. Неравный риск заболевания между этническими популяциями может быть частично объяснен окружающими условиями и социоэкономическими различиями. SNPs цитокинов могут также играть роль в данной изменчивости.
В итоговом этническом кладе вероятен фактор наблюдаемых различий частот SNPs цитокинов. Данные различия между кавказской, популяцией аборигенов и филиппинцев могут частично отразить тот факт, что данные популяции развивались в ответ на селективное давление их микробных сред [22].
Глава 6. Ассоциация туберкулёза со специфичностями гена HLA-DR-B1 в различных регионах Тувы
Генетические факторы в значительной мере определяют восприимчивость к различным заболеваниям, в том числе и инфекционной природы. Туберкулез в этом отношении не является исключением. Определенный вклад в восприимчивость к туберкулезу вносят гены системы HLA, которые детерминируют различные иммунологические феномены. Имеются многочисленные работы, в которых обнаружена положительная ассоциация антигенов HLA с заболеванием туберкулезом. Считается, что наиболее значимыми являются ассоциации туберкулеза с генетическими маркерами локуса HLA-DR, поскольку в этом локусе располагаются гены иммунного ответа. Этот факт можно использовать для формирования по генетическим маркерам системы HLA групп риска в отношении заболевания туберкулезом. В то же время показано, что в различных популяциях с заболеванием туберкулезом ассоциируются разные антигены HLA.
В ряде работ не было обнаружено значительных различий во встречаемости антигенов HLA у больных туберкулезом и здоровых лиц. Возможно, это связано или с малочисленностью материала, или с неправильно подобранными сравниваемыми группами, поскольку в подавляющем большинстве работ обнаружена положительная ассоциация антигенов HLA с туберкулезом. В то же время исследования в разных регионах Республики Тува выявили положительную ассоциацию туберкулеза со специфичностями HLA-DR-B1 13(6) и HLA-DR-B1 14(6). Возможно, высокая заболеваемость коренного населения Тувы ассоциирована с названными специфичностями гена HLA-DR-B1, что связано с национальными особенностями коренного населения Республики Тува [9].
Глава 7. Распределение антигенов комплекса HLA у больных туберкулёзом и здоровых лиц в татарской популяции
Результаты изучения распределения антигенов HLA у здорового населения обследованных популяций (русской, молдавской, узбекской, туркменской и тувинской) вошли в сборник исследований по генофонду населения России и сопредельных стран, проводимых Российской академией наук.
Первая работа в этом по распределению антигенов HLA населения республики Татарстан была выполнена в 2003 г. в 4 районах Северо-Западной и Прикамской частей Татарстана (Арский, Балтасинский, Высокогорский и Атнинский). Татарское население этих районов проживает в указанной местности на протяжении жизни не менее 4 поколений, что установлено методом опроса.
Иммуногенетическому исследованию предшествовало изучение эпидемиологической ситуации по туберкулезу - заболеваемости, болезненности, смертности.
Изучено распределение антигенов HLA первого класса у здоровых лиц и больных активным туберкулезом органов дыхания, выявленных в 2002 г.
Статистически достоверная разница между частотами встречаемости антигенов трех исследованных локусов системы HLA обнаружена только для антигена HLA-B22. Это указывает на то, что по крайней мере в этой части Татарстана у больных активным туберкулезом легких существует ассоциация с антигеном В22 [2].
Таким образом, в результате исследования распределения антигенов комплекса HLA первого класса в татарской этнической группе (4 района Татарстана) установлено, что у больных активным туберкулезом легких существует ассоциация с антигеном HLA-B22.
ЗАКЛЮЧЕНИЕ
![]() Открытие антигенов
тканевой совместимости у человека HLA (Human Leucocyte Antigens) положило начало
успешному развитию кооперативных интернациональных исследований, в которых
участвуют все лаборатории мира, занимающиеся тканевой совместимостью. Проведено
исследование распределения компонентов комплекса HLA в большинстве популяций
мира.
Открытие антигенов
тканевой совместимости у человека HLA (Human Leucocyte Antigens) положило начало
успешному развитию кооперативных интернациональных исследований, в которых
участвуют все лаборатории мира, занимающиеся тканевой совместимостью. Проведено
исследование распределения компонентов комплекса HLA в большинстве популяций
мира.
Успехи трансплантологии, с одной стороны, и достижения клинической генетики и иммуногенегики — с другой, диктуют необходимость продолжать исследования в нашей стране.
Подобные исследования были начаты в 80-е годы XX столетия в Центральном НИИ туберкулеза РАМН под руководством акад. РАМН А. Г. Хоменко и проф. В. И. Литвинова и получили развитие в последние годы [16].
В условиях экспедиций в ряде регионов России и стран СНГ проведены комплексные клинические, генетико-эпидемиологические и иммунологические исследования групп коренного населения с различной этнической принадлежностью и эпидемической ситуацией по туберкулезу. Изучение распределения компонентов комплекса HLA среди здорового населения и у больных туберкулезом легких проведено в русской, узбекской, туркменской, молдавской, тувинской популяциях. Для каждой популяции были обнаружены свои особенности в частотах встречаемости антигенов HLA и характерные для данной популяции ассоциации с восприимчивостью (или резистентностью) к туберкулезу легких.
В проведенных исследованиях в русской популяции Москвы и Московской области найдена ассоциация туберкулеза легких с антигенами В5 и В17, в молдавской — с антигенами В5 и В38, в узбекской — с антигеном В12, в армянской - с В12 и В35, в тувинской — с В15. Отличие в этом отношении татарской популяции от других (ассоциация с антигеном В22) может быть объяснено либо особенностями этногенеза всего татарского населения республики, либо генетическими особенностями татарского населения этих районов Татарстана, обособленного в генетическом плане в субизолят. Это может подтвердиться после иммуногенетического обследования большей части районов республики.
В ряде работ не было обнаружено значительных различий во встречаемости антигенов HLA у больных туберкулезом и здоровых лиц. В подавляющем большинстве работ обнаружена положительная ассоциация антигенов HLA с туберкулезом. В то же время исследования в разных регионах Республики Тыва выявили положительную ассоциацию туберкулеза со специфичностями HLA-DR-B1 13(6) и HLA-DR-B1 14(6). Возможно, высокая заболеваемость коренного населения Тувы ассоциирована с названными специфичностями гена HLA-DR-B1, что связано с национальными особенностями коренного населения Республики Тува.
СПИСОК ЛИТЕРАТУРЫ
1. Баранов В.С., Баранова Е.В., Иващенко Т.Э., Асеев М.В. Геном человека и гены "предрасположенности". Введение в предиктивную медицину. - 2000. - 271 с.
2. Гергерт В.Я., Валиев Р.Ш., Чуканова В.П. Распределение антигенов комплекса HLA у больных туберкулёзом и здоровых лиц в татарской популяции. // Проблемы туберкулёза и болезни лёгких. – 2004. - №2. – с. 45-46.
3. Гриппи М.А. Патофизиология легких. - 1997. - 344 с.
4. Иващенко Т.Э., Сиделева О.Г., Петрова М.А. и др. Генетические факторы предрасположенности к бронхиальной астме // Генетика. - 2001. - Т.37. - №1. - с.107-111.
5. Комогорова Е.Э., Костенко Е.В., Стаханов А.Н. Особенности иммунологических показателей у больных с различными формами туберкулёза лёгких. // Клиническая иммунология. – 2005. - №1 – с. 45-50.
6. Ляхович В.В., Вавилин В.А., Макарова С.И. и др. Роль ферментов биотрансформации ксенобиотиков в предрасположенности к бронхиальной астме и формировании особенностей её клинического фенотипа // Вестн. РАМН. - 2000. - №12. - С.36-41.
7. Макарова С.И., Вавилин В.А., Ляхович В.В., Гавалов С.М. Аллель NAT285 – фактор устойчивости к заболеванию бронхиальной астмой у детей // Бюллетень экспериментальной биологии и медицины. - 2000. - Т.129. - №6. - с.677-679.
8. Маянский А.Н. Туберкулёз (иммунологические и иммунопатогенетические аспекты). // Клиническая иммунология. – 2001. - №2. – с. 53-65.
9. Поспелов Л.Е., Матракшин А.Г., Ларионова Е.Е. Ассоциация туберкулёза со специфичностями гена HLA-DR-B1 в различных регионах Тувы. // Проблемы туберкулёза и болезни лёгких. – 2005. - №2. – с.23-24.
10. Поспелов Л.Е., Серова Л.Д., Калинина Н.М. HLA-DR-антигены у больных туберкулёзом и здоровых ревакцинированных БЦЖ лиц. // Проблемы туберкулёза и болезни лёгких. – 2003. - №2. – с.82-83.
11. Пузырев В.П. Медико-генетическое исследование населения приполярных регионов. - 1991. - 200 с.
12. Пузырев В.П. Состояние и перспективы геномных исследований генетической кардиологии // Вестн. РАМН. - 2000. - №7. - с.28-33.
13. Пузырев В.П. Генетика артериальной гипертензии (современные исследовательские парадигмы) // Клиническая медицина. - 2003. - 1. - с.12-18.
14. Пузырев В.П., Огородова Л.М. Геномная медицина в решении проблем пульмонологии // Вестн. РАМН. - 2000. - №12. - с.45-48.
15. Пузырев В.П., Огородова Л.М., Салюкова О.А. Генетические основы этиопатогенеза бронхиальной астмы // Сиб. мед. журнал. - 1998. - №3. - с.82-85.
16. Соафер В.Н. Международный проект "Геном человека" // Соросовск. образ. Журнал. - 1998. - №12. - С.4-11.
17. Степанов В.А., Пузырев К.В., Спиридонова М.Г. и др. Полиморфизм генов ангиотензин-превращающего фермента и эндотелиальной синтазы окиси азота у лиц с артериальной гипертензией, гипертрофией левого желудочка и гипертрофической кардиомиопатией // Генетика. - 1999. - Т.34. - №11. - с.1578-1581.
18. Суздальцева Т.В. Иммунопатологические аспекты аспирин-индуцированной бронхиальной астмы // Аллергология. - 1999. - №4. - с.16-18.
19. Хаитов Р.М., Алексеев Л.П. Физиологическая роль главного комплекса гистосовместимости. // Клиническая иммунология. – 2001. - №3. – с. 4-12.
20. Хаитов Р.М., Богова А.В., Ильина Н.И. Эпидемиология аллергических заболеваний в России // Иммунология. - 1998. - №3. - С.4-9.
21. Шевченко Ю.Л. Значение социальных факторов во взаимодействии человека и микроорганизмов. Роль здравоохранения в профилактике и лечении инфекционных заболеваний // Вестн. РАМН. - 2000. - №11. - с.7-11.
22. Larcombe L., Rempel J.D., Dembinski I. Differential cytocine genotipe frequencies. // Genes and Immunity. - 2005. - 6. – p.140-144.
23. Markus S., Samuel M. Behar. Role of CD1d-Restricted NKT Cells in Microbal Immunity. // Infection and Immunity. - 2003. - №10. – p.5447-5455.
24. Natural reviews / Microbiologi. - 2004. - №2. - p. 747-754.
25. Trends in Microbiologi. - 2000. - №9. - p.419-425.
ПРИЛОЖЕНИЯ
Рисунок 1. Процессинг и экспрессия HLA-пептида.
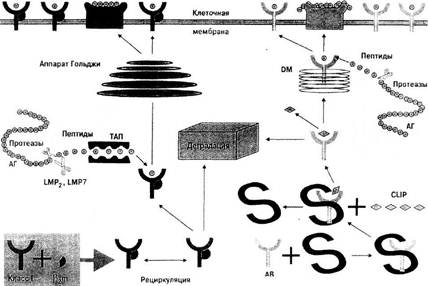
Рисунок 2. Персистентные микобактериальные инфекции и иммунный ответ хозяина.
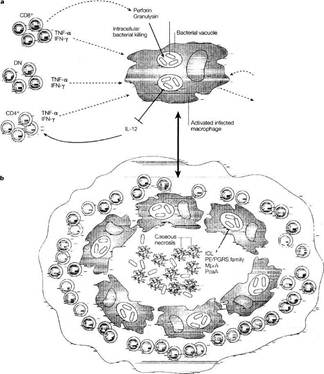
Рисунок 3. Т-клеточные популяции, вовлечённые в антимикробную защиту.
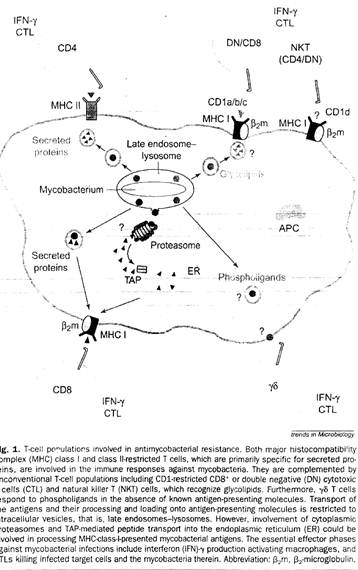
Рисунок 4. Встреча CD1 молекул с гликолипидами.
© 2009 База Рефератов