
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Особенности фармакологического действия нейропептидных препаратов
Курсовая работа: Особенности фармакологического действия нейропептидных препаратов
Введение
Глаукома
Описание основных групп нейропротекторов
Молекулярный механизм действия актовегина
Нимодипин
Ферментные антиоксиданты
Неферментные антиоксиданты
Эмоксипин
Вещества, влияющие на систему ГАМК
Общие принципы действия ноотропов
Цераксон
Нейропептиды
Ретиланамин
Кортексин
Фармакокинетика
Заключение
Список литературы
Введение
Актуальность исследования различных видов церебральной патологии и разработки методов их лечения не требует детального обоснования. Последнее десятилетие уходящего века не случайно было объявлено Всемирной организацией здравоохранения "десятилетием мозга". Церебральные патологии по распространённости занимают третье место среди населения стран Европейского союза и Американского континента, уступая лишь заболеваниям сердечно-сосудистой системы и злокачественным новообразованиям. Заболевания головного мозга деструктивного и дегенеративного характера приводят не только к уменьшению продолжительности жизни населения, но и ограничивают социальную активность человека в силу развития когнитивного дефицита, ограничивая способность индивидуума к мышлению, обучению, адекватному восприятию информации и принятию решений. Список церебральных патологий, сопровождающихся нарушениями когнитивных функций, достаточно велик и включает в себя травму мозга, хроническую церебро-васкулярную недостаточность, постгипоксическую энцефалопатию, нейроинфекции, хронический алкоголизм, задержку развития у детей, поражения мозга нейродегенеративного характера [21]. Нарушение когнитивных и ассоциативных функций в условиях церебральных патологий протекают на фоне выраженных структурных изменений тканей мозга за счёт угнетения процессов биоэнергетики, развития глутаматной "эксайтотоксичности", гиперпродукции активных форм кислорода, снижения активности антиоксидантных систем, приводящих, в конечном итоге, к развитию апоптоза. Именно активация апоптоза, по мнению многих исследователей, является первопричиной развития стойких нарушений когнитивно-мнестических функций ЦНС [12,13,14]. Биохимические и морфоцитологические признаки апоптоза выявляются в большом спектре экспериментальных нейродегенеративных расстройств: транзиторной церебральной ишемии, вызванной окклюзией церебральной артерии; интрацеребральной геморрагии; на моделях эпилептогенных судорог; локальном термическом повреждении мозга. Апоптоз включается в патологии любых проявлений ишемических и травматических повреждений нервной ткани, включая нарушения спинного мозга, деменциальные изменения, связанные с развитием болезней Альцгеймера, Паркинсона, сенильной деменцией, врожденными патологиями мозга и др. Таким образом, можно говорить о нейроапоптозе как новом патобиохимическом механизме нейродегенеративных расстройств широкого спектра [12,15]. Основное свойство апоптоза как принципиально нового морфо-биохимического процесса, отличного от некроза - это включение специализированных биохимических механизмов, в результате которых происходит повреждение молекулы ДНК и уничтожение белоксинтезирующих структур. Вот почему такой важной и актуальной для современной науки и медицины является проблема разработки высокоэффективных и безопасных препаратов для лечения данных патологий.
С физиологической и биохимической точки зрения нарушение кровоснабжения структур мозга вносит серьезный дисбаланс в соотношение систем биорегуляторов и является источником патологических процессов, развивающихся на нейрональном и субклеточном уровнях. Нейрохимические процессы, происходящие при цереброваскулярной ишемии, представляют собой комплекс реакций, включающих интенсивное накопление экстрацеллюлярного глутамата, нарушение ионного гомеостаза, активизация кальцийзависимых внутриклеточных протеаз (кальпаин), образование токсических свободных радикалов и активных форм кислорода, неизбежно ведущих к некротической или/и апоптической гибели нейронов. Поэтому можно предположить, что вещества, блокирующие компоненты этого каскада, антагонисты рецепторов глутамата, ингибиторы протеаз и каспаз, нейтрализаторы свободных радикалов и активаторы репаративных процессов могут рассматриваться как потенциальные средства терапии церебральной ишемии. Представленная в общем виде картина свидетельствует о том, что распространенная некогда концепция монотерапевтического подхода для лечения цереброваскулярных ишемией, представляющая собой неотложную реперфузию тромболитическими препаратами, оказывается несостоятельной. Мультитерапевтический подход, учитывающий многостадийность и степень тяжести ишемических расстройств мозга, должен включать:
вазоактивную терапию, обеспечивающую функционально необходимый метаболизм в тканях мозга;
компенсаторную (заместительную) терапию, направленную на ликвидацию нейротрансмиттерного дефицита в поврежденных структурах мозга;
нейротрофическую коррекцию ростовыми факторами, необходимыми для раннего поддержания биохимических сигнальных и трансляционных процессов в нервной клетке;
торможение образования продуктов перекисного окисления липидов;
торможение активности кальпаинов, ферментов протеолиза;
торможение экспрессии и активности каспаз, ферментов апоптоза.
Такая полифункциональная активность наблюдается у ноотропов нового поколения - препаратов нейропептидной природы (Семакс, Цереброзин, Кортексин). По сравнению с реперфузией (тромболизисом), такое направление лечения цереброваскулярных патологий, как нейропротективная терапия, практически не имеет противопоказаний и каких-либо ограничений (сахарный диабет, высокое артериальное давление). Нейропротекцию условно разделяют на первичную, направленную на прерывание быстрых реакций глутамат-кальциевого каскада, свободно-радикальных механизмов, что позволяет увеличить период "терапевтического окна" для активной реперфузии, и вторичную, обеспечивающую прерывание отсроченных механизмов смерти клеток. К группе препаратов, обеспечивающих как первичную, так и вторичную нейропротекцию, относят широко применяющихся в последние годы в клинической практике пептидные препараты - Семакс, Церебролизин, Кортексин.
Целью работы является изучение молекулярно-биохимических основ терапевтического действия данных препаратов.
Задачи:
На основе анализа прочитанной литературы охарактеризовать химическое строение нейропептидных препаратов, сформулировать особенности фармакологического действия.
Подробно рассмотреть механизм действия.
Ознакомиться с основными терапевтическими эффектами.
Нейропротекция и виды нейропротекции.
Нейропротекторы.
Нейропротекторы - (греч. neuron - нерв + лат. protec-tio - защита) - лекарственные средства, защищающие нервные клетки от повреждения свободными радикалами и токсинами, от кислородной недостаточности и других неблагоприятных факторов, активизирующие метаболические процессы в головном мозге. (2)
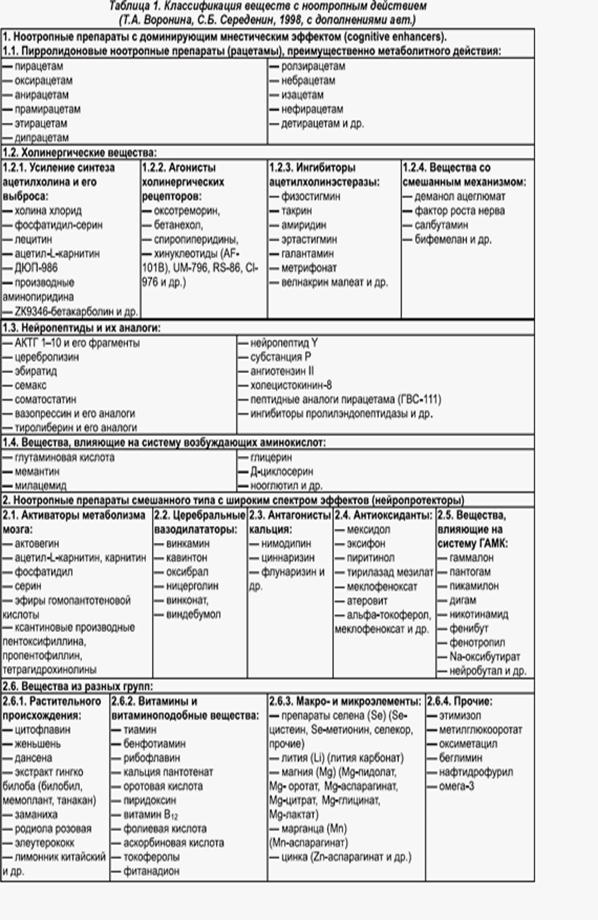
Нейропротекторы имеют ноотропный компонент воздействия. Классификация, предложенная Т.А. Ворониной и С.Б. Середениным (1998), показывает, насколько гетерогенна и значительна группа лекарств с ноотропным компонентом действия, применяемая в медицине. (3)
В настоящее время - это наиболее перспективная и динамично развивающаяся группа лекарств. Ниже приведены лишь некоторые препараты указанной группы.
Механизм действия нейропротекторов:
В первую очередь они воздействуют на известные нам патохимические реакции, возникающие при патологических процессах, в т. ч. и на гипоксию.
Слово "гипоксия" всем привычно и знакомо, но как лечить это состояние - большая проблема. Ведь до конца не расшифрованы механизмы патохимических реакций, возникающих при гипоксии. Критические состояния порождают мощное и многопричинное снижение скорости гликолиза, и как следствие - дефицит энергии и гипоксию. Воздействие на промежуточный обмен веществ представляется удобной "точкой отсчета" при медикаментозном лечении критических состояний. реди наиболее перспективных зарубежных препаратов отмечен лубелузол, проходящий сейчас третью фазу клинических испытаний, глиатилин. Среди российских - комбинированный препарат цитофлавин, который уже применяется. (2)
Применение:
Нейропротекция, рассматриваемая в качестве средства защиты нейронов при сосудистой патологии головного мозга, является важным аспектом фармакотерапии нейродегенеративных, цереброваскулярных и других заболеваний ЦНС.
В комплексной терапии больных с хронической недостаточностью мозгового кровообращения.
ОНМК.
ДЦП и ЧМТ.
Болезни Альцгеймера.
Постгипоксическая энцефалопатия.
Болезнь Паркинсона.
Нарушения когнитивных функций вследствие травмы головного мозга.
Эпилепсия.
Тяжелые психические заболевания (шизофрения), олигофрения.
При неврологических осложнениях сахарного диабета.
Глаукома
Нейропротекция - защита нервных клеток от повреждения свободными радикалами и токсинами, от кислородной недостаточности и других неблагоприятных факторов.
Выделяют два вида нейропротекции: первичная и вторичная.
Основным направлением первичной нейропротекции является прерывание быстрых механизмов глутаматкальциевого каскада с целью коррекции дисбаланса возбуждающих и тормозных нейротрансмиттерных систем и активации естественных тормозных процессов. Этот вид нейропротекции должен начинаться с первых минут ишемии и продолжаться на протяжении первых трех дней инсульта, особенно активно - в первые 12 часов. Антагонисты NMDA - рецепторов уменьшают поток ионов Са2+ в клетки через агонистзависимые кальциевые каналы. Они были первыми нейропротективными препаратами, которые в экспериментальных условиях значительно (на 40-70%) ограничивали область инфаркта мозга, прежде всего за счет сохранения живой зоны "ишемической полутени". Блокада рецепторов может осуществляться неконкурентными антагонистами. Единственными безопасными и (по результатам 2-й фазы испытаний) эффективными неконкурентными антагонистами NMDA - рецепторов на сегодняшний день являются препараты магния, регулирующий кальциевый ток через вольтажчувствительные каналы. При церебральной ишемии уменьшается содержание глутаматных рецепторов в коре, что вызывает перевозбуждение или даже смерть нейронов, так как потеря этих субъединиц АМРА - глутаматными рецепторами приводит к повышению проницаемости мембраны нейрона для ионов кальция и уменьшению митохондриального пула ионов магния, а также к повышению уровня свободного цитозольного магния в нейроне - признанного маркера индукции апоптоза. В состоянии покоя устье АМРА - рецептора заблокировано ионами магния. При ишемии АМРА - рецептор теряет ионы магния из устья и не препятствует усиленному току ионов цинка также лишается металла. Кроме того, магний как микроэлемент участвует в формирование каталитических центров и стабилизации регуляторных сайтов в составе многочисленных ферментов нервной и глиальной ткани в процессе синтеза и деградации нейромедиаторов и нейропептидов в головном мозге в формировании пространственной конфигурации и внутримолекулярной стабилизации эндорфинов гипоталамических рилизинг - факторов вещества Р, нейропептида Y. Магний вовлечён в различные антиоксидантные функции нейронов глиальных элементов.
Восполняя дефицит магния и витамина В6 препарат не только оказывает протективное действие, но и реализует седативные, анальгетические и антипароксизмальные эффекты магнийсодержащих препаратов, что связанно с важнейшей способностью ионов магния регулировать процессы торможения и возбуждения в головном мозге.
Продолжаются клинические испытания ремацемида - низкоаффинного антагониста NMDA - рецепторов, обладающих способностью ингибировать и потенциалзависимые кальциевые каналы. Первые клинические исследования выявили слабовыраженные побочные эффекты препарата (двоение и сонливость).
Лубелузол - соединение бензотиазола, являющейся блокатором натриевых каналов. Препарат предотвращает пресинаптическое высвобождение глутамата, снижая концентрацию нейротрансмиттера во внеклеточном пространстве периинфарктной зоны мозга, а также тормозит глутаматиндуцированнную нейротоксичность оксида азота снижая активность фермента NO - синтаза.
Глиатилин - холиномиметик центрального действия; нейропротектор, ноотроп.
Глиатилин является новым соединением, в составе структурной формулы которого содержится 40,5% метаболически защищенного холина. Попадая в организм, глиатилин всасывается в кровь и попадает в головной мозг, где под воздействием ферментов разлагается на холин и глицерофосфат. Холин является одним из компонентов ацетилхолина и принимает участие в его синтезе, в результате чего возрастает скорость передачи возбуждения в нервных синапсах. Глицерофосфат является предшественником фосфолипидов (фосфатдихолина) мембраны нейронов, способствует улучшению обменных процессов в нервных клетках., Клиническая эффективность глиатилина связана с распределением холинергических структур в центральной нервной системе. Ацетилхолин представлен в различных отделах нервной системы широко, основное его местонахождения в ЦНС - базальные ганглии, таламус, серое вещество полушарий, хвостатое ядро, ядра моста (мускариновые рецепторы), передние рога боковых желудочков, вегетативные образования НС (никотиновые рецепторы). Учитывая биохимическую "карту" мозговой ткани, в которой ацетилхолин имеет широкое представительство, есть основания предполагать, что этот медиатор обеспечивает сложные двигательные функции - инициацию движений, двигательные стереотипы. Холинергическая система, тесно взаимодействуя с дофаминергической, ГАМК-ергической и глутаматэргической медиаторными системами, обеспечивает спонтанную активность и эмоциональное поведение, память и волевые акты. Глиатилин, с одной стороны, являясь донором холина, увеличивает синтез ацетилхолина и положительно воздействует на нейротрансмиссию, с другой - глицерофосфат участвует в синтезе фосфатидилхолина (мембранного фосфолипида). Глиатилин, являясь предшественником фосфолипидов мембран, участвует в анаболических процессах, ответсвенных за мембранный фосфолипидный и глицеролипидный синтез, оказывая положительное влияние на функциональное состояние мембранных структур клеток, улучшая цитоскелет нейронов, увеличивая массу клеточных органелл (рибосом, митохондрий). Этот механизм действия препарата особенно важен при острых заболеваниях нервной системы. В экспериментальных исследованиях показано, что процесс гибели нейронов растянут во времени. В патогенезе таких состояний ключевое значение имеет патологическая (некроз) и физиологическая (апоптоз) гибель значительной части популяции зрелых дифференцированных нейронов при экзо - или эндогенных влияниях. Даже при кратковременном патогенном воздействии происходит уменьшение объема клеток, которое приводит к потере межклеточных контактов с одновременной реструктуризацией мембранных образований клетки, ядерного хроматина и повреждением цитоплазматических органелл нейронов. Некроз завершает процесс нейродегенерации, которая сопровождается отеком, набуханием, распадом и лизисом нейронов. Плазматическая мембрана претерпевает морфологические и химические изменения, которые делают ее узнаваемой для фагоцитов, включающихся в процесс невоспалительной санации мозговой ткани в "скомпроментированной" области. Выживающие нейроны формируют аномальные связи, новые кланы нейронов, которые предрасположены к патологии из-за недостаточных функциональных возможностей и слабой резистентности к воздействию новых патогенных факторов. Отсутствие токсичности и достаточная широта терапевтической дозы делают глиатилин приоритетным при острой церебральной патологии (черепно-мозговой травме, остром нарушении мозгового кровообращения), при патологических и ятрогенных состояниях (операция, наркоз), связанных с глубоким нарушением сознания и необходимостью скорейшего его восстановления (оглушение - кома, медикаментозный сон).
Глиатилин улучшает церебральный кровоток, усиливает метаболические процессы в головном мозге, активирует структуры ретикулярной формации головного мозга и восстанавливает сознание при травматическом поражении головного мозга. В остром периоде черепно-мозговой травмы у больных с сохранными механизмами ауторегуляции мозгового кровотока Глиатилин способствует увеличению линейной скорости кровотока на стороне поражения, нормализует пространственно-временные характеристики, спонтанную биоэлектрическую активность мозга, а также способствует более быстрому и полному регрессу очаговой невросимптоматики и восстановлению сознания.
Глиатилин эффективен:
в раннем восстановительном периоде у лиц, перенесших ишемический инсульт, оказывает нормализующее влияние на пораженные и компенсаторно значимые зоны мозга.
у больных с легкой и среднетяжелой степенью интелектуально мнестических функций на фоне дисциркуляторной энцефалопатии и остаточных явлений нарушения мозгового кровообращения, обусловленного атеросклерозом и/или артериальной гипертензией.
оказывает профилактическое и корригирующее действие на патогенные факторы инволютивного психоорганического синдрома, такие как изменение фосфолипидного состава мембран нейронов и снижение холинергической активности.
улучшает состояние когнитивных функций, а также ряда поведенческих и познавательных функций у больных "мягкой и умеренной" деменцией альцгеймеровского типа.
улучшает настроение, способствует устранению эмоциональной неустойчивости, раздражительности и апатии.
активизирует умственную деятельность.
Выводится глиатилин через легкие (в виде двуокиси углерода), почки и кишечник.
С учетом современных представлений о возможности вживания ткани мозга в зоне пенумбры в течении как минимум 48 - 72 ч. После нарушения мозгового кровообращения особое значение приобретает разработка новых эффективных методов вторичной нейропротекции направленных на прерывание отсроченных механизмов смерти клеток (отдалённых последствий ишемии), избыточного синтеза оксида азота и оксидантного стресса, активации микроглии связанных с ней дисбаланса цитокинов, иммунных сдвигов, локального воспаления, нарушение микроциркуляции и ГЭБ; трофической дисфункции апоптоза. Вторичная нейропротекция может быть начата относительно поздно - через 6 - 12 часов после сосудистого инцидента и должна быть наиболее интенсивной на протяжении первых семи суток заболевания. Важно отметить не только терапевтическое, но и профилактическое значение. Коррекция отдаленных последствий ишемии замедляет развитие церебрального атеросклероза и энцефалопатии в постинсультном периоде.
Цитофлавин - метаболический препарат. Снижает образование свободных радикалов, активирует антиоксидантную защиту и ферменты дыхательной цепи митохондрий. Оказывает противоишемическое действие, улучшает коронарный и мозговой кровоток, обладает нейропротекторными свойствами. Применяется при острых нарушениях мозгового кровообращения, последствиях ишемического инсульта, дисциркуляторной энцефалопатии, токсической эцефалопатии, постнаркозной депрессии. Цитофлавин - метаболическое средство, действие которого обусловлено компонентами, входящими в его состав.
Цитофлавин снижает образование свободных радикалов, восстанавливает активность ферментов антиоксидантной защиты и энергетический потенциал клетки. Цитофлавин активирует окислительно-восстановительные ферменты дыхательной цепи митохондрий, стимулирует синтез белка и нуклеиновых кислот, улучшает процессы утилизации кислорода, способствует утилизации глюкозы, жирных кислот и ресинтезу макроэргов и ГАМК в нейронах.
Цитофлавин оказывает противоишемическое действие, улучшает коронарный и мозговой кровоток, ограничивает зону некроза. Цитофлавин обладает нейропротекторными свойствами, улучшает метаболические процессы в ЦНС, восстанавливает рефлекторные нарушения, расстройства чувствительности, интеллектуально-мнестические функции. Цитофлавин способствует быстрому пробуждению после общей анестезии.
Основными направлениями вторичной нейропротекции являются:
антиоксидантная терапия.
торможение местной воспалительной реакции.
улучшение трофического обеспечения мозга (нейротрофины).
нейроимуномодуляция (нейропептиды).
регуляция рецепторных структур (ганглиозиды).
Одним из направлений вторичной нейропротекции является применение антиоксидантов - препаратов, уменьшающих выраженность реакции оксидантного стресса.
В проведенных экспериментальных и клинических исследованиях высокую эффективность показали отечественные препараты: эмоксипин, мексидол.
Эмоксипин - производное 3-гидроксипиридина, структурный аналог витамина В6. Основными эффектами эмоксипина являются торможение ПОЛ и активация антиоксидантной системы; изменение активности мембраносвязанных ферментов; модификация метаболической, рецепторной и транспортной функций клеточных мембран. Препарат стабилизирует кальций-АТФазу саркоплазматического ретикулума в условиях денатурации сарколеммы и препятствует повреждению мембраны клеток. Установлено антигипоксическое действие эмоксипина, ингибирует фосфоди-эстеразу, способствуя накоплению в ткани мозга сАМР. Установлено антигипокси-ческое действие эмоксипина. Препарат безопасен и хорошо переносится.
Отечественным антиоксидантом нового поколения является мексидол - соль эмоксипина и янтарной кислоты. Препарат тормозит ПОЛ и свободнорадикальные процессы, увеличивает концентрацию восстановленной формы глутатиона, активирует эндогенную антиоксидантную систему супероксиддисмутазы и церулоплазмин, предупреждает снижение активности глутатионзависимых ферментов, в результате чего достоверно уменьшается выраженность процессов оксидантного стресса. Выявлены также позитивное влияние мексидола на состояние мембранных структур клеток (уменьшение вязкости липидного бислоя мембраны и увеличение её текучести); модуляция активности мембраносвязных ферментов, ионных каналов, рецепторных комплексов, в том числе бензодиазепинового, ГАМК, ацетилхолинового,; улучшение синоптической передачи и пластичности мозга. Препарат стимулирует энергосинтезирующие функции митохондрий и улучшает энергетический обмен в клетке, повышая, таким образом, устойчивость ткани мозга к гипоксии и ишемии. Причиной антигипоксического эффекта мексидола является прямое окисление сукцината, входящего в его состав, о чём свидетельствует усиление эндогенного дыхания, сопровождающееся восстановлением флаинопротеидов. Мексидол не только оказывает метаболическое действие, но и улучшает мозговое кровообращение: вызывает обратное развитие атеросклеротической активностью (снижает уровень общего холестерина и липопротеидов низкой плотности), нормализует реологические свойства крови, подавляет агрегацию тромбоцитов.
Таким образом, важной стратегией вторичной нейропротекции являются разработка и внедрение препаратов с выраженными нейротрофическими и ростовыми свойствами.
Факторы роста, представляющие собой эндогенные полипептиды, являются идеальными претендентами для лечения инсульта, так как обладают нейропротективными, репаративными и пролиферативными свойствами. (1)
В настоящий момент принято выделять две группы нейропротекторных препаратов - прямые и непрямые нейропротекторы.
Согласно данной классификации прямые нейропротекторы непосредственно защищают нейроны. Эти препараты блокируют основные факторы повреждения клеток, которые обусловлены развитием ишемии в этой зоне, в результате которой наблюдается увеличение концентрации продуктов ПОЛ и свободных радикалов, ионов Са++, ацидоз. Прямыми нейропротекторными свойствами обладают природные витамины и флавоноиды - аскорбиновая кислота, a-токоферол, витамин А, g-аминомаслянная кислота (ГАМК); ферменты антиоксидантной системы организма - супероксиддисмутаза (СОД); неферментные антиоксиданты - эмоксипин, мексидол и гистохром; блокаторы кальциевых каналов - бетаксолол, нифедипин; нейропептиды - ретиналамин, кортексин; антигипоксанты - цитохром с. Кроме того, в настоящее время ведется поиск препаратов, которые могли бы непосредственно устранять факторы, способствующие активации апоптоза. Действие этих препаратов направлено на снижение неблагоприятного влияния глютамата и других субстратов на аксоны ганглионарных нейронов.
Непрямое нейропротекторное действие подразумевает влияние препаратов на различные факторы, увеличивающие риск повреждения клеток (снижение перфузионного давления, атеросклероз, изменение реологических свойств крови, ангиоспазм), а также повышение устойчивости организма к снижению перфузионного давления кислорода в тканях. Подобным эффектом обладают препараты, улучшающие микроциркуляцию (теофиллина этилендиамин и никотинат, винпоцетин, пентоксифиллин и др.), реологические свойства крови, снижающие уровень холестерина в крови, ноотропные средства.
Описание основных групп нейропротекторов
1. Активаторы метаболизма мозга.
Актовегин - высокоактивный стимулятор утилизации кислорода и глюкозы в условиях ишемии и гипоксии, увеличивающий транспорт и накопление глюкозы в клетках, что улучшает аэробный синтез макроэргических соединений и повышает энергетические ресурсы нейронов, препятствуя их гибели. Препарат Актовегин представляет собой гемодиализат телячьей крови, содержит такие органические вещества, как аминокислоты, нуклеозиды, липиды, олигосахариды.
Фармакологическое действие:
Актовегин активирует клеточный метаболизм (обмен веществ) путем увеличения транспорта и накопления глюкозы и кислорода, усиливая их внутриклеточную утилизацию. Эти процессы приводят к ускорению метаболизма АТФ (аденозинтрифосфорной кислоты) и повышению энергетических ресурсов клетки. При условиях, ограничивающих нормальные функции энергетического метаболизма (гипоксия /недостаточное снабжение ткани кислородом или нарушение его усвоения/, недостаток субстрата) и при повышенном потреблении энергии (заживление, регенерация /восстановление ткани/), актовегин стимулирует энергетические процессы функционального метаболизма (процесс обмена веществ в организме) и анаболизма (процесс усвоения веществ организмом). Вторичным эффектом является усиление кровоснабжения.
Молекулярный механизм действия актовегина
Выделенная из актовегина, активная фракция оказывает инсулиноподобное действие на изолированные адипоциты жировой ткани: биосинтез липидов может вырасти в зависимости от дозы в 5 раз; вызванное изопротеренолом торможение этого эффекта не происходит; при этом наступает торможение внутриклеточного образования Ц-АМФ; воздействие на адипоциты активной фракцией Актовегина вызывает зависящую от концентрации стимуляцию активности пируват-дегидрогеназы (ПДГ). При этом активной форме передается около 60% общей активности ПДГ.
Инсулиноподобные механизмы действия актовегина существенно отличаются от механизмов применения непосредственно инсулина, так как в этих условиях липогенез, липолиз и транспорт глюкозы не ингибируются.
Было замечено, что гемодиализат не оказывает влияния на фосфорилирование инсулиновых рецепторов или на зависимость инсулина от его рецептора. Из этого можно сделать вывод, что сигналы актовегина не передаются инсулиновым рецепторам, а, скорее всего, проходят на пострецепторном уровне.
Активная фракция, изолированная от гемодиализата, повышает транспорт 3-0-метилглюкозы в зависимости от дозы в 5 раз. Время воздействия такое же, как и при использовании инсулина. Оба агента начинают действовать в течение 1 мин, а достигают максимума через 5 мин.
Стимуляция транспорта 3-0-метилглюкозы активной фракцией не вызывает увеличения цитохолазина-В во фракции плазмы мембраны. Активная фракция, очевидно, действует независимо от перемещения глюкозы. Стимуляция транспорта происходит через модуляцию внутренней активности носителя глюкозы. Это объясняет самостоятельное инсулиноподобное воздействие Актовегина на транспорт и использование глюкозы, что выражается в улучшении энергетического статуса клетки.
Показания к применению:
Недостаточность мозгового кровообращения, ишемический инсульт (недостаточное снабжение ткани головного мозга кислородом вследствие острого нарушения мозгового кровообращения); черепно-мозговые травмы; нарушения периферического кровообращения (артериального, венозного); ангиопатии (нарушение тонуса сосудов); трофические нарушения (нарушения питания кожи) при варикозном расширении вен нижних конечностей (изменениях вен, характеризующихся неравномерным увеличением их просвета с образованием выпячивания стенки вследствие нарушения функции их клапанного аппарата); язвы различного происхождения; пролежни (омертвение тканей, вызванное длительным давлением на них вследствие лежания); ожоги; профилактика и лечение лучевых поражений. Повреждения роговицы (прозрачной оболочки глаза) и склеры (непрозрачной оболочки глаза): ожог роговицы (кислотами, щелочью, известью); язвы роговицы различного происхождения; кератит (воспаление роговицы), в том числе после трансплантации (пересадке) роговицы; потертости роговицы у пациентов с контактными линзами; профилактика поражений при подборе контактных линз у пациентов с дистрофическими процессами в роговице (для применения глазного желе), а также для ускорения заживления трофических язв (медленно заживающих дефектов кожи), пролежней (омертвения тканей, вызванного длительным давлением на них вследствие лежания), ожогов, лучевых поражений кожи и др.
Побочные действия:
Аллергические реакции: крапивница, чувство прилива крови, потливость, повышение температуры тела. Зуд, жжение в области применения геля, мази или крема; при применении глазного геля - слезотечение, инъецированность склер (покраснение склер).
Противопоказания:
Повышенная чувствительность к препарату. С осторожностью назначать препарат в период беременности. В период кормления грудью применение актовегина нежелательно.
2. Блокаторы кальциевых каналов.
Нимодипин
Нимодипин - блокатор кальциевых каналов, производное дигидропиридина. Избирательно взаимодействует с кальциевыми каналами типа L и блокирует трансмембранное поступление ионов кальция.
Фармакологическое действие:
Особенностью препарата является преимущественное влияние на кровоснабжение мозга. Препарат оказывает дилатирующее действие на сосуды головного мозга и обладает противоишемическими свойствами.
Нимодипин предотвращает или устраняет спазмы сосудов, вызываемые различными сосудосуживающими биологически активными веществами (серотонином, простагландинами, гистамином).
Под влиянием препарата происходит более выраженное увеличение перфузии в ранее пораженных участках головного мозга с недостаточным кровоснабжением, чем в здоровых участках, не влияя на системное АД. Особенно отчетливо этот эффект проявляется при спазмах кровеносных сосудов после субарахноидального кровоизлияния.
Нимодипин оказывает протективное действие в отношении нейронов мозга, стабилизирует их функциональное состояние. Благоприятно влияет на память и улучшает способность к концентрации внимания.
Показания:
Профилактика спазма сосудов головного мозга и лечение ишемических нарушений мозгового кровообращения, вызванных субарахноидальным кровоизлиянием;
Неврологические расстройства вследствие спазма сосудов головного мозга, лечение и профилактика ишемических нарушений мозгового кровообращения (в т. ч. при гипертоническом кризе);
Состояние после оперативного лечения по поводу субарахноидального кровоизлияния;
Лечение сенильной деменции;
Лечение отдаленных последствий перенесенного ишемического инсульта, субарахноидального кровоизлияния;
Профилактика мигрени.
Побочное действие:
Нимодипин обычно хорошо переносится больными.
Со стороны сердечно-сосудистой системы: снижение АД (1-9%), возможно - резкое снижение АД (что особенно нежелательно при исходной артериальной гипотонии), тахикардия (<1%), периферические отеки, гиперемия лица (1-9%), ощущение тепла или жара, потливость (<1%). Также, особенно при парентеральном применении, может наблюдаться урежение ЧСС, экстрасистолия; редко - коллапс (<1%).
Со стороны ЖКТ и печени: могут возникать диспептические явления (1-9%). При парентеральном введении возможно увеличение уровня трансаминаз, ЩФ, гамма-глутамилтрансферазы, тошнота, рвота, гепатит, желтуха (<1%).
Со стороны ЦНС и психического статуса: в некоторых случаях возможны расстройства сна, головная боль (1-9%), повышение психомоторной активности, агрессивность, гиперкинезы, депрессия (<1%).
Со стороны опорно-двигательного аппарата: мышечные спазмы (1-9%).
Со стороны мочевыделительной системы: при парентеральном введении возможно нарушение функции почек, вследствие чего возможно повышение содержания мочевины и/или креатинина в сыворотке крови (1-9% - периферические отеки; <1% - гипонатриемия).
Аллергические реакции: дерматит (1-9%).
Местные реакции: флебит (особенно при введении неразведенного раствора нимодипина).
Прочие: одышка (<1%).
Противопоказания:
Выраженные нарушения функции печени, в том числе при циррозе печени (для приема внутрь);
Отек мозга;
Выраженное повышение внутричерепного давления;
Выраженная гипотензия;
Гиперчувствительность;
Беременность (в экспериментальных исследованиях в настоящее время тератогенное действие препарата не выявлено);
Лактация (на время лечения следует прекратить грудное вскармливание).
Ограничения к применению:
Гипотензия (легкая или умеренная), сердечная недостаточность, кардиогенный шок, инфаркт миокарда с застойными явлениями в легких, нерезко выраженные нарушения функции печени.
Резкое понижение АД или возникновение выраженной головной боли обусловливают необходимость прекращения терапии.
Ферментные антиоксиданты
Эрисод
Действующие вещества: Супероксиддисмутаза
Лекарственная форма: порошок для приготовления глазных капель
Фармакологическое действие:
Антиоксидантное средство, оказывает антигипоксическое, противовоспалительное и антицитолитическое действие. Является эндогенным акцептором свободных кислородных радикалов, избыточное накопление которых в клетке имеет важное значение в развитии кислородзависимых патологических процессов (гипоксия, воспаление, интоксикация). Нормализует протекающие с участием свободных радикалов кислорода окислительные процессы и предупреждает разрушение биомембран клеток, связанное с активацией ПОЛ.
Показания: Открытоугольная глаукома, герпетические заболевания глаз; передний увеит, травмы и ожоги глаз; послеоперационный период после удаления катаракты.
Противопоказанния: Гиперчувствительность.
Побочные действия: Сухость глаз, аллергические реакции
Неферментные антиоксиданты
Гистохром
Действующие вещества: Пентагидроксиэтилнафтохинон
Лекарственная форма: раствор для внутривенного введения, раствор для инъекций
Фармакологическое действие: Стабилизирует клеточные мембраны, взаимодействует с активными формами кислорода, свободными радикалами, проявляет свойства хелатора металлов переменной валентности. Снижает количество продуктов перекисного окисления липидов, содержание которых увеличивается при сердечно-сосудистых заболеваниях. Оказывает кардиопротекторное действие у пациентов с успешной тромболитической терапией инфаркта миокарда. Применение препарата приводит к снижению частоты реперфузионных аритмий, в т. ч. жизнеугрожающих (желудочковые экстрасистолы IVa и IVb классов, пароксизмальных желудочковых) и наджелудочковых; не оказывает существенного влияния на AV и внутрижелудочковую проводимость. Замедляет формирование очага некроза в течение первых 2-3 сут. Улучшает сократительную способность миокарда и уменьшает частоту развития острой ЛЖ недостаточности на протяжении первых суток заболевания у пациентов с инфарктом миокарда в дополнение к коронарному тромболизису.
Показания: Острый инфаркт миокарда в сочетании с тромболитическими препаратами для устранения вызываемых ими реперфузионных осложнений. Стенокардия.
Противопоказанния: Гиперчувствительность, беременность, период лактации, детский возраст.
Побочные действия: Болезненность по ходу вены (без развития флебита). В первые 2 сут после применения - окрашивание мочи в темно-красный цвет. Аллергические реакции.
Мексидол. - 2-этил-6-метил-3-оксипиридина сукцинат. Химическое строение мексидола обуславливает отсутствие его тропности к известным рецепторам (ГАМК, ацетилхолиновым, бензодиазепиновым, опиоидным). Следовательно, диапазон его фармакологического действия максимален.
Фармакологическое действие:
Мексидол является солью янтарной кислоты и имеет сходство с пиридоксином. Молекула 3-оксипиридина облегчает проникновение сукцината в клетку. Реализуется срочный адаптационный механизм. Суть его в том, что при гипоксии сукцинатдегидрогеназа тормозится позднее других дегидрогеназ цикла Кребса. Поэтому сукцинат наиболее предпочтительный субстрат митохондриального окисления в условиях дефицита кислорода.
При окислении янтарной кислоты в цикле Кребса образуется энергии в сотни раз больше, чем при окислении глюкозы.
Под воздействием мексидола восстанавливаются функционирование цикла Кребса и энергосинтезирующая функция митохондрий.
Активируется синтез белка и нуклеиновых кислот, поддерживается высокий уровень макроэргов. Стимулируется клеточная репарация. Реализуется эффект нейрональной реанимации.
Высокая липофильность мексидола обеспечивает его селективное защитное действие именно в области биологических мембран. Препарат повышает активность антиоксидантных ферментов, ответственных за метаболизм перекисей липидов и синглетных форм кислорода, в частности супероксиддисмутазы. Ингибирует первичные и гидроксильные радикалы пептидов. Таким образом, мексидол способен ограничить повреждающее действие протеолиза и уменьшить степень аутолитического поражения.
Включение мексидола в интенсивную терапию обеспечивает снижение до стресс-нормы уровень средних молекул в крови, являющихся интегральным показателем выраженности протеолиза. Повышается соотношение простациклин/тромбоксан, тормозится образование лейкотриенов. Мексидол обладает липид-регулирующим действием, увеличивая содержание фосфолипидов в биомембранах, вызывает перемещение структурных переходов в область низких температур. Эти эффекты обуславливают изменение физико-химических свойств мембран. Увеличивается их пластичность, восстанавливается деятельность ионных каналов.
Параллельно этому изменяется активность мембраносвязанных ферментов: фосфодиэстеразы, циклических нуклеотидов, аденилатциклазы, альдоредуктазы, ацетилхолинэстеразы. Мексидол модулирует рецепторные комплексы мембран, в частности бензодиазепиновый, ГАМК, ацетилхолиновый. Усиливает их способность к связыванию. Следовательно, он действует синергично с другими церебропротекторами, в особенности с действующими как прямые агонисты рецепторов.
С одной стороны препарат уменьшает эффекты десенситизации синапсов и улучшает синаптическую передачу. С другой стороны мексидол увеличивает длительность открытого состояния хлорного канала. Это повышает резистентность к нейрональному возбуждению. Таким образом, восстанавливается интегративная функция головного мозга, реализуется физиологический механизм обратной связи.
Мексидол эффективно стабилизирует биологические мембраны не только нейронов, но и клеток крови. Подавляется агрегация и адгезия тромбоцитов и лейкоцитов. Повышается пластичность эритроцитов. Улучшаются реологические свойства крови. Это способствует устранению церебральной циркуляторной гипоксии.
Мексидол оказывает церебральный вазодилятационный эффект, снижает показатели мозгового сосудистого сопротивления, способствует оттоку крови в мозговые вены. Этим опосредованно снижается внутричерепное давление и повышается перфузионное давление мозга, стабилизируется мозговой метаболизм.
Активация мексидолом деятельности иммунной системы опосредованно снижает выраженность системной воспалительной реакции, в частности энцефалитической, что существенно для исходов инсультов и черепно-мозговой травмы. В частности, под воздействием мексидола достигается уменьшение выраженности лимфопении. Это отражает не только иммунотропные эффекты препарата, но и его способность опосредованно подавлять патологическую ирритацию срединных структур головного мозга.
Таким образом, мексидол обеспечивает реализацию адаптационных задач организма. Реализуются множественные эффекты препарата, проявляющиеся на различных уровнях организации: антиоксидантные, антигипоксантные, мембранопротекторные, церебропротективные, транквилизирующие, антистрессорные, ноотропные, вегетотропные, противосудорожные. Важно, что мексидол воздействует практически на все ключевые звенья окислительного стресса.
Клиническим эквивалентом фармакологических эффектов мексидола являются следующие.
Быстрый регресс нарушений сознания и очаговой симптоматики, в частности афазии и плегии, что обуславливает большую способность к самообслуживанию.
Противосудорожное действие. На фоне применения препарата у больных с судорожной готовностью и эписиндромом дозы противосудорожных средств (карбамазепин) удается снизить в среднем на 30%.
Важно, что мексидол не снижает двигательной активности больных на фоне устранения продуктивной психической симптоматики. Это является профилактикой синдрома деафферентации, пролежней, застойной пневмонии, венозного стаза, флеботромбозов.
Внося существенный вклад в восстановление интегративной функции головного мозга, мексидол обеспечивает ускоренное восстановление адекватных поведенческих реакций.
Клинически значимо уменьшается уровень тревожности, негативизма и агрессии. Как сопутствующий эффект наблюдается нормализация ночного сна и снижение потребности в снотворных препаратах.
Суммарные фармакологические эффекты мексидола в сочетании с другими средствами интенсивной терапии позволяют уменьшить продолжительность искусственной вентиляции легких у больных с травматической комой.
Способность мексидола снижать выраженность реперфузионного повреждения косвенно подтверждается отсутствием случаев геморрагического пропитывания ишемических очагов, в том числе и у больных, получавших в комплексе интенсивной терапии такие препараты как фраксипарин и гепарин.
Положительные клинические эффекты мексидола зарегистрированы у всех, больных, получавших мексидол.
Учитывая, что окислительный стресс относится к первичным повреждающим реакциям, развивающимся в первые минуты повреждения мозга, мексидол необходимо применять максимально рано, в период открытого терапевтического окна - желательно в первые 6 часов. Это препарат неотложной помощи.
Рекомендуемая доза мексидола не менее 1000 - 1600 мг в сутки в течение острейшего периода травмы и инсульта. Эффекты мексидола разворачиваются в первые 1-1,5 ч. А стойкие системные эффекты достигаются уже к концу первых суток. Опыт использования мексидола в клинической практике на протяжении более 5 лет у более чем 300.000 больных свидетельствует о безопасности препарата и об отсутствии клинически значимых побочных эффектов.
Вышеизложенное позволяет рекомендовать мексидол как препарат выбора для купирования окислительного стресса при травматических и сосудистых повреждениях головного мозга. Уникальное сочетание саногенных влияний на субклеточном, нейрональном и сосудистом уровнях обеспечивает эффективную церебропротекцию, что и является конечной целью реанимационного пособия.
Показания
острое нарушение мозгового кровообращения;
дисциркуляторная энцефалопатия;
нейроциркуляторная дистония;
легкие когнитивные расстройства атеросклеротического генеза;
невротические и неврозоподобные состояния с синдромом тревоги;
купирование абстинентного синдрома при алкоголизме с наличием в клинической картине невротических и вегетативно-сосудистых расстройств;
острая интоксикация антипсихотическими средствами (нейролептиками);
острые гнойно-воспалительные процессы брюшной полости (острый панкреатит, перитонит) в составе комплексной терапии.
Побочное действие
Со стороны пищеварительной системы: редко - тошнота, сухость во рту.
Прочие: редко - аллергические реакции.
Противопоказания
острые нарушения функции печени;
острые нарушения функции почек;
повышенная чувствительность к препарату.
Эмоксипин
Фармакологическое действие:
Эмоксипин является антиоксидантом (лекарственным средством, препятствующим перекисному окислению липидов клеточных мембран), обладающим антигипоксической (повышающей устойчивость ткани к нехватке кислорода), ангиопротекторной (повышающей устойчивость сосудов), антиагрегационной (препятствующей склеиванию тромбоцитов) активностью.
Показания к применению:
Первоначально препарат был предложен для применения в офтальмологической практике в качестве средства для лечения внутриглазных кровоизлияний, диабетической ретинопатии (невоспалительного поражения сетчатки глаза, связанного с повышенным содержанием сахара в крови), центральных хориоретинальных дистрофий (невоспалительного поражения сетчатки глаза вследствие заболевания мозга), тромбоза (образования сгустка крови в сосуде) центральной вены сетчатки и ее ветвей, посттравматических кровоизлияний, осложненной миопии (близорукости). Препарат назначают также для защиты сетчатой оболочки глаза при воздействии света высокой интенсивности (лазерные и солнечные ожоги, лазеркоагуляция /прижигание ткани лучами лазера/). Кроме того, эмоксипин применяют в послеоперационном периоде у больных глаукомой с отслойкой сосудистой оболочки (хориоидеи).
В последнее время эмоксипин успешно применяют при лечении других заболеваний, сопровождающихся усилением перекисного окисления липидов и гипоксией (недостаточным снабжением ткани кислородом или нарушением его усвоения - инфаркт миокарда, острая кровопотеря, кожные заболевания, глаукома и др.).
Способ применения:
При глазных заболеваниях эмоксипин применяют ретробульбарно (за глазное яблоко), парабульбарно (в пространство, окружающее глазное яблоко) и субконъюнктивально (под наружную оболочку глаза). Ретробульбарно препарат вводят в дозе 0,5 мл 1% раствора 1 раз в сутки ежедневно в течение 10-15 дней; субконъюнктивально и парабульбарно - по 0,2-0,5 мл 1% раствора 1 раз в сутки ежедневно или через день в течение 10-30 дней. При необходимости лечение можно повторять 2-3 раза в год. Для защиты сетчатой оболочки при лазерокоагуляции эмоксипин вводят ретробульбарно в дозе по 0,5 мл 1% раствора за сутки и непосредственно за 1 ч до коагуляции (прижигания). Далее препарат применяют в течение 2-10 дней 1 раз в день ретробульбарно в тех же дозах (0,5 мл 1% раствора). При коагуляции опухолей эмоксипин вводят перед отграничивающей и разрушительной коагуляцией по указанной выше схеме. Лечение эмоксипином следует проводить под контролем свертываемости крови.
Эмоксипин в глазной практике также используют в виде 1% раствора для капель.
Больным в остром периоде инфаркта миокарда вводят эмоксипин внутривенно капельно по 10 мг/кг в сутки в течение 5 дней, затем внутримышечно по 1 мг/кг в течение 15 дней. Отмечается ускорение репаративных (восстановительных) процессов и уменьшение зоны некроза (омертвения ткани).
При истинной экземе эмоксипин вводят внутримышечно по 1 мл 1% раствора 2 раза в день в течение 14 дней.
Растворы эмоксипина не следует смешивать с растворами других лекарственных средств.
Побочные действия:
Препарат обычно хорошо переносится. При ретро - и парабульбарном введении возможны ощущение боли, жжения, зуд, покраснение, а также уплотнения параорбитальных тканей (тканей, расположенных около глазного яблока), рассасывающиеся самостоятельно. Для снятия аллергических явлений рекомендуется инсталляция (закапывание) кортикостероидов.
Вещества, влияющие на систему ГАМК
Фенотропил - (М-карбамоил-метил-4-фенил-2-пироллидон).
Фармакологическое действие
Ноотропный препарат. Оказывает выраженное антиамнестическое действие, активирует интегративную деятельность головного мозга, способствует консолидации памяти, улучшает концентрацию внимания и умственную деятельность, облегчает процессы обучения, ускоряет передачу информации между полушариями головного мозга, повышает устойчивость тканей мозга к гипоксии и токсическим воздействиям, обладает противосудорожным действием и анксиолитической активностью, регулирует процессы активации и торможения ЦНС, улучшает настроение.
Фенотропил оказывает положительное влияние на обменные процессы и кровообращение головного мозга, стимулирует окислительно-восстановительные процессы, повышает энергетический потенциал организма за счет утилизации глюкозы, улучшает регионарный кровоток в ишемизированных участках головного мозга. Повышает содержание норадреналина, дофамина и серотонина в головном мозге.
Фенотропил не оказывает влияния на дыхательную и сердечно-сосудистую системы. Оказывает слабовыраженное диуретическое действие. Обладает анорексигенной активностью при курсовом применении.
Фенотропил оказывает умеренно стимулирующее действие в отношении двигательных реакций, повышает физическую работоспособность.
Умеренный психостимулирующий эффект препарата сочетается с анксиолитической активностью. Фенотропил улучшает настроение, оказывает анальгезирующее действие, повышая порог болевой чувствительности.
Фенотропил оказывает адаптогенное действие, повышая устойчивость организма к стрессу в условиях повышенных психических и физических нагрузок, при утомлении, гипокинезии и иммобилизации, при низких температурах.
На фоне применения Фенотропила отмечается улучшение зрения (увеличение остроты, яркости и полей зрения).
Фенотропил улучшает кровоснабжение нижних конечностей.
Фенотропил стимулирует выработку антител в ответ на введение антигена, что указывает на его иммуностимулирующие свойства, но в то же время не вызывает развитие реакций гиперчувствительности немедленного типа и не изменяет аллергическую воспалительную реакцию кожи, вызванную введением чужеродного белка. При курсовом применении Фенотропила не развивается лекарственная зависимость и толерантность. При отмене препарата не отмечено развитие синдрома отмены.
Действие Фенотропила проявляется после однократного применения, что важно при использовании препарата в экстремальных условиях.
Фенотропил (N-карбамоил-метил-4-фенил-2-пирролидон) по своему основному фармакологическому действию относится к ноотропным лекарственным средствам, зарегистрирован и разрешен к промышленному производству Минздравом России в 2003г.
Феноторопил, как и пирацетам, является производным пирролидона, т.е. его основу составляет замкнутая в цикл γ-аминомасляная кислота (ГАМК), которая является важнейшим тормозным медиатором и регулятором действия других медиаторов. В отличие от пирацетама у Фенотропила имеется фенильный радикал, что определяет существенное различие в спектрах фармакологической активности этих препаратов. Таким оборазом, Фенотропил, как и большинство других ноотропов, близок по химическому строению к эндогенным медиаторам.
Общие принципы действия ноотропов
Для пирролидоновых ноотропов и, в частности, для Фенотропила и пирацетама характерна низкая токсичность и отсутствие выраженных побочных эффектов даже в субтоксических дозах. Механизмы реализации эффектов ноотропов близки к естественным и отражают их нейрометаболическое действие. Так, электрофизиологические механизмы действия ноотропов выражаются в облегчении прохождения информации между структурами головного мозга, усилении синаптической передачи, повышении уровня бодрствования, усилении абсолютной и относительной мощности спектра ЭЭГ коры и подкорковых структур, в частности гиппокампа.
Механизм нейрохимических эффектов пирролидоновых ноотропов определяется стимуляцией метаболических, биоэнергетических и пластических процессов в головном мозге, в т. ч. усилением синтеза белка и фосфолипидов, повышением скорости оборота информационных молекул. Пока отсутствуют доказательства существования собственных рецепторов для пирролидоновых ноотропов, и показано, что они не обладают высокой аффинностью к большинству известных рецепторов. Вместе с тем пирролидоновые ноотропы влияют на основные синаптические системы - холинергическую, адренергическую, дофаминергическую, ГАМКергическую и глутаматергическую, причем в том направлении, в котором эти системы имеют отношение к памяти и адаптации организма к экстремальным воздействиям.
Механизмы реализации эффектов Фенотропила определяются, прежде всего, его нейрометаболитным профилем. Являясь производным пирролидона, Фенотропил имеет сходство с пирролидоновыми ноотропами по механизму действия. Наиболее яркими эффектами пирролидонов являются: повышение уровня АТФ, активация аденилатциклазы, уменьшение активности Na, K-АТФазы, усиление активности синопсомальной фосфолипазы А, активация аденилаткиназы, угнетение кортикального выброса пролина, усиление синтеза ядерной РНК в мозге, усиление утилизации глюкозы и др.
Показания
заболевания ЦНС различного генеза (особенно заболевания сосудистого генеза или связанные с нарушениями обменных процессов в головном мозге и интоксикацией /например, при посттравматических состояниях и явлениях хронической цереброваскулярной недостаточности/), сопровождающиеся ухудшением интеллектуально-мнестических функций, снижением двигательной активности;
невротические состояния, проявляющиеся вялостью, повышенной истощаемостью, снижением психомоторной активности, нарушением внимания, ухудшением памяти;
нарушения процессов обучения;
депрессии легкой и средней степени тяжести;
психоорганические синдромы, проявляющиеся интеллектуально-мнестическими нарушениями и апатико-абулической симптоматикой, а также апатичные состояния при шизофрении;
судорожные состояния;
ожирение (алиментарно-конституционального генеза);
профилактика гипоксии, повышение устойчивости к стрессу, коррекция функционального состояния в экстремальных условиях профессиональной деятельности с целью предупреждения развития утомления и повышения умственной и физической работоспособности, коррекция суточного биоритма, инверсия цикла "сон-бодрствование";
хронический алкоголизм (с целью уменьшения симптомов астении, депрессии, интеллектуально-мнестических нарушений).
Побочное действие:
Со стороны ЦНС: бессонница (при приеме препарата после 15 ч).
У некоторых больных в первые 3 дня приема - психомоторное возбуждение, гиперемия кожных покровов, ощущение тепла, повышение АД.
Противопоказания
Повышенная чувствительность к компонентам препарата.
Инстенон - комбинированный препарат, содержащий три отдельных лекарственных вещества: гексобендин, этамиван и этофиллин.
Фармакологическое действие:
Терапия Инстеноном в бoльшей степени влияла на состояние когнитивных функций, нежели на выраженность клинических неврологических нарушений. Сравнение в динамике результатов выполнения нейропсихологических тестов показало, что исследуемый препарат благоприятно влияет на сферу памяти и двигательные навыки больных с ДЭ. В мнестической сфере наиболее значимая положительная динамика отмечалась в тестах с интерференцией: объем отсроченного (после интерференции) воспроизведения в тесте на заучивание 10 слов достоверно увеличился, в то время как объем непосредственного (без интерференции) воспроизведения остался прежним. Динамика выполнения теста "тройки", где пациенту нужно одновременно запомнить две конкурентные серии слов, была более значима, чем динамика результатов заучивания 10 слов, где для запоминания предъявлялась одна серия слов.
Положительный эффект терапии Инстеноном на запоминание и воспроизведение не зависел от модальности и отмечался как в зрительной, так и в слухоречевой памяти. Однако положительную динамику претерпели в основном результаты сложных в когнитивном отношении тестов, что свидетельствует о способности Инстенона влиять на наиболее подвижные составляющие когнитивной деятельности, такие как способность одновременно решать несколько задач, устойчивость к интерференции, активный поиск следа памяти. Данные функции тесно связаны с уровнем непроизвольного внимания. Сходные результаты получены и в других исследованиях. Так, по данным клинико-нейропсихологического исследования, улучшение проявляется преимущественно уменьшением утомляемости и увеличением умственной работоспособности с одновременным достижением большей устойчивости внимания. Таким образом, Инстенон, вероятно, действует на память опосредовано, улучшая внимание и эффективность обработки информации при запоминании и воспроизведении. Это согласуется с представлением, что один из действующих компонентов Инстенона - этамиван - усиливает восходящие активирующие влияния ретикулярной формации ствола головного мозга. Известно, что активирующие влияния ретикулярной формации являются одним из основных функциональных механизмов обеспечения непроизвольного внимания. На клеточном уровне действие аналептиков связывают с влиянием на бензодиазепиновые и ГАМК-ергические рецепторы, что в конечном итоге приводит к улучшению передачи информации. Помимо этого, следует учитывать и влияние на скорость выполнения интеллектуальных операций производных ксантина, к которым относятся теофиллин и его дериват этофиллин, входящий в состав Инстенона. Однако результаты изучения клеточных механизмов действия ксантиновых производных довольно противоречивы. Считается, что ингибирование ксантинами нуклеотидфосфодиэстеразы, приводящее к уменьшению утилизации цАМФ и усилению центрального и периферического действия этого нуклеотида, несомненно. Однако клинический эффект производных ксантина может быть связан и с блокированием аденозиновых рецепторов, поскольку предполагается, что обладающий гипногенной активностью аденозин является физиологическим модулятором центральных активирующих систем. Благоприятное влияние Инстенона на концентрацию внимания также связано с воздействием на патогенетические факторы когнитивных нарушений при ДЭ - нарушенный церебральный кровоток и метаболизм. Считается, что под действием теофиллина происходит увеличение кровотока в ишемизированной зоне. Однако действие на церебральный метаболизм, вероятно, более важно, чем сосудорасширяющий эффект, поскольку тонус церебральных сосудов зависит в основном от местных факторов, поэтому в условиях ишемии склерозированные мозговые сосуды, по-видимому, уже максимально расширены. Под действием входящего в состав Инстенона гексобендина активируется анаэробный гликолиз, что приводит к увеличению утилизации глюкозы и кислорода.
Вместе с тем отсутствие статистически значимого изменения объема памяти в тесте на заучивание 10 слов и отсутствие динамики узнавания визуального материала свидетельствует о том, что Инстенон, возможно, не влияет на первичные процессы консолидации следа памяти. Однако при сосудистой мозговой недостаточности (в отличие от болезни Альцгеймера) нарушения памяти имеют в основном динамическую природу. При этом ведущим механизмом мнестических расстройств считается недостаточность обработки информации на этапах запоминания и воспроизведения вследствие дефицита внимания и нарушения регуляции мнестической деятельности. Препарат, вероятно, влияет именно на эти механизмы памяти.
Поэтому Инстенон особенно показан при связанных с сосудистой патологией головного мозга нарушениях памяти. Кроме того, снижение памяти у пожилых даже в рамках одной нозологической формы, как с этиологической, так и с патогенетической точки зрения носит гетерогенный характер, что обусловлено комплексностью и многофакторностью патологических изменений. Поэтому эффективности того или иного метода терапии следует ожидать лишь у части больных (т. н. "отвечающие на лечение больные").
Другая когнитивная сфера, в которой была зафиксирована положительная динамика под влиянием терапии - это психомоторные функции. После лечения достоверно улучшилось выполнение пробы на реципрокную координацию, возросла ее скорость. В основе благоприятного влияния Инстенона на двигательные способности больных лежат, видимо, аналогичные механизмы, что и в сфере памяти. Следует отметить, что диспраксия динамического характера является характерной особенностью когнитивных нарушений при субкортикальной деменции (в частности, вследствие сосудистой мозговой недостаточности). Благоприятное влияние исследуемого препарата на двигательные способности больных подчеркивает перспективность использования Инстенона при когнитивных нарушениях, связанных с хронической сосудистой мозговой недостаточностью и, возможно, других заболеваниях, которые сопровождаются когнитивными нарушениями по субкортикальному типу.
Влияние Инстенона на клинические неврологические нарушения у обследованных больных было существенно меньшим. Однако по некоторым показателям, отражающим атактические расстройства, была зафиксирована статистически значимая положительная динамика. В литературе имеются указания на бoльшую эффективность Инстенона при вертебрально-базилярной недостаточности.
После курса лечения Инстеноном достоверно улучшилось самочувствие больных: уменьшилась выраженность головокружения, шума в голове, утомляемости и снижения памяти. Положительная динамика была отмечена прежде всего в отношении тех субъективных симптомов, которые связаны с состоянием когнитивных функций (жалобы на снижение памяти, повышенную утомляемость). Терапия Инстеноном не оказала статистически значимого влияния на симптомы, связанные с эмоциональным состоянием больных, такие как головная боль и нарушения сна.
Раздельный анализ динамики когнитивных и неврологических нарушений у пациентов с деменцией и без деменции выявил сходный характер изменений исследуемых показателей в обеих группах. Однако у пациентов с деменцией эффект препарата в целом был более слабым и редко достигал статистической значимости. Это вполне объяснимо, учитывая то, что при сосудистой деменции имеется значительно больший морфологический дефект, а имеющиеся нарушения хуже поддаются коррекции.
Переносимость исследуемого препарата была хорошей у всех обследованных больных. Побочный эффект лечения в виде усиления головной боли был зафиксирован лишь у одного пациента, тяжесть ее была выражена весьма незначительно, в дальнейшем головная боль регрессировала без дополнительного лечения. Следует заметить, что указания на подобные случаи имеются и в литературе [8, 20].В.А. Яворская и соавт. указывают на возможность возникновения головных болей и чувства дискомфорта у пациентов с изменениями внешнего дыхания по типу гипервентиляции, что авторы связывают с возбуждающим влиянием препарата на дыхательный центр.
Таким образом, Инстенон является весьма перспективным препаратом для применения при ДЭ II-III стадии. Этот препарат хорошо переносится и оказывает положительный эффект в отношении состояния когнитивных функций, самочувствия больных, нарушения равновесия и ходьбы. Инстенон может быть рекомендован к широкому применению у пациентов с ДЭ.
Показания:
заболевания мозга сосудистого генеза и связанные с возрастными изменениями;
последствия недостаточности кровоснабжения мозга;
постинсультные состояния;
головокружения, вызванные функциональными расстройствами мозга.
Побочное действие
В отдельных случаях: при применении в высоких дозах - головная боль, гиперемия лица, снижение АД.
Цераксон
Фармакологическое действие:
Действующее вещество Цераксона - цитиколин - улучшает функции ионообменных насосов мембран нервных клеток, за счет образования новых фосфолипидов. Стабилизируя мембрану нейронов, Цераксон уменьшает выраженность отека головного мозга. Вследствие чего, наблюдается регресс таких симптомов, как когнитивные нарушения, нарушения памяти и внимания, связанные с травмами черепа, гипоксическими состояниями, ОНМК.
Так как цитиколин находится в организме человека, провести исследования фармакокинетики не представляется возможным, потому что нельзя разграничить эндогенный цитиколин и экзогенный. Препарат, практически полностью (на 99%) всасывается из ЖКТ, выделяется преимущественно через почки. Биодоступность не зависит от способа введения и одинакова, как при пероральном, так и при парентеральном введении.
Показания к применению:
ОНМК, в острой стадии;
терапия осложнений, возникших, вследствие ОНМК;
ЧМТ в остром периоде и в периоде реабилитации;
неврологические нарушения, когнитивные и двигательные расстройства, возникшие вследствие патологии сосудов мозга или дегенеративных процессов.
Способ применения:
В виде раствора для перорального применения назначается по 2 мл (200мг) трижды в день. Для взрослых, по 1 мл (100мг) 2-3 раза в сутки для детей. Детям можно назначать Цераксон с момента рождения.
Длительность курса терапии зависит от тяжести заболевания, но не менее 1.5 мес.
Способ приема: препарат в виде раствора, вводится с помощью шприца. После каждого приема препарата, шприц рекомендуется промывать.
При острых состояниях, терапию препаратом необходимо начать, как можно раньше, желательно в первые сутки. При острых состояниях препарат можно вводить внутривенно (с небольшой скоростью) или внутривенно капельно (скорость инфузии 1 капля в минуту).
Схема дозирования Цераксона: 0.5 г-1г дважды в сутки внутривенно, в течение 14 дней, затем 0.5-1г дважды в сутки внутримышечно. После чего возможен переход на пероральный прием. Рекомендованный курс терапии, для получения максимального эффекта - 3 месяца. Доза препарата и кратность приема могут варьироваться в зависимости от дозировки, максимальная суточная дозировка - 2г.
Побочные действия:
Иногда, возможна гипотензия и другие симптомы стимуляции парасимпатической системы.
Противопоказания:
Не назначать людям, имеющим парасимпатический тип нервной системы.
Нейропептиды
В последнее время активно ведется поиск высокоэффективных нейропротекторов среди нейропептидов. Новым направлением в исследовании нейропептидов стало определение их роли в регуляции апоптоза, а также влияния на экспрессию генов раннего реагирования.
Нейропептиды свободно проникают через гематоэнцефалический барьер и оказывают многостороннее действие на ЦНС, что сопровождается высокой эффективностью и выраженной направленностью действия при условии их очень малой концентрации в организме. (16)
Тесная взаимосвязь всех отдаленных последствий ишемии, а также общность их триггерных механизмов позволяют, наряду с локальным воздействием на них использовать модулирующие влияния через системы регуляторов, осуществляющих контроль над экспрессией вторичных клеточных мессенджеров, цитокинов и других сигнальных молекул, а также над запуском генетических программ апоптоза, антиапоптозной защиты, усиления нейротрофического обеспечения. Такие регуляторные (модуляторные) влияния устраняют общую дезинтеграцию во взаимодействии сложных и часто разнонаправленных молекулярно-биохимических механизмов, восстанавливая их нормальный баланс. Особо важную роль при этом играют эндогенные регуляторы функций ЦНС - нейропептиды [17]. Их молекулы, представляющие собой короткие аминокислотные цепи, "нарезаются" из более крупных белковых молекул-предшественников ферментами протеолиза ("процессинг") лишь "в нужном месте и в нужное время" в зависимости от потребностей организма. Нейропептиды существуют всего несколько секунд, но длительность их действия может измеряться часами. Эндогенное образование нейропептида в ответ на какое-либо изменение внутренней среды приводит к высвобождению ряда других пептидов, для которых первый является индуктором. Если их совместное действие однонаправлено, эффект будет суммированным и продолжительным. Выход пептида может регулироваться несколькими регуляторными пептидами предыдущего каскада. Таким образом, эффекторная последовательность совокупности пептидов образует так называемый пептидный регуляторный континуум, особенность которого заключается в том, что каждый из регуляторных пептидов способен индуцировать или ингибировать выход ряда других пептидов. В результате, первичные эффекты того или иного пептида могут развиваться во времени в виде цепных и каскадных процессов [18].
Особенностью структуры нейропептидов является наличие нескольких лигандных групп связывания, предназначенных для разных клеточных рецепторов. Это одно из "молекулярных объяснений" присущей им полифункциональности. Физиологическая активность нейропептидов во много раз превышает аналогичное действие непептидных соединений. В зависимости от места их высвобождения, нейропептиды могут осуществлять медиаторную функцию (передачу сигнала от одной клетки к другой); модулировать реактивность определенных групп нейронов; стимулировать или тормозить выброс гормонов; регулировать тканевой метаболизм или выполнять функцию эффекторных физиологически активных агентов (вазомоторная, Na+-уретическая и другие виды регуляции). Известно, что нейропептиды способны регулировать активность про - и противовоспалительных цитокинов через модуляцию активности их рецепторов. При этом восстановление нормального баланса цитокинов происходит более эффективно, чем при воздействии на отдельные цитокиновые системы. Как правило, "цитокиновые" эффекты нейропептидов сопровождаются их влиянием на генерацию оксида азота и другие оксидантные процессы [19]. Многие нейропептиды проявляют выраженные нейротрофические ростовые свойства, а также способность регулировать экспрессию ранних генов. С учетом того, что нейропептиды легко проникают через гематоэнцефалический барьер (в отличие от полипептидных цепей факторов роста), трудно переоценить их потенциальную терапевтическую значимость.
Нейропептиды: общие сведенья.
Постулаты:
Первый постулат: нейропептиды - универсальные регуляторы.
Второй постулат: пептиды построены как комбинации аминокислот - основных “кирпичиков" биологического мира.
Третий постулат: нейропептиды синтезируются в мозге (впрочем, в других органах тоже).
Четвертый постулат: биохимия синтеза пептидов едина для любых систем организма.
Пятый постулат: принцип “ЧТО? - ГДЕ? - КОГДА? ” как основной закон упорядоченной регуляторной миссии нейропептидов.
ПЕРВАЯ - ЧТО? Какой пептид (химическая и фармакологическая специфика)?
ВТОРОЕ - ГДЕ? В каком органе или в каких клетках экспрессируется его стимулированный синтез? Где предстоит пептиду работать как регулятору или исполнителю физиологического процесса?
ТРЕТЬЕ - КОГДА? В какой момент ритмично следующей или патологически нарушенной динамики физиологических процессов изменяется его активность?
Шестой постулат: рецептор - специализированная мембранная структура, где информационный сигнал превращается в физиологический акт.
Седьмой постулат: болезнь как нарушение соразмерности в биогенезе и рецепции нейропептидов. (5)
К нейропептидам относят любые пептиды, локализованные в нервной ткани и участвующие в регуляции функций ЦНС. В настоящее время известно около 100 нейропептидов, которые синтезируются различными популяциями нейронов мозга млекопитающих. Их молекулы, представляющие собой короткие аминокислотные цепи, "нарезаются" из более крупных белковых молекул-предшественников ферментами протеолиза (процессинг нейропептидов) лишь "в нужном месте и в нужное время" в зависимости от потребностей организма. Нейропептиды существуют всего несколько секунд, но длительность их действия может измеряться часами.
Обычно нейропептиды взаимодействуют с рецепторами посредством связывания с G-белком. Тогда как медиаторы воздействую на возбудимость других нейронов либо деполяризуя, либо гиперполяризуя их, нейропептиды обладают более широким спектром действия: они могут влиять на генную экспрессию, местный кровоток, образование синапсов и морфологию клеток нейроглии. Кроме того, в отличие от нейромедиаторов, они обладают продолжительным действием.
Нейропептиды имеют несколько групп связывания, предназначенных для разных клеточных рецепторов - это объясняет их полифункциональность. Физиологическая активность нейропептидов во много раз превышает действие непептидных соединений.
В течение последних десяти лет в ходе многочисленных клинических исследований были изучены эффекты многих нейропептидов на процессы нейродегенерации.
Для многих нейропептидов предложены "биологически активные конформации", обладая которыми пептид предпочтительно вступает во взаимодействие с рецептором.
Нейропептиды играют особую роль, так как являются эндогенными регуляторами функций ЦНС и имеющие ряд преимуществ перед другими группами нейропротективных препаратов:
высокая физиологическая активность (во много раз выше, чем у непептидных соединений);
наличие нескольких групп связывания для разных клеточных рецепторов и способность к регуляции экспрессии других сигнальных молекул, что обеспечивает многофункциональность нейропептидов;
короткое время жизни, обеспечивающее минимум побочных эффектов;
способность проникать через гематоэнцефалический барьер;
наличие трофических, ростовых, противовоспалительных, медиаторных и эффекторных свойств.
Так как многие нейропептиды проявляют выраженные нейротрофические ростовые свойства и легко проникают через гематоэнцефалический барьер (в отличие от полипептидных цепей факторов роста), трудно переоценить их потенциальную терапевтическую значимость.
Основной проблемой при применении нейропептидов для лечения является проблема доставки их в ЦНС: нейропептиды очень быстро разрушаются под действием особых пептидаз, время их действия очень ограничено, а потери по пути в ЦНС остаются большими. ведется работа по созданию нейропептидов, обладающих повышенной проникающей способностью через гематоэнцефалический барьер с использованием других путей введения, например, через назоталамический путь (через нос).
Нейропептиды: противовоспалительное действие.
Известно, что нейропептиды способны регулировать активность про - и противовоспалительных цитокинов через модуляцию активности их рецепторов. При этом восстановление нормального баланса цитокинов происходит более эффективно, чем при воздействии на отдельные цитокиновые системы. Как правило, цитокиновые эффекты нейропептидов сопровождаются их влиянием на образование NO (оксида азота) и другие.
Нейропептиды против апоптоза.
Новым направлением в исследовании нейропептидов стало определение их роли в регуляции апоптоза. Существует определенная параллель между информацией об участии нейропептидов и нейротрофических факторов роста в развитии неврологических расстройств и причастностью этих химических регуляторов к апоптозу нейронов. Нейротрофические ростовые факторы можно разделить на те, которые играют роль индукторов апоптоза в нервной ткани и те, которые противодействуют его развитию.
Так, например, короткие фрагменты ADNF ADNF-14 ADNF-9 предотвращают смерть нейронов при БА. Нейропептид NAD, состоящий из 8 аминокислот и сходный по строению с ADNF, предотвращал когнитивные нарушения у моделей с БА.
Такие свойства этих нейропептидов свидетельствуют о том, что их можно рассматривать как возможные терапевтические агенты для лечения психоневрологических расстройств, связанных с нейродегенерацией.
Нейропептиды - биологически активные соединения, синтезируемые в нервных клетках. Нейропептиды:
участвуют в регуляции обмена веществ и поддержании гомеостаза,
воздействуют на иммунные процессы,
играют важную роль в механизмах памяти, обучения, сна и др.
могут действовать как медиаторы и гормоны. (6)
Влияние нейропептидов на выработку интерферонов.
Многие неврологические заболевания сопровождаются развитием иммунодефицитного состояния, о чем свидетельствует нарушение продукции цитокинов, в частности в системе интерферонов. К таким заболеваниям относится острое нарушение мозгового кровообращения (ОНМК), болезнь Альцгеймера, травматические повреждения головного мозга, а также различные нейроинфекционные заболевания. Результаты проведенных клинических исследований показали, что использование нейропептидов (на моделе церебролизина) приводит к нормализации нарушенных показателей иммунитета при остром инсульте, болезне Альцгеймера, у часто и длительно болеющих детей с минимальной мозговой дисфункцией, а также при нейроинфекционных заболеваниях. По скольку головной мозг является одним из регуляторов иммунной системы, то очевидно, что препарат, полученный из головного мозга (церебролизин), способен оказывать регулирующее действие на иммунную систему. Предложена гипотеза о том, что механизм нейроиммунокорригирующего действия церебролизина обусловлен не только специфической нейротрофической активностью, сходной с эффектом фактора роста нервов, но и индукцией интерферона, который в свою очередь обладает противовирусной, иммуномодулирующей и антипролиферативной активностью. Лечебный эффект церебролизина у больных с ОНМК, нейроинфекционными заболеваниями, деменцией альцгеймеровского типа (дефицитной по интерферону) и травматическим повреждением головного мозга может быть связан с индукцией интерферона, который в свою очередь корригирует дисбаланс нейроиммунной системы.
Нейропептиды (на модели церебролизина) оказывают как прямое (индукция интерферона), так и опосредованное (нейротрофичк; еский эффект) иммунокорригирующее действие при многих неврологических заболеваниях, сопровождающихся нарушениями иммунной системы. (10)
Нейропептиды-лекарства.
В последние годы все больше и больше внимания уделяется изучению и поиску новых способов нейропротективной терапии.
Нейропептиды являются щелочными полипептидами, имеющие молекулярную массу от 1000 до 10000Да. Их получают из тканей сетчатки и головного мозга с помощью кислой экстракции с последующей очисткой от балластных веществ. Данный метод получения исключает возможность переноса вирусов и протоонкогенов, что обеспечивает безопасность применения данных веществ в клинической практике.
Нейропептиды обладают способностью индуцировать процессы специфической дифференцировки в популяции клеток, являющимися исходным материалом для их получения.
Они влияют на клеточный и гуморальный иммунитет, состояние системы гомеастаза, ПОЛ и другие защитные реакции организма. Это действие выражено в разной степени и зависит от применяемой дозы.
Механизмы действия нейропетидов в настоящее время не до конца ясен. По всей видимости, их эффекты осуществляются через специфические рецепторы, расположенные на поверхности клетки. После экзогенного введения полипептидов происходит выброс эндогенных регуляторных пептидов, для которых введенный пептид является индуктором. Эффект пептидного каскада приводит к пролонгированию эффекта нейропептидов, который сохраняется даже после полного разрушения первоначального индуктора.
В настоящее время используются такие нейропептиды, как ретиламин и кортексин. (7)
Ретиланамин
Свойства / Действие:
Ретиналамин - пептидный биорегулятор; препарат, улучшающий функциональное состояние сетчатки. Ретиналамин представляет собой лиофилизат, полученный путем уксуснокислой экстракции из сетчатки глаза крупного рогатого скота или свиней, содержащий комплекс низкомолекулярных пептидов, молекулярный вес которых не превышает 10 000 дальтон, достаточный для проникновения через гематоофтальмический барьер.
Ретиналамин обладает тканеспецифическим многофункциональным действием на сетчатку глаза.
Ретиналамин оказывает стимулирующее действие на фоторецепторы и клеточные элементы сетчатки, улучшает функциональное взаимодействие пигментного эпителия и наружных сегментов фоторецепторов при дистрофических изменениях, стимулирует репаративные процессы при заболеваниях и травмах сетчатки глаза, ускоряет процесс восстановления световой чувствительности.
Ретиналамин оказывает нормализующее действие на коагуляцию крови, обладает выраженным протекторным действием в отношении сосудистого эпителия, а также иммуномодулирующим действием.
Ретиналамин нормализует проницаемость сосудов, уменьшает проявления воспалительной реакции.
Ретиналамин улучшает метаболизм клеток, способствует оптимизации энергетических процессов и нормализации функций клеточных мембран, улучшает внутриклеточный синтез белка, регулирует процессы перекисного окисления липидов.
Ретиналамин прошел широкие клинические испытания в ведущих медицинских учреждениях страны: Санкт-Петербургской государственной медицинской академии им.И. И. Мечникова, клинике Военно-медицинской академии, клинике Научно-исследовательского института экспертизы трудоспособности и организации труда инвалидов, Одесском научно-исследовательском институте глазных болезней и тканевой терапии им. академика В.П. Филатова, Главном военном клиническом госпитале им.Н. Н. Бурденко, Научно-исследовательском институте фтизиопульмонологии МЗ РФ, клинике глазных болезней Читинской Государственной медицинской академии и др.
Показания:
Ретиналамин применяют у больных при:
центральные и периферические наследственные тапеторетинальные абиотрофии;
пигментная дегенерация сетчатки различного генеза;
диабетическая ретинопатия;
вторичные посттравматические и поствоспалительные центральные дистрофии сетчатки.
Способ применения и дозы:
Ретиналамин вводят парабульбарно или внутримышечно по 5 - 10 мг 1 раз/сут в течение 5 - 10 дней.
При необходимости проводят повторный курс Ретиналамином через З-б месяцев.
Правила приготовления раствора Ретиналамина: содержимое флакона перед инъекцией растворяют в 1-2 мл 0,5% раствора новокаина, воды для инъекций или изотонического раствора натрия хлорида.
Противопоказания:
Применение Ретиналамина противопоказано при индивидуальной непереносимости препарата, беременности.
Побочное действие:
При применении Ретиналамина побочного действия в рекомендуемых дозах не выявлено.
Возможны аллергические реакции. (8)
Кортексин
Кортексин - препарат полипептидной природы (пептидный биорегулятор), получаемый путем экстракции из коры головного мозга крупного рогатого скота и свиней. В медицинской практике Кортексин используется в виде прозрачного бесцветного раствора, который готовят из лиофизилированного порошка.
Кортексин содержит низкомолекулярные активные нейропептиды, молекулярный вес которых не превышает 10 000 дальтон, достаточный для проникновения через ГЭБ.
Фармакологическое действие:
Кортексин оказывает церебропротекторное (нейропротекторное), ноотропное и противосудорожное действие; Кортексин обладает тканеспецифическим многофункциональным действием на кору головного мозга, что проявляется в метаболической регуляции (повышает эффективность энергетического метаболизма клеток мозга, улучшает внутриклеточный синтез белка), функциональной нейромодуляции, нейротрофической активности.
Кортексин регулирует соотношение тормозных и возбуждающих аминокислот, уровень серотонина и дофамина, оказывает ГАМКергическое влияние, обладает антиоксидантной активностью (регулирует процессы перекисного окисления липидов в клетках головного мозга, снижает образование свободных радикалов, блокирует процессы свободнорадикального окисления).
Кортексин стимулирует процесс умственной деятельности, не оказывая избыточного активирующего влияния, восстанавливает биоэлектрическую активность головного мозга.
Кортексин оказывает положительное действие при нарушении когнитивных функций, улучшает концентрацию внимания, кратковременную память, улучшает процессы обучения, ускоряет восстановление функций головного мозга после стрессорных воздействий, стимулирует репаративные процессы в головном мозге, снижает токсические эффекты нейротропных веществ.
Фармакокинетика
Сложный состав Кортексина, состоящего из биологически активных нейропептидов, содержащих 20 аминокислот и обладающих суммарным многофункциональным действием, не позволяет произвести обычный фармакокинетический анализ отдельных компонентов.
Показания:
Кортексин показал высокую эффективность при лечении следующих заболеваний:
черепно-мозговая травма;
нарушения мозгового кровообращения;
вирусные и бактериальные нейроинфекции;
энцефалопатии различного генеза;
острые и хронические энцефалиты и энцефаломиелиты;
эпилепсия;
астенические состояния (астения);
вегето-сосудистая дистония, надсегментарные вегетативные расстройства;
нарушение памяти, мышления;
сниженная способность к обучению;
различные формы детского церебрального паралича;
задержка психомоторного и речевого развития у детей.
Способ введения и дозы:
Применение Кортексина в виде стерильного лиофилизированного порошка во флаконах по 10 мг: содержимое флакона (ампулы) перед инъекцией растворяют в 1,0-2,0 мл 0,5% раствора новокаина, воды для инъекций или изотонического 0,9% раствора хлорида натрия для инъекций.
Взрослым Кортексин назначают внутримышечно однократно ежедневно по 10 мг в течение 5-10 дней.
Детям с массой тела до 20 кг Кортексин вводят в дозе 0,5 мг/кг, с массой тела более 20 кг - 10 мг внутримышечно ежедневно однократно в течение 10 дней.
При необходимости проводят повторный курс Кортексином через 1-6 месяцев.
Дельтаран - нейропротектор с мощным антиоксидантным, стресс-протекторным и антидепрессивным действием.
Фармакологическое действие:
Дельтаран - представитель принципиально нового класса фармакологических препаратов - нейропротекторов с мощным антиоксидантным, стресс протекторным и антидепрессивным действием, обеспечивающих защиту нейронов от разрушения токсическими, инфекционными и другими повреждающими агентами, а также предупреждающих гибель нервных клеток вследствие стресса.
Дельтаран разработан в Институте биоорганической химии Российской Академии Наук им. М.М. Шемякина и Ю.А. Овчинникова, при участии Института фармакологии РАМН, Института Онкологии им.Н. Н. Петрова, Исследовательского Центра "Комкон".
Дельтаран - синтетический нейропептид, структурно соответствующий своему эндогенному аналогу. Дельтаран - смесь синтетического нейропептида, называемого дельта-сон индуцирующим пептидом, (1 весовая часть) и аминокислоты глицина (10 весовых частей). Дельта-сон индуцирующий пептид имеет следующую аминокислотную последовательность: триптофанил - аланил - глицил - глицил - аспартил - аланил - серил - глицил - глутаминовая кислота.
Дельтаран способствует формированию дельта-фазы сна, обладает стресспротекторным и антидепрессивным действием.
После интраназального введения Дельтаран достигает таламических ядер через 1,5-2 минуты. Стабилизирующий эффект развивается, в зависимости от уровня эндогенных пептидов, в течение от 3 минут до 1,5 часов.
Дельтаран - препарат для коррекции нарушений при алкоголизме и наркомании; средство для лечения абстинентного синдрома.
уменьшает первичное патологическое влечение к алкоголю и устраняет проявления алкогольной абстиненции;
эффективен в комплексной терапии абстинентного синдрома, как при алкоголизме, так и при опийной наркомании; в некоторых случаях может использоваться в виде монотерапии;
эффективен в последующей терапии алкоголизма и наркомании, уменьшая первичное патологическое влечение, редуцируя вегето-астенический и депрессивный синдромы;
эффективен при лечении алкоголизма и наркомании, осложнённых посттравматическими нарушениями ЦНС;
возможно, способен восстанавливать генетически детерминированную чувствительность опиатных рецепторов.
Показания:
в наркологической практике Дельтаран применяется в качестве средства купирования алкогольного абстинентного синдрома и первичного патологического влечения к алкоголю (Дельтаран наиболее эффективен при наличии в структуре алкогольного абстинентного синдрома вегетативных и аффективных проявлений (субдепрессивных и дисфорических); Дельтаран положительно влияет на отдельные проявления алкогольного абстинентного синдрома в виде аффективных нарушений с преобладанием повышенной утомляемости и астении;
при интоксикациях (алкогольной, наркотической, ятрогенной, в том числе и вследствие высокодозной химиотерапии злокачественных новообразований);
при патологиях центральной и периферической нервной системы (менингиты, энцефалиты любого генеза, невриты, радикулиты, парезы, инсульты, рассеянный склероз, эпилепсии, черепно-мозговые травмы, ДЦП, ММД у детей);
в нейрологической и геронтологической практике Дельтаран применяется для купирования синдромов дисциркуляторной энцефалопатии атеросклеротического генеза (при головных болях, тяжести и шуме в голове, раздражительности, эмоциональной неустойчивости, дисфории и нарушениях сна);
в нейрологической практике Дельтаран применяется при снижении памяти, умственной работоспособности и других интеллектуально-мнестических нарушениях;
при болезнях сердечно-сосудистой системы (атеросклероз, гипертоническая болезнь, ишемическая болезнь сердца, стенокардия, различные аритмии, миокардиты);
при неотложном состоянии (шок любого генеза, в т. ч. травматический, токсический, дыхательная недостаточность, нарушения кардиоритма).
Способ применения и дозы:
Дельтаран перед употреблением разводится кипячёной водой комнатной температуры в количестве 1 мл, а затем закапывается по одной-две капли в среднюю часть носа в зону разветвления окончаний обонятельного нерва, как известно, не имеющего синапсов на пути в ЦНС, с интервалом 10-20 минут (по 0.5 мл в сутки в каждый носовой ход). Продолжительность лечения Дельтараном составляет 5-10 дней. При необходимости курс лечения Дельтараном повторяют.
Противопоказания:
беременность, период лактации;
индивидуальная непереносимость (в т. ч. гиперчувствительность в анамнезе) компонентов препарата Дельтаран.
Побочные эффекты:
Возможны аллергические реакции.
Церебролизин. - гидролизат белковой вытяжки из головного мозга молодых свиней, содержащий 85% аминокислот и 15% пептидов; 1 мл раствора церебролизина получают из 1 г вещества мозга животных. Активной фракцией препарата являются мозго-специфичные пептиды; аминокислоты, входящие в состав церебролизина, свободны и находятся в постоянной естественной связи друг с другом. Молекулярная масса пептидов церебролизина не превышает 10 000 Da, что исключает возможность развития анафилактических реакций, а также обусловливает легкое проникновение пептидов через гематоэнцефалический барьер и активное их включение в метаболизм нейронов головного мозга.
Фармакологическое действие:
Ноотропное средство - концентрат, содержащий низкомолекулярные биологически активные нейропептиды (мол. масса не превышает 10 тыс. Da), которые проникают через ГЭБ и непосредственно поступают к нервным клеткам. Оказывает нейропротекторное действие, обеспечивает функциональную нейромодуляцию, метаболическую регуляцию головного мозга, имеет нейротрофическую активность. Нейропротекторное действие обусловлено защитой нейронов от повреждающего действия лактацидоза, предотвращением образования свободных радикалов и снижением концентрации продуктов ПОЛ на модели ишемии - реперфузии. Повышает жизнеспособность и предотвращает гибель нейронов в условиях гипоксии и ишемии, снижает повреждающее нейротоксическое действие аминокислот (глутамата); подавляет апоптоз посредством ингибирования палпаина и цаспаазы. Метаболическая регуляция осуществляется посредством повышения эффективности аэробного энергетического метаболизма мозга, что ведет к улучшению внутриклеточного синтеза белка в развивающемся и стареющем мозге. Нейротрофическая активность обусловлена стимуляцией формирования синапсов и предотвращением активации клеток микроглии и индукции астроглиоза. Функциональная нейромодуляция: оказывает положительное влияние при нарушениях познавательных функций, улучшает концентрацию внимания, процессы запоминания и воспроизведение информации, связанные с кратковременной памятью, повышает способность к приобретению и сохранению навыков, активизирует процесс умственной деятельности, улучшает настроение. Способствуя формированию положительных эмоций, оказывает модулирующее влияние на поведение. После однократного введения специфическая нейротрофическая активность сохраняется около 8 ч.
Показания:
Цереброваскулярная недостаточность (дисциркуляторная энцефалопатия), ишемический инсульт (острая фаза и в стадии реабилитации), состояние после геморрагического инсульта, травматические повреждения мозга (сотрясение мозга, ЧМТ, состояние после хирургического вмешательства на мозге), задержка умственного развития у детей, снижение способности к концентрации внимания у детей, синдром деменции различного генеза (пресенильная - болезнь Альцгеймера, сенильная альцгеймеровского типа, сосудистая - мультиинфарктная форма, смешанные формы), эндогенная депрессия, резистентная к антидепрессантам.
Противопоказания:
Гиперчувствительность, острая почечная недостаточность, эпилептический статус. C осторожностью. Беременность (I триместр).
Побочные действия:
Аллергические реакции, гипертермия (на фоне быстрой в/в инфузии), болезненность в месте введения.
Способ применения и дозы:
В/м или в/в капельно. При острых состояниях (ишемический инсульт, ЧМТ, осложнения после нейрохирургических операций) - в/в капельно, в течение 60-90 мин, по 10-60 мл в 100-250 мл 0.9% раствора NaCl; продолжительность курса - 10-25 дней. В резидуальном периоде инсульта и травматического повреждения мозга - в/в, по 5-10 мл в течение 20-30 дней. При психоорганическом синдроме и депрессии - в/в, по 5-10 мл в течение 20-25 дней (деменция) или 10-15 дней (депрессия). В нейропедиатрической практике - в/м, по 1-2 мл (до 1 мл на 10 кг массы тела) в течение 1 мес, с повторением курса 2-3 раза в год. При болезни Альцгеймера, деменции сосудистого и сочетанного генеза - в/в капельно, 20-30 мл в 100-200 мл 0.9% раствора NaCl. Курс лечения - 20 инфузий. (9)
В последние годы всё больше внимания уделяется изучению свойств нейропептидов, оказывающих эффективное многостороннее влияние на центральную нервную систему.
Одним из первых отечественных лекарственных средств пептидной природы является "Семакс", разработанный в Институте молекулярной генетики РАН. Это синтетический аналог фрагмента АКТГ 4-10, полностью лишенный гормональной активности. Экспериментальные исследования показали ряд преимуществ семакса перед природным АКГТ 4-10, отсутствие токсичных и побочных явлений, большую продолжительность действия (более чем в 24 раза), высокую устойчивость в организме.
Семакс, являясь эндогенным регулятором функций центральной нервной системы, в очень малых дозах (3 - 30 мкг/кг) даёт ярко выраженный ноотропный эффект. Он стимулирует функции переднего мозга: улучшает консолидацию памяти, повышает способность к обучению. При этом в отличие от большинства ноотропных препаратов непептидной природы семакс не вызывает истощения соответствующих функций. Уже в малых дозах он улучшает энергетические процессы мозга, повышает его устойчивость к стрессовым повреждениям, гипобарической и сосудистой гипоксии, экспериментальным нарушениям мозгового кровообращения. Клинические исследования показали высокую эффективность семакса при лечении интеллектуально-мнестических расстройств и астенических состояний различного генеза, органических поражений головного мозга, инсультов, состояний вызванных сосудистой гипоксией, а также при профилактике и лечении постнаркотических мнестических нарушений.
Исследования клинической эффективности семакса при заболеваниях мозга явились предпосылкой для клинического изучения эффективности препарата в офтольмологии при заболеваниях зрительного нерва. (11)
Семакс. - синтетическое олигопептидное соединение. Одна капля 0,1% водного раствора семакса содержит 50 мкг синтетического олигопептида метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролила, аналога фрагмента 4-10 АКТГ.
Фармакологическое действие:
Механизм действия семакса основан на адаптивных изменениях клеточного метаболизма лимбической системы. Эти изменения приводят к повышению продукции цАМФ.
Фармакологическое действие - ноотропное, церебропротективное, антигипоксическое, антиоксидантное.
Фармакодинамика
Семакс обладает оригинальным механизмом нейроспецифического действия на ЦНС.
Семакс обладает выраженным нейрометаболическим действием, проявляющимся даже при назначении его в очень малых дозах. Более высокие дозы Семакса, сохраняя нейрометаболические свойства малых доз, оказывают выраженное антиоксидантное, антигипоксическое, ангиопротективное и нейротрофическое действие. При интраназальном введении Семакс через 4 мин проникает через ГЭБ, а терапевтическое действие при однократном введении продолжается 20-24 ч, что связано с его последовательной деградацией, при которой бóльшая часть эффектов нейропептида сохраняется у его фрагментов.
Нейрометаболическое
Препарат влияет на процессы, связанные с формированием памяти и обучением. Семакс усиливает внимание при обучении и анализе информации, улучшает консолидацию памятного следа; улучшает адаптацию организма к гипоксии, церебральной ишемии, наркозу и другим повреждающим воздействиям.
Семакс оказывает стимулирующее действие на популяцию холинергических нейронов базальных ядер переднего мозга.
Направленное действие Семакса на холинергические нейроны сопровождается достоверным повышением активности фермента ацетилхолинэстеразы специфических структур мозга, что коррелирует с улучшением процессов обучения и формирования памяти.
Нейропротективное
Семакс влияет на процессы отсроченной нейрональной гибели, включая локальное воспаление, образование оксида азота, оксидантный стресс и дисфункцию трофических факторов. Мощное, сопоставимое с эффектом NGF, трофотропное действие Семакса на нейроны холинергической группы как в полной среде, так и в неблагоприятных условиях, обусловленных депривацией глюкозы и кислорода. Семакс на генном уровне включает синтез нейротрофинов - регуляторов роста и дифференциации нервной ткани (фактора BDNF).
Семакс оказывает прямое действие на молекулярные триггерные механизмы, на нормализацию баланса цитокинов и на повышение уровня противовоспалительных факторов, снижая образования оксида азота, вызывая торможения процессов перекисного окисления липидов (ПОЛ), активации синтеза супероксид дисмутазы (СОД) и снижения уровня циклического гуазинмонофосфата (cGMP).
Антиоксидантное, антигипоксическое
Семакс положительно влияет на адаптацию организма к гипоксии. Обнаружена способность препарата купировать постгипервентиляционные ЭЭГ-эффекты, вызванные компенсаторным уменьшением мозгового кровотока.
Препарат практически не токсичен при однократном и длительном введении. Не проявляет аллергических, эмбриотоксических, тератогенных и мутагенных свойств. Не обладает местнораздражающим действием.
Показания препарата Семакс
интеллектуально-мнестические расстройства при сосудистых поражениях головного мозга;
состояния после ЧМТ, нейрохирургических операций и наркоза;
дисциркуляторная энцефалопатия;
преходящие нарушения мозгового кровообращения, а также невротические расстройства различного генеза, в т. ч. после ионизирующего излучения;
восстановительный период после инсульта;
повышение адаптационных возможностей организма человека в экстремальных ситуациях;
профилактика психического утомления при монотонной операторской деятельности в наиболее напряженные периоды работы в стрессовых условиях;
атрофия зрительного нерва;
невриты воспалительной, токсико-аллергической этиологии;
в качестве ноотропного средства у детей в возрасте от 5 лет при лечении минимальных мозговых дисфункций (в т. ч. синдрома дефицита внимания с гиперактивностью).
Ишемический инсульт (острый период).
Противопоказания
повышенная чувствительность к компонентам препарата;
беременность;
период лактации;
острые психозы;
расстройства, сопровождаемые тревогой;
судороги в анамнезе;
детский возраст до 5 лет.
судороги в анамнезе.
Побочные действия
При длительном применении возможно слабое раздражение слизистой оболочки носа.
Заключение
Таким образом, проведенный анализ данных литературы показал значительную роль нейропептидов как в регуляции физиологических функций нервной ткани, так и при протекающих в ней патологических процессах. В связи с этим дальнейшая разработка фармакокоррекции токсических нейродеструктивных заболеваний нейропептидами является актуальной проблемой современной токсикологии и фармакологии.
Список литературы
1. Журнал Врач 2004г. №6 Нейропротективная терапия ишемического инсульта.
2. www.remedium.ru/public/journal/mc/2007/section. php
3. http://neurology. mif-ua.com
4. Громова О.А., Панасенко О.М., Скальный А.В. Нейрохимические механизмы действия современных нейропротекторов природного происхождения (элементный анализ и ферментативная антиокислительная активность) // Актовегин. Новые аспекты клинического применения.М., 2002, с.15-18.
5. http://vivovoco. astronet.ru
6. http://www.glossary.ru
7. Журнал клиническая офтальмология 2004г. №3, Сравнениенейропротекторных свойств ретиламина и эмоксипина.
8. http://amt. allergist.ru
9. http://www.webapteka.ru
10. Журнал Патологическая физиология и эксперементальная терапия. 2008г. №2,Влияние нейропептидов на выработку интерферонов.
11. Вестник офтальмологии 2000г. №1
12. Болдырев А.А. Роль активных форм кислорода в жизнедеятельности нейрона // Усп. физиол. наук. - 2003. - Т.34, №3. - С.21-34.
13. Скворцова В.И. Механизмы повреждающего действия церебральной ишемии и нейропротекция // Вест. РАМН. - 2003. - №11. - С.74-81.
14. Хижняк А.А., Курсов С.В. Участие возбуждающих аминокислотных трансмиттеров в механизмах нейродеструкции и перспективные методы патогенетической коррекции // Біль, знеболювання, інтенсивна терапія. - 2003. - №1. - С.43-51.
15. Болдырев А.А. Дискриминация между апоптозом и некрозом нейронов под влиянием окислительного стресса // Биохимия. - 2000. - Т.65, №7. - С.981-990.
16. Динзбург А.Л., Чирков А.М., Чиркова С.К. Стресс - протективный эффект нейропептидов у обезьян // Пат. физиол. эксперим. терапия. - 1995. - №1. - С. 19-21.
17. Рыбников В.Ю. Закуцкий Н.Г. Пептидная регуляция функций мозга. - СПб.: Стела, 2000, 24 с.
18. Шабалов Н.П., Скоромец А.А., Шумилина А.П., Платонова Т.Н. и др. Ноотропные и нейропротективные препараты в детской неврологической практике // Вестн. Росс. Воен. - мед. академии. - 2001. - №1 (5). - С.24-29.
19. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. - М.: Медицина, 2001. - 328 с.
20. Манвелов Л. С., Кадыков А.С. Инсульт. М. 2004г.
21. Гусев Е.И. Проблема инсульта в России // Инсульт. - 2003. - №9. - С.3-7.
© 2009 База Рефератов