
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Синтез м-нитробензальдегида
Курсовая работа: Синтез м-нитробензальдегида
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Инженерно-технологический факультет
Кафедра органической химии
Синтез м-нитробензальдегида.
Курсовая работа
Выполнил
(фамилия, имя, отчество)
______________________
(подпись)
Научный руководитель
Ширяев А.К.
_______________________
(подпись)
Работа защищена
«___»________________200_г.
Оценка____________________
Зав. кафедрой
Климочкин Ю.Н.
________________________
(подпись)
САМАРА 2007
СОДЕРЖАНИЕ
| Содержание | 2 | |
| 1. | Введение | 3 |
| 2. | Обзор литературы | 4-12 |
| 2.1. Номенклатура альдегидов | 4-5 | |
|
2.2. Методы синтеза альдегидов 2.3. Физические свойства и строение альдегидов 2.4. Реакция Канниццаро 2.5. Реакция электрофильного замещения |
5-8 8-10 10-11 11 |
|
| 3. | Обсуждение результатов | 12-13 |
| 4. | Экспериментальная часть | 14-15 |
| 4.1. Реагенты и оборудование | 14 | |
| 4.2. Методика эксперимента | 15 | |
| 5. | Выводы | 16 |
| 6. | Библиография | 17 |
1.Введение.
Данная исследовательская работа проведена для получения м-нитробензальдегида и подробного изучения свойств альдегидов, которые широко используются в промышленности, в органическом синтезе и в других областях. Например, в качестве дезинфицирующего средства используют формальдегид (для дезинфекции зерно- и овощехранилищ, парников, теплиц), также он широко применяется в органическом синтезе (например, в производстве синтетических смол (фенолформальдегидные, карбамидные), глицерина и т.д.).
При нагревании с аммиаком формальдегид образует гексаметилентетрамин (уротропин), который в больших количествах применяют в производстве фенолформальдегидных смол, взрывчатых веществ, а также в качестве горючего (сухой спирт).
Из ацетальдегида в промышленных масштабах получают уксусную кислоту, уксусный ангидрид, этиловый спирт, бутиловый спирт, ацетали, этилацетат и ряд других веществ. Подобно формальдегиду он конденсируется с фенолом, аминами и другими веществами, образуя синтетические смолы, используемые в производстве полимерных материалов.
Соединения, в которых карбонильная группа связана с двумя атомами водорода и одним углеводородным заместителем, называют альдегидами.
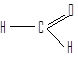
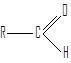
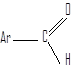
Углеводородные заместители могут быть алифатическими, алициклическими (насыщенными или ненасыщенными) или ароматическими.
2.Обзор литературы
Насыщенные и ароматические альдегиды.
2.1.Номенклатура.
Тривиальные названия альдегидов образуются из названия соответствующих карбоновых кислот путем замены слова кислота, словом альдегид.
По правилам номенклатуры ИЮПАК при составлении названия альдегида за основу выбирают наиболее длинную углеродную цепь, которая включает карбонильную группу (СНО). Эта группа получает наименьший номер. К названию углеводорода, соответствующего главной цепи, прибавляют суффикс – аль. Отметим, что, как и в случае карбоновых кислот, атом С-2 по номенклатуре ИЮПАК соответствует α-углеродному атому в обычных названиях
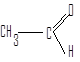
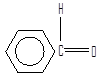
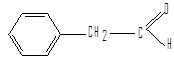
ацетальдегид бензальдегид фенилацетатальдегид
(этаналь) (фенилэтаналь)
В префиксе альдегидная группа называется формил-.
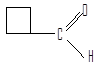
формилциклобутан (циклобутанкарбальдегид)
Для некоторых альдегидов применяют тривиальные названия, соответствующие названиям карбоновых кислот (даны в скобках).
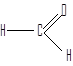
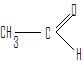
формальдегид (муравьиный альдегид) ацетальдегид (уксусный альдегид)


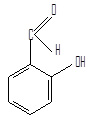
бензальдегид n-толуиловый альдегид салициловый альдегид
(бензойный альдегид)
2.2.Методы синтеза альдегидов
Лишь некоторые из многих лабораторных методов синтеза альдегидов будут описаны ниже. Некоторые основаны на реакции окисления или восстановления, в которых спирт, углеводород или хлорангидрид превращаются в альдегид с тем же числом атомов углерода. Другие методы включают образование новых углерод-углеродных связей и дают альдегиды с большим числом атомов углерода, чем в исходных веществах.
Озонолиз алкенов
Этот способ распространен в лабораторной практике. Он дает особенно хорошие результаты при применении к симметричным алкенам.
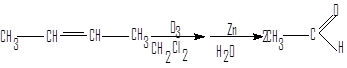
ацетальдегид
Окисление алкенов в присутствии солей палладия
Способ имеет промышленное применение и по экономическим причинам является более предпочтительным, чем гидратация ацетилена.
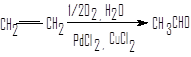
этилен ацетальдегид
Гидроформилирование алкенов
Этот способ относится к группе процессов оксосинтеза, основу которых составляют каталитические превращения смеси оксида углерода и водорода.
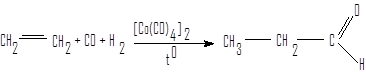
этилен пропаналь
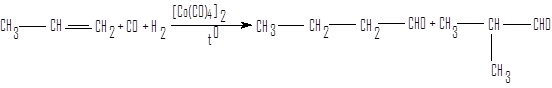
пропен бутаналь 2-метилпропаналь
(основной продукт)
Гидратация алкинов (реакция Кучерова)
Гидратация ацетилена – один из ранних способов получения ацетальдегида в промышленности.
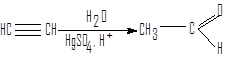
ацетилен ацетальдегид
Окисление алкенилборанов
Алкенилбораны получают взаимодействием алкинов с дибораном при 0° С. В этих условиях гидроборирование протекает как син-присоединение. Окислением алкенилборанов из гомологов ацетилена, содержащих концевую тройную связь, получают альдегиды.
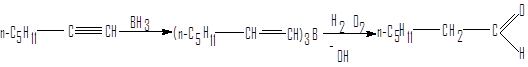
1-гептин гептаналь
Окисление спиртов
Окислением первичных спиртов получают альдегиды.
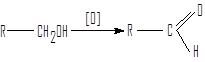
первичный альдегид
спирт
Окисление первичных спиртов требует осторожности, поскольку образующийся на первой стадии альдегид способен к быстрому окислению до карбоновой кислоты. И в этом случае один из наиболее распространенных окислителей пиридинийхлорохромат.
Восстановление хлорангидридов карбоновых кислот
Для получения как алифатических, так и ароматических альдегидов пригодна реакция Розенмунда-Зайцева (А.М.Зайцев, 1873 г.; К.Розенмунд, 1918 г.). Чтобы избежать дальнейшего восстановления формильной группы в продукте реакции, активность катализатора снижают добавкой контактных ядов (фенилизотиоцианат, тиомочевина, 2-меркаптотиазол). Наиболее эффективным каталитическим ядом оказалась тетраметилтиомочевина (ТМТМ).
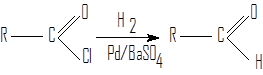
хлорангидрид (ТМТМ) альдегид
Окисление метиларенов триоксидом хрома
В лабораторной практике ароматические альдегиды могут быть получены окислением метиларенов.
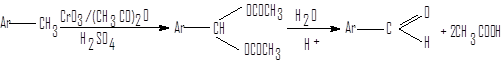
метиларен альдегид уксусная кислота
Гидролиз дигалогенметиларенов
Для этой цели пригоден и гидролиз дигалогенметиларенов. Реакция гидролиза протекает гладко, однако имеет ограниченное применение из-за малой доступности дигалогенметиларенов и представляет препаративный интерес лишь при работе с дихлорметиларенами.
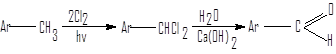
метиларен дихлор- альдегид
метиларен
2.3.Физические свойства и строение альдегидов.
Физические свойства.
Температуры кипения и плавления некоторых альдегидов.
Таблица 1. Физические свойства альдегидов
| Альдегид | Формула | Мол. масса | Т. кип., °С | Т. пл., °С |
|
Бензальдегид Формальдегид Ацетальдегид Пропаналь Бутаналь Пентаналь Гексаналь Гептаналь Октаналь Нонаналь Деканаль |
С6Н5СНО HCHO CH3CHO CH3CH2CHO CH3(CH2)2CHO CH3(CH2)3CHO CH3(CH2)4CHO CH3(CH2)5CHO CH3(CH2)6CHO CH3(CH2)7CHO CH3(CH2)8CHO |
106 30 44 58 72 86 100 114 128 142 156 |
178 -21 21 49 76 103 128 153 171 192 209 |
-26 -92 -123.5 -81 -99 -92 -56 -43 -21 -13 -5 |
Молекулы альдегидов полярны. Поэтому они имеют более высокие температуры кипения, чем неполярные соединения близкой молекулярной массы, однако более низкие, чем соответствующие спирты.
Указанные закономерности изменения температур кипения объясняются тем, что в альдегидах отсутствуют межмолекулярные водородные связи. Вместе с тем альдегиды склонны к межмолекулярной ассоциации за счет диполь-дипольных взаимодействий.
Формальдегид – газ с острым запахом, растворим в воде. Его используют в виде водного раствора, который называют формалином. Низшие альдегиды имеют резкий неприятный запах. Высшие гомологи имеют запах цветов и фруктов. Низшие альдегиды заметно растворимы в воде. Растворимость резко уменьшается, когда число атомов углерода в молекуле равно или более пяти. Ароматические альдегиды бесцветные высококипящие жидкости или твердые соединения, плохо растворимые в воде. Многие ароматические альдегиды обладают резким запахом, часто приятным.
Бензальдегид – бесцветная жидкость с запахом горького миндаля, т. кип. 179.5°С. На воздухе он быстро окисляется в бензойную кислоту. Бензальдегид встречается в природе в виде гликозида амигдалина в масле горьких миндалей, в косточках вишни, абрикоса, персика и т.д. Амигдалин под действием ферментов дает бензальдегид, синильную кислоту и дисахарид генцибиозу. Бензальдегид в промышленности получают каталитическим окислением толуола. Широко применяется в синтезе красителей, лекарств и душистых веществ.
Строение
Молекула простейшего карбонильного соединения – формальдегида имеет плоское строение. Длины связей С=О и С-Н равны соответственно 1,20 и 1,10 Å. Валентный угол Н-С-О равен 121,8°, а угол Н-С-Н – 116,5°.
Электронное строение альдегидов показано ниже также на примере формальдегида.
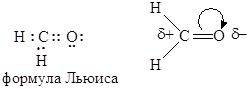
Согласно атомно-орбитальной модели, орбитали обеих НЭП атома кислорода являются sp2 – гибридными и располагаются в плоскости молекулы, т.е. имеют σ-симметрию. Являясь изоэлектронным аналогом этилена, формальдегид отличается значительной полярностью двойной связи вследствие смещения электронов к более электроотрицательному атому атому кислорода.
Анализ альдегидов
Альдегиды характеризуются путем получения производных по карбонильной группе с нуклеофильными реагентами, особенно с производными аммиака.
Для альдегидов характерна легкость их окисления. Альдегиды окисляются холодным разбавленным нейтральным раствором KMnO4 или раствором CrO3 в H2SO4.
Чрезвычайно чувствительной пробой на альдегиды является реакция Шиффа. Альдегиды реагируют с фуксинсернистой кислотой, давая характерное малиновое окрашивание.
Нитрование альдегидов
Альдегиды нитруются при охлаждении концентрированной HNO3 или нитрующей смесью с образованием преимущественно м-нитропроизводных. Так, например, при действии на бензальдегид нитрующей смесью при 5-10°С получается м-нитробензальдегид с выходом около 80% наряду с небольшим количеством орто-изомера. Практически свободный от изомеров м-нитробензальдегид получают действием нитрующей смеси на гидробензамидин.
Действуя азотной кислотой на ароматические альдегиды при низких температурах, удалось получить продукты присоединения, так называемые нитраты альдегидов, которые, будучи внесены в серную кислоту, переходят в нитрозамещенные в ядре альдегиды.
2.4.Реакция Канниццаро
В присутствии концентрированного раствора щелочи альдегиды, не содержащие α-водородных атомов, вступают в реакцию самоокисления – восстановления с образованием смеси спирта и соли карбоновой кислоты. Эта реакция, известная под названием реакции Канниццаро, обычно происходит при взаимодействии альдегида с концентрированным водным или спиртовым раствором щелочи при комнатной температуре (в этих условиях альдегид, содержащий α-водородные атомы, быстрее будет вступать в альдольную конденсацию).
![]()
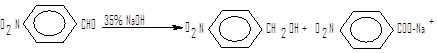
Как правило, смесь двух альдегидов в реакции Канниццаро дает набор всех возможных продуктов. Однако если одним из альдегидов будет формальдегид, то образуется почти исключительно формиат натрия и спирт, соответствующий другому альдегиду.
![]()
Повышенная склонность формальдегида подвергается окислению, делает подобную перекрестную реакцию Канниццаро удобным методом синтеза.
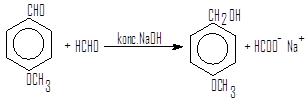
2.5. Реакция электрофильного замещения
Карбонильная группа является электроноакцепторным заместителем, дезактивирует ароматическое кольцо в реакциях электрофильного замещения и направляет электрофильный агент в м-положение:
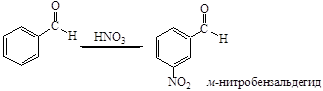
Ароматические альдегиды при хранении легко окисляются до кислот. Окисление ускоряется светом и катализаторами – солями металлов, например железа.
Окисление можно предотвратить добавлением ничтожных количеств ингибиторов – фенолов или аминов.
3.Обсуждение полученных результатов.
Нитрование – единственный метод получения нитробензальдегидов. Но методик нитрования, как способов получения нитробензальдегидов, несколько. Нами найдены две методики получения м-нитробензальдегида:
1)Методика синтеза м-нитробензальдегида путем нитрования бензальдегида смесью нитрата калия и серной кислоты.
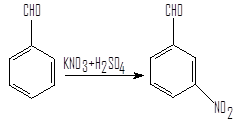
В толстостенном стакане емкостью 1 л, снабженном механической мешалкой и капельной воронкой, растворяют при комнатной температуре 110 г (1,09 моль) нитрата калия и 400 мл концентрированной серной кислоты. Стакан помещают в баню со смесью льда с солью и, при Т=0°С и сильном перемешивании, из капельной воронки медленно приливают 100 г (0,94 моля) бензальдегида, поддерживая температуру 0-5°С. По окончании приливания бензальдегида перемешивание продолжают еще 1,5 часа, и затем густую, окрашенную в оранжевый цвет реакционную массу выливают в стакан емкостью 1 л, содержащий 200 г измельченного льда. Выделившийся осадок промывают на воронке Бюхнера, промывают 200 мл 5%-ного раствора соды и еще несколько раз холодной водой, тщательно отжимают и сушат в вакуум-эксикаторе.
Выход 118 г(82,8 % от теоретич.), т. пл.=58-60°С. Полученный таким образом продукт вполне пригоден для дальнейшей работы. Перекристаллизовывать его можно из бензола или лигроина.
2) Методика синтеза м-нитробензальдегида путем нитрования гидробензамидина смесью моногидрата серной кислоты и азотной кислоты.
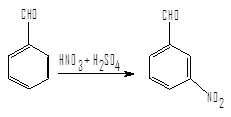
При 10-12 °С вносят небольшими порциями 350 г размолотого в порошок гидробензамидина в 1650 г моногидрата серной кислоты. После полного растворения раствор охлаждают до 0°С и в течение 15 ч прибавляют к нему 930 г нитрующей смеси (30 %HNO3 и 70 % моногидрата серной кислоты) так, чтобы температура реакционной смеси была ниже 15°С. Затем в течении 10-12 ч повышают температуру до 15-18°С и смесь выливают в такое количество льда, чтобы установилась температура 45°С. Через несколько часов остывший раствор фильтруют на воронке Бюхнера и отмывают м-нитробензальдегид от кислот. Выход 450г; т. пл.=58°С. В виде примеси препарат содержит 0,5% орто-изомера.
Из представленных выше методик синтеза м-нитробензальдегида выбираем первую. Исходные соединения, используемые в первой методике (бензальдегид, нитрат калия, серная кислота и сода), более доступны, чем исходные реагенты, требующиеся для второй методики (азотная кислота, моногидрат серной кислоты и гидробензамидин). Наш выбор обусловлен также простотой выполнения эксперимента: проведение синтеза по первой методике требует значительно меньше времени (2 часа), чем проведение синтеза по второй методике (около 30 часов). И, наконец, отметим немаловажный фактор безопасности проведения синтеза по первой методике: нитрующая смесь нитрата калия и серной кислоты, используемая в первой методике, менее опасна, чем нитрующая смесь азотной кислоты и моногидрата серной кислоты, используемая во второй.
Таким образом, из приведенных выше доводов видно, что синтез м-нитробензальдегида путем нитрования бензальдегида смесью нитрата калия и серной кислоты, является для нас оптимальным.
4.Экспериментальная часть
Рассчитываем реагенты на 5 г бензальдегида (по предложению научного руководителя).
4.1.Реагенты и оборудование.
Реагенты.
| Название | Формула |
Молек. масса |
Тпл., °С |
Ткип., °С |
Плотность | Исходное количество веществ | ||
| г | мл | моль | ||||||
| бензальдегид | С7Н6О | 106 | -26 | 178-179 | 1,04 | 5 | 4,8 | 0,048 |
| нитрат калия | КNО3 | 101 | 334 | 400 разл. | 2,11 | 5,5 | 2,6 | 0,054 |
| серная кислота (конц.) | Н2SО4 | 98 | -13,6 | 301,30 | 1,84 | 37 | 20 | 0,37 |
| сода | Na2CO3 | 106 | 852 | разл. | 2,53 | 25,3 | 10 | 0,24 |
Оборудование:1. капельная воронка
2. трехгорлая колба
3. механическая мешалка
4. баня со льдом и солью
5. термометр низких температур
6. воронка Бюхнера
7. колба Бюнзена
8. стакан на 100 мл
4.2.Методика эксперимента.
В трехгорлой колбе, снабженной механической мешалкой и капельной воронкой, растворяем при комнатной температуре 5,5 г (0,054 моль) нитрата калия и 20 мл концентрированной серной кислоты. Колбу помещаем в баню со смесью льда с солью и, при Т=0°С и сильном перемешивании, из капельной воронки медленно приливаем 5 мл (0,048 моль) бензальдегида, поддерживая температуру 0-5°С. По окончании приливания бензальдегида перемешивание продолжаем еще 1,5 часа, и затем густую, окрашенную в оранжевый цвет реакционную массу выливаем в стакан емкостью 100 мл, содержащий измельченный лед. Выделившийся осадок промываем на воронке Бюхнера водой и 10 мл 5%-ного раствора соды и еще несколько раз холодной водой, тщательно отжимаем и сушим. Выход чистого продукта 5,6г (78 % от теоретич.), т.пл.=58-59°С (литер. т. пл. 58-60°С).
5.Вывод.
Путем нитрования бензальдегида мы получили достаточно чистый (т. пл. 58-59°С) м-нитробензальдегид с выходом (78% от теорет.), который вполне пригоден для дальнейшей работы. Выход полученного вещества зависит от чистоты использованных реагентов (С6Н5СНО→С6Н5СООН), а также оттого, что реакция, возможно, прошла не полностью.
6.Библиография.
Книги:
1. Препаративная органическая химия под общей ред. д.х.н. Н.Е.Вульфсон, перевод с польского В.В.Шпанова и В.С.Володиной. 1959г. 888с., с.226-230
2. Топичев А.В. Нитрование углеводородов и других органических соединений. Изд.2-е М., изд-во АНСССР. 1956г. с.47-52
3. Вейганд К., Хильгетаг Г. Методы эксперимента в органической химии. М.: Химия. 1968г. 944с. с. 589-615
4. Синтезы органических препаратов./Сб.2. М.: ИЛ. 1949г. с.366. с.117-125
Доклад.
Данная исследовательская работа проведена для получения м-нитробензальдегида и подробного изучения свойств альдегидов, которые широко используются в промышленности, в органическом синтезе и в других областях.
Альдегидами называют соединения, в которых карбонильная группа связана с двумя атомами водорода и одним углеводородным заместителем.
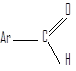
Углеводородные заместители могут быть алифатическими, алициклическими (насыщенными или ненасыщенными) или ароматическими.
Существует несколько лабораторных методов синтеза альдегидов. Некоторые основаны на реакции окисления или восстановления, в которых спирт, углеводород или хлорангидрид превращаются в альдегид с тем же числом атомов углерода. Другие методы включают образование новых углерод-углеродных связей и дают альдегиды с большим числом атомов углерода, чем в исходных веществах.
1.Озонолиз алкенов
Этот способ распространен в лабораторной практике. Он дает особенно хорошие результаты при применении к симметричным алкенам.
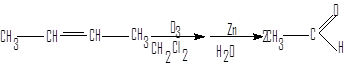
ацетальдегид
2.Гидратация алкинов (реакция Кучерова)
Гидратация ацетилена – один из ранних способов получения ацетальдегида в промышленности.
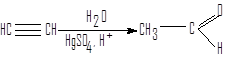
ацетилен ацетальдегид
3.Окисление спиртов
Окислением первичных спиртов получают альдегиды.
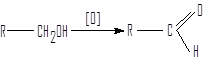
первичный альдегид
спирт
Альдегиды нитруются при охлаждении концентрированной HNO3 или нитрующей смесью с образованием преимущественно м-нитропроизводных. Так, например, при действии на бензальдегид нитрующей смесью при 5-10°С получается м-нитробензальдегид с выходом около 80% наряду с небольшим количеством орто-изомера. Практически свободный от изомеров м-нитробензальдегид получают действием нитрующей смеси на гидробензамидин.
Действуя азотной кислотой на ароматические альдегиды при низких температурах, удалось получить продукты присоединения, так называемые нитраты альдегидов, которые, будучи внесены в серную кислоту, переходят в нитрозамещенные в ядре альдегиды.
Карбонильная группа является электроноакцепторным заместителем, дезактивирует ароматическое кольцо в реакциях электрофильного замещения и направляет электрофильный агент в м-положение:
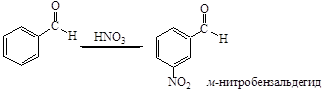
Ароматические альдегиды при хранении легко окисляются до кислот. Окисление ускоряется светом и катализаторами – солями металлов, например железа.
Окисление можно предотвратить добавлением ничтожных количеств ингибиторов – фенолов или аминов.
Нитрование – единственный метод получения нитробензальдегидов. Но методик нитрования, как способов получения нитробензальдегидов, несколько. Нами найдены две методики получения м-нитробензальдегида:
1)Методика синтеза м-нитробензальдегида путем нитрования бензальдегида смесью нитрата калия и серной кислоты.
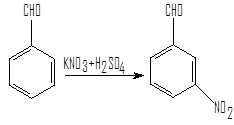
2) Методика синтеза м-нитробензальдегида путем нитрования гидробензамидина смесью моногидрата серной кислоты и азотной кислоты.
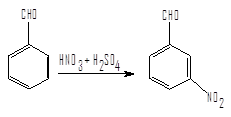
Из представленных выше методик синтеза м-нитробензальдегида выбираем первую. Исходные соединения, используемые в первой методике (бензальдегид, нитрат калия, серная кислота и сода), более доступны, чем исходные реагенты, требующиеся для второй методики (азотная кислота, моногидрат серной кислоты и гидробензамидин). Наш выбор обусловлен также простотой выполнения эксперимента: проведение синтеза по первой методике требует значительно меньше времени (2 часа), чем проведение синтеза по второй методике (около 30 часов). И, наконец, отметим немаловажный фактор безопасности проведения синтеза по первой методике: нитрующая смесь нитрата калия и серной кислоты, используемая в первой методике, менее опасна, чем нитрующая смесь азотной кислоты и моногидрата серной кислоты, используемая во второй.
Таким образом, из приведенных выше доводов видно, что синтез м-нитробензальдегида путем нитрования бензальдегида смесью нитрата калия и серной кислоты, является для нас оптимальным.
Вывод: путем нитрования бензальдегида мы получили достаточно чистый (т. пл.=58-59°С) м-нитробензальдегид с выходом (78% от теорет.), который вполне пригоден для дальнейшей работы. Выход полученного вещества зависит от чистоты использованных реагентов (С6Н5СНО→С6Н5СООН), а также оттого, что реакция, возможно, прошла не полностью.
© 2009 База Рефератов