Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Дослідження антивірусної активності 6-азацитидину та амізону в модельній системі: цитомегаловірус - культура клітин фібробластів легень ембріона людини
Реферат: Дослідження антивірусної активності 6-азацитидину та амізону в модельній системі: цитомегаловірус - культура клітин фібробластів легень ембріона людини
КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ІМЕНІ ТАРАСА ШЕВЧЕНКО
АБДУЛЛАЄВА МАЙЯ ВОЛОДИМИРІВНА
УДК: 578.825.12:578.74[058.86+078.33]:615.281
ДОСЛІДЖЕННЯ АНТИВІРУСНОЇ АКТИВНОСТІ 6-АЗАЦИТИДИНУ ТА АМІЗОНУ В МОДЕЛЬНІЙ СИСТЕМІ: ЦИТОМЕГАЛОВІРУС КУЛЬТУРА КЛІТИН ФІБРОБЛАСТІВ ЛЕГЕНЬ ЕМБРІОНА ЛЮДИНИ
03.00.06 вірусологія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Київ - 2008
Дисертацією є рукопис
Робота виконана в Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського АМН України
Науковий керівник: доктор медичних наук, професор, член-кореспондент НАН та АМН України, РАМН, заслужений діяч науки і техніки України Фролов Аркадій Федорович
Інституту епідеміології та нфекційних хвороб ім. Л.В. Громашевського АМН України, завідувач відділу загальної вірусології
Офіційні опоненти: доктор біологічних наук, професор Руденко Адель Вікторівна Інститут урології АМН України, завідувач лаборатор мікробіології, вірусології та мікології кандидат біологічних наук, старший науковий співробітник Нестерова Надія Віталівна Інститут мікробіолог вірусології ім.Д.К. Заболотного НАН України, завідувач лабораторії репродукц вірусів
Захист дисертації відбудеться “4” березня 2008 р. о 14 год. на засіданн спеціалізованої вченої ради Д 26.001.14 при Київському національному університеті імені Тараса Шевченка за адресою: 03127, м. Київ, пр-т Глушкова 2, корпус 12, аудиторія 434.
Поштова адреса: 01033, м. Київ, вул. Володимирська 64.
З дисертацією можна ознайомитись у бібліотеці Київського національного університету імені Тараса Шевченко за адресою: Україна, 01033, м. Київ, вул. Володимирська, 58.
Автореферат розісланий “ 28” січня 2008 р.
Вчений секретар
спеціалізовано вченої ради О.В. Молчанець
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Цитомегаловірусна інфекція (ЦМВІ) на сьогодн особливо актуальна проблема сучасності. За оцінюючими даними, рівень нфікування цитомегаловірусом, як у cвіті так і у нашій країні становить більше 90% ( Trincado D.E., 2000; Нисевич Л.Л., 2002 та інш.).
Особливо важливе місце ЦМВІ належить у патології плоду, новонароджених і дітей раннього віку. Вона є однією із причин самовільних викиднів, передранніх пологів, вроджених вад розвитку, фетопатій. Небезпечною ЦМВІ є і для реципієнтів органів та кісткового мозку, онкологічних хворих та ВІЛ-інфікованих (Чешик С.Г., 2001).
Широкий спектр клінічних проявів та розповсюдженість ЦМВ серед усіх верств населення, спонукає звернути увагу на своєчасну діагностику ЦМВІ, враховуючи яку, можливо у найкоротший термін скоректувати стратегію лікування для хворих. Найбільш розповсюджені методи виявлення ЦМВ імуноферментний та полімеразної ланцюгово реакції мають ряд недоліків, із яких найбільш значний полягає у складност диференційної діагностики первинної, персистентної чи реактивованої інфекції. Це обгрунтовує використання у світовій лабораторній практиці нових методів ранньої специфічної експрес діагностики ЦМВІ.
Хіміотерапія ЦМВІ є складним і в багатьох випадках не вирішеним завданням. Існуючі хіміотерапевтичн засоби поки не дозволяють досягти повної зупинки продуктивної реплікації ЦМВ. Основні препарати, які специфічно інгібують репродукцію ЦМВ (ганцикловір, валганцикловір, фоскарнет і цидофовір) мають побічні токсичні ефекти (Дзюблик И.В, 1999; DeSmet M.D., 1999). А тривале застосування ганцикловіру у великих дозах викликає формування резистентності до ЦМВ (Mendez J.C, 1999). Крім того, довготривалі курси лікування до цього часу залишаються надзвичайно дорогими при сумнівному ефекті.
Саме тому актуальним питанням дослідження ефективності методів лабораторно діагностики ЦМВІ, які дозволяють встановити форму інфекції та пошуку нових анти-ЦМВ засобів із вивченням механізмів їх дії і було присвячено дану дисертаційну роботу. Даний напрямок досліджень дасть можливість вдосконалити методи діагностики та лікування ЦМВІ.
Зв’язок роботи з науковими програмами, планами, темами. Роботу виконано у відповідності з напрямом наукових досліджень Інституту епідеміолог та інфекційних хвороб ім. Л.В. Громашевського АМН України, лаборатор загальної вірусології, у рамках тематичного плану “Вивчення механізмів епідемічного процесу при грипі та цитомегаловірусній інфекції”, завдань: Цитогенетичні дослідження гострої та персистентної форми ЦМВ-інфекції”, та Вивчення механізмів дії амізону та 6-аzaC на репродукцію ЦМВ in vitro” у 2001-2004 роках (шифр: 084, номер держреєстрації 01.02.U 000631).
Мета задачі дослідження. Мета роботи — дослідження діагностичної цінності методів ранньої лабораторної діагностики ЦМВІ, а також вивчення анти-цитомегаловірусно активності 6-аzaC та амізону.
Для досягнення поставленої в роботі мети передбачалось вирішення наступних задач:
1. Встановити ефективність виявлення ранніх білків ЦМВ швидким культуральним методом та у тесті на виявлення антигенемії;
2. Дослідити можливість диференціац персистентної та гострої форм ЦМВІ за допомогою експресних методів лабораторно діагностики (ШКМ, ІФА, ПЛР, тАГ);
3. Вивчити цитотоксичну дію 6-azaC та амізону в культурі клітин фібробластів легень ембріона людини;
4. Дослідити анти-ЦМВ активність 6-azaC та амізону у дослідах in vitro;
5. Визначити вплив 6-azaC та амізону на синтез ранніх (р72, рр65) та пізніх (gB) вірусних білків в інфікованих клітинах.
Об’єкти дослідження – цитомегаловірус людини АD 169, лейкоцити та сироватки периферичної крові пацієнтів, антивірусні препарати, нфіковані та неінфіковані ЦМВ клітини культури ФЛЕЛ, моноклональні антитіла направлені до р 72, рр 65, gB білків ЦМВ.
Предмет дослідження – імунні комплекси антиген-антитіло, репродукція ЦМВ, цитотоксичність та анти-ЦМВ активність 6-azaC та амізону.
Методи дослідження – для виконання поставлених завдань використовували вірусологічні, молекулярно-біологічні та імунологічні методи, а також методи статистичної обробки результатів.
Наукова новизна одержаних результатів. Показано високу діагностичну цінність швидкого культурального методу, який підтверджує у 65% новонароджених і дітей раннього віку і у 70% хворих після трансплантації нирки - гостру форму ЦМВІ. Показано, що за допомогою тесту на виявлення антигенем за 3-4 год. можливо виявити ранні білки вірусу і встановити форму перебігу ЦМВІ. Вперше встановлено анти-ЦМВ активність 6-аzaC та амізону in vitro, що дає змогу розглядати їх, як перспективні проти-ЦМВ агенти. Доведено, що механізм дії цих засобів полягає в інгібіції ситезу пізнього структурного білку gB.
Практичне значення одержаних результатів. Отримані дані експериментально доводять високу ефективність застосування швидкого культурального методу та тесту на виявлення антигенемії, що дозволяє віддиференціювати гостру і персистентну форми ЦМВІ. За результатами досліджень було створено проект: “Модифікація застосування швидкого культурального методу, як нової технології діагностики цитомегаловірусної інфекції” за №76/4 від 29.10.04 р. у напрямі: “Діагностика методи лікування найпоширеніших захворювань”. Результати можуть бути використані в розробці методичних рекомендацій по діагностиці ЦМВІ у новонароджених та дітей раннього віку, а також у хворих після трансплантац органів чи тканин. Виявлена і підтверджена в дослідах анти-ЦМВ активність 6-azaC і амізону обґрунтовує необхідність наступних етапів оцінки препаратів, які можуть бути використані для клінічного впровадження, як нові проти-ЦМВ засоби. Результати даних досліджень відображені в деклараційних патентах: на винахід - №69986 А “Інгібітор цитомегаловірусу людини 2-b-D- рибофуранозил –5- аміно-1,2,4 – триазин –3 (2Н)- ОН”, на корисну модель - 10889 “Застосування 4-(N-бензил)амінокарбонілу –1-метилпіридинію йодиду як профілактичного інгібітора цитомегаловірусної інфекції людини”.
Особистий внесок здобувача. Автором самостійно проаналізована наукова література по темі дисертації. Основний об’єм експериментальної роботи, обробка та аналіз отриманих результатів, формулювання висновків дисертаційно роботи виконана пошукачем особисто. Здобувачем самостійно проаналізовано одержаний експериментальний матеріал, який викладений автором у ряді статей у фахових виданнях та тезах доповідей на вітчизняних та міжнародних конференціях. Планування основних напрямків досліджень дисертаційної роботи, обговорення отриманих результатів та їх узагальнення здійснені під керівництвом д.мед.н, професора, чл.-кор. НАН та АМН України, РАМН, заслуженого діяча науки і техніки України Фролова Аркадія Федоровича.
При проведенні даних досліджень автор використовувала моноклональні антитіла до білків ЦМВ, які були отримані раніше у відділі клітинної інженерії Науково дослідного інституту вірусології РАМН, с.н.с., к.б.н. Макаровою Н.Е..
Значну частину досліджень виконано на базі лабораторії клітинної інженерії Науково дослідного інституту вірусології РАМН, Москва (д.б.н., проф. Кущ А.А., к.б.н. Федорова Н.Е.), лабораторії контролю якості імунобіологічних препаратів Інституту епідеміології та інфекційних хвороб ім. Л.В. Громашевського АМН України (д.мед.н. Рибалко С.Л., к.б.н. Дядюн С.Т.). Автор засвідчує глибоку повагу та щиру вдячність за співпрацю, корисні поради та сприяння у виконанні роботи.
Апробація результатів дисертації. Результати досліджень, які увійшли в дисертаційну роботу, доповідались і апробовані на семінарах відділу загально вірусології Інституту епідеміології та інфекційних хвороб АМН України та відділу клітинної інженерії Науково дослідного інституту вірусології ім. Д.І. Івановського РАМН, ХI Російському національному конгресі “Человек и лекарство (Москва, Росія, 2004); Х з’їзді Товариства мікробіологів України (Одеса, 2004); IV Міжнародній конференції “Біоресурси і віруси” (Київ, 2004); XIV з’їзд мікробіологів, епідеміологів та паразитологів (Полтава, 2005).
За матеріалами дисертаційних досліджень було створено науково-технічний проект 76/4: “Модифікація і застосування швидкого культурального методу, як ново технології діагностики цитомегаловірусної інфекції людини” (Київ, 2004), за конкурсом автор отримав “Відзнаку” від Київської міської держадміністрації.
Публікації. За матеріалами дисертації опубліковано 9 наукових праці, в тому числі, 3 статті у провідних фахових журналах, 2 патенти України на винаходи та 4 тези доповідей на наукових конференціях.
Обсяг структура дисертації. Дисертація складається із вступу, огляду літератури, методів і об’єктів досліджень, експериментальної частини, аналізу й узагальнення результатів, висновків, списку використаних джерел та додатків. Робота викладена на 125 сторінках основного тексту, містить 5 таблиць, 17 рисунків. Список використаних джерел включає 265 робіт вітчизняних та іноземних авторів.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Огляд літератури складається із чотирьох розділів, в яких докладно викладено сучасні уявлення про структуру та біологічну активність ЦМВ, його роль в інфекційній патології людини, огляду сучасних методів лабораторно діагностики ЦМВ та ідеології профілактики та лікування ЦМВ-інфекції.
Матеріали та методи дослідженнь. У роботі використано цитомегаловірус людини (референс-штам ЦМВ AD 169) люб'язно наданий доктором L. Pereira (Медичний Центр, Університет Сан-Франциско, США). У дослідах використовували первинну культуру клітин ФЛЕЛ (фібробластів легень ембріона людини), яка входить до Каталогу Європейської колекції культур клітин. Культивування культури клітин ФЛЕЛ проводили використовуючи такі поживні середовища, як Ігла ДМЕМ, Ігла МЕМ, з використанням розчину Версену та Хенксу виробництва фірми Панеко” (Росія) та Хімопсину фірми “Самсон-Мед” (Росія). Як стимулятор росту використовували ембріональної телячу сироватка виробництва фірми “Hy Clone (США) чи “Biowest” (Франція) та пуповинну сироватку людини виробництва фірми Панеко” (Росія). Дослiджували лімфоцити та сироватки периферичної крові від 50 дітей віком від одного дня до першого року життя, що перебували на лікуванні у Центрі корекції розвитку дітей раннього віку та від 17 реципієнтів нирки, що знаходились на лікуванні у Науково-дослідному інституті трансплантології та штучних органів.
При дослідженнях використовували буферні розчини: 0.01 М фосфатно-сольовий буфер рН 7,5, який містить 0,1 М NaCl, 0,025M KCl, 0,025M KH2PO4, 0,036M Na2HPO4x12H2O; 0,005 М розчин Трис- HCl рН 7,4, який містить 0,1 М Na Cl та оригінальні очищені МКА до білків р72, рр65, gВ ЦМВ, що були отримані Макаровою Н.Е. в НДІ вірусології ім. Д.І. Івановського РАМН, у робочих розведеннях 1:100. Як контроль використовували комерційні діагностичні МКА фірми “Ortho” (США). Як кон'югат використовували поліклональні кролячі анти-мишачі імуноглобуліни, мічені пероксидазою хрону DakoCytomation” (Данія) у робочому розведенні 1:100. Як субстрат використовували диамінобензидин “Bioscinces” (США) в концентрації 10 млг DAВ розведеного в 20 мл 0,005 М розчині буферу ТРИС рН 7.4 з додаванням 20 мкл 30% перекису водню (розрахунок на один планшет). При проведенні досліджень використовували комерційні тест-системи “Enzygnost Anti-CMV/Ig” фірми Behring та ELISa фірми “HUMAN” Німеччина, для визначення специфічних антитіл класів М G у сироватках крові до ЦМВ методом ІФА.
ДНК ЦМВ в зразках сироваток крові дітей та реципієнтів нирки виявляли за допомогою реактивів набору ЦИТОПОЛ (ТУ-9398-428-17253567-01) виробництва ТОВ НПФ "Літех" Москва і ТОВ НПФ "ГЕНтех" Москва. ІФА та ПЛР у цих випадках та облік результатів здійснювали відповідно до інструкцій фірм-виробників.
Антигенвмісні включення у клітинах ЦМВ виявляли методом імуноцитохімічного забарвлення (кількісний варіант), досліджуючи препарати лейкоцитів периферичної крові хворих, забарвлених МКА до рр65.
Антивірусну дію 6-azaC чи 2-ß-Д-рибофуранозил-5-аміно-1,2,4-триазин-3(2Н)-ОН (Інститут молекулярної біології і генетики НАН України) та амізону чи 4-(N-бензил)амінокарбоніл-1-метилпіридиній йодид (Інститут фармаколог токсикології АМН України) щодо ЦМВ вивчали за методичними рекомендаціями (Щербинська А.М., Дяченко Н.С., Рибалко С.Л. та інш., 2000 ). Як контрольний препарат застосовували ганцикловір “Roche” (Швейцарія). Антивірусні сполуки досліджували в системі in vitro у трьох схемах: 1. терапевтична (робочі концентрац вносились після 24 г. інфікування клітин); 2. профілактична (робоч концентраціях вносились за 24 год. до інфікування клітин); 3. профілактична накопичувальна (робочі концентрації вносились за 48, 24 та 1 год. до нфікування клітин). Отримані дані виражали графічно у вигляді дозозалежно кривої, за допомогою якої визначали 50% ефективну дозу (ЕD50), що зменшує кількість сформованих включень у клітинах на 50%. В результаті проведених досліджень визначали цитотоксичну дозу (CD50), ефективну дозу (ED50) та індекс селективності (IS) досліджуваних сполук, який розраховували за формулою: ІS = CD50 / ED50.
Результати були оброблені статистично за допомогою ком’ютерної програми Microsoft Excel-2000.
Виявлення ранніх білків ЦМВ за допомогою методів експрес діагностики. На першому етапі досліджень виявляли антиген ЦМВ у 50 новонароджених та дітей раннього віку. Дослідження проводили двома методами – швидким культуральним та ІФА, використовуючи лейкоцитарні фракції та сироватки крові отримані від дітей. Відповідно до класифікації клінічних проявів ЦМВІ, немовлят було розділено на дві групи. До першої - віднесли 23 дитини з клінічними симптомами перинатального інфікування ЦМВІ. До другої групи віднесли 27 дітей, яким діагноз ЦМВІ неонатологами та педіатрами поставлено не було.
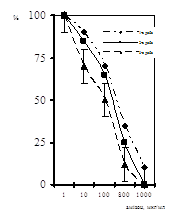
Визначення класів Ig показало, що 96+0,82% зразків сироваток крові дітей 1-ої групи містили IgG, у той час, як у дітей 2-ої групи вони були зафіксовані у 59+0,49% обстежених (рис. 1). Найбільшу зацікавленість представили результати виявлення анти-ЦМВ IgМ, які розглядались як показник початкової стадії або гострої форми інфекції. IgМ були виявлені в сироватках крові 17+0,47% дітей з клінічними ознаками та у 22+0,51% дітей без клінічних ознак ЦМВІ (p<0,05). Швидким культуральним методом у дітей першої групи антиген ЦМВ було виявлено у 17 осіб, що складало 74%. Тоді як у дітей другої групи антиген ЦМВ виявлено не було. Останн свідчить про високий рівень безсимптомних форм цитомегаловірусної інфекції, спостерігається навіть у її гострій формі.
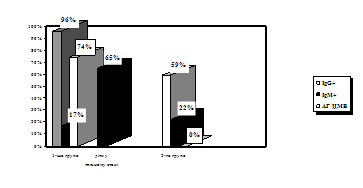
Рис. 1. Виявлення маркерів ЦМВ ІФА та ШКМ у крові дітей раннього віку
Проведене нами порівняння результатів 2-х лабораторних методів, що використовувались для діагностики ЦМВІ у обох групах дітей раннього віку, показало, що у обстежених дітей 1-ої групи (з клінічними ознаками ЦМВІ) IgМ та антиген ЦМВ одночасно було виявленj швидким культуральним методом у 3-х випадках, що складало 13+0,47% (табл. 1). Наявність у сироватках дітей цієї групи імуноглобулінів класу G супроводжувалося виявленням антигену ЦМВ швидким культуральним методом у 15 дітей (65%). У дітей другої групи (без клінічних ознак ЦМВІ) IgM було виявлено у 6 осіб, що сладало 22+0,47%, а IgG у 12 осіб, що складало 59+0,49%, тоді як антиген ЦМВ швидким культуральним методом виявлено не було (табл. 2). Одночасно IgG та IgM у дітей 2-ої групи було виявлено у 4 осіб, що складало 15+0,81% від загальної кількості дітей у групі.
Таблиця 1
Порівняльне дослідження виявлення ЦМВ у крові немовлят та дітей раннього віку з клінічними проявами ЦМВІ ІФА та ШКМ
|
№ п/п лейкоцитарних фракцій крові |
Імуноферментний метод ELISa фірми “HUMAN” |
Швидкий культуральний Метод |
|
| Anti-CMV/IgG | Anti-CMV/Ig M | p 72 + pp 65 | |
|
середнє значення оптичної густини *(ОО), (M+m) |
середнє значення оптичної густини *(ОО), (M+m) |
кількість антиген вмісних клітин на 2х105 клітин ФЛЕЛ |
|
| 1 | 0,300+0,04 | 0 | 1 |
| 2 | 0,313+0,009 | 0 | 2 |
| 3 | 0,500+0,015 | 0 | 2 |
| 4 | 0,805+0,02 | 0,313+0,009 | 3 |
| 5 | 0,298+0,009 | 0 | 2 |
| 6 | 0,529+0,02 | 0 | 4 |
| 7 | 0,368+0,01 | 0 | 0 |
| 8 | 0 | 0 | 1 |
| 9 | 0,400+0,012 | 0 | 2 |
| 10 | 0,300+0,009 | 0 | 0 |
| 11 | 0,300+0,009 | 0 | 2 |
| 12 | 0,800+0,02 | 0,744+0,02 | 4 |
| 13 | 0,700+0,02 | 0 | 5 |
| 14 | 0,800+0,2 | 0 | 0 |
| 15 | 0,500+0,015 | 0 | 0 |
| 16 | 1,496+0,04 | 0 | 4 |
| 17 | 1,020+0,03 | 0,320+0,009 | 6 |
| 18 | 1,110+0,03 | 0 | 5 |
| 19 | 1,617+0,05 | 0 | 4 |
| 20 | 0,300+0,009 | 0 | 2 |
| 21 | 1,580+0,05 | 0,450+0,01 | 0 |
| 22 | 0,600+0,012 | 0 | 5 |
| 23 | 1,230+0,036 | 0 | 0 |
| Позитивний результат |
1>0,250 ОО |
2>0,250 ОО |
> 1 клітини |
Примітки:
1. 1,2 Значення позитивного результату вираховували згідно інструкції виробоника тест-системи;
2. *О/О – оптичні одиниці
Таблиця 2
Порівняльне дослідження виявлення ЦМВ у крові немовлят та дітей раннього віку без клінічних проявів ЦМВ-інфекції ІФА та ШКМ
|
№ п/п Лейко лейко них фракцій крові
|
Імуноферментний метод ELISa фірми “HUMAN” |
Швидкий культуральний метод |
|
| Anti-CMV/Ig G | Anti-CMV/Ig М | p72 + pp65 | |
|
середнє значення оптичної густини *(ОО), (M+m) |
середнє значення оптичної густини *(ОО), (M+m) |
кількість антиген-вмісних клітин на 2х105 клітин ФЛЕЛ |
|
| 1 | 0,397+0,01 | 0,190+0,006 | 0 |
| 2 | 0,36 +0,01 | 0 | 0 |
| 3 | 0,340+0,01 | 0 | 0 |
| 4 | 0 | 0 | 0 |
| 5 | 0 | 0 | 0 |
| 6 | 0 | 0 | 0 |
| 7 | 0,650+0,02 | 0 | 0 |
| 8 | 0 | 0 | 0 |
| 9 | 0,620+0,02 | 0 | 0 |
| 10 | 0,556+0,016 | 0,345+0,01 | 0 |
| 11 | 1,403+0,04 | 0 | 0 |
| 12 | 0,335+0,01 | 0 | 0 |
| 13 | 0,316+0,01 | 0 | 0 |
| 14 | 0,637+0,019 | 0,340+0,01 | 0 |
| 15 | 2,098+0,06 | 0,440+0,01 | 0 |
| 16 | 0,868+0,03 | 0 | 0 |
| 17 | 0 | 0 | 0 |
| 18 | 0 | 0 | 0 |
| 19 | 0 | 0,550 +0,02 | 0 |
| 20 | 0 | 0 | 0 |
| 21 | 0 | 0 | 0 |
| 22 | 0,516+0,02 | 0 | 0 |
| 23 | 1,570+0,05 | 0 | 0 |
| 24 | 2,445+0,07 | 0 | 0 |
| 25 | 0 | 0 | 0 |
| 26 | 0,699+0,02 | 0 | 0 |
| 27 | 0 | 0,300+0,009 | 0 |
| Позитивний результат |
1>0,250 ОО |
2>0,250 ОО |
> 1 клітини |
Примітки:
1. 1,2 Значення позитивного результату вираховували згідно інструкції виробоника тест-системи;
2. *О/О – оптичні одиниці
Підсумовуючи отримані дані можна заключити, що метод ІФА для визначення анти-ЦМВ АТ не є надійним методом для діагностики ЦМВІ у немовлят і дітей раннього віку; швидкий культуральний метод у 65% немовлят та дітей раннього віку виявляє ранні білки ЦМВ, що підтверджу гостру форму ЦМВІ.
Детекція раннього білку рр 65 ЦМВ у тесті на виявлення антигенемії. Наступним етапом нашої роботи було адаптувати та застосувати експрес-тест на виявлення антигенемії у клітинах крові людини та порівняти ефективність даного методу з ШКМ та методом ПЛР.
Проведена нами адаптація даного тесту, на відміну від відомого “Clonab CMV HCMV pp 65-Antigen” фірми Biotest (Німеччина), рунтувалась на виявленні раннього антигену у лейкоцитах крові людини за допомогою оригінальних моноклональних антитіл та спрямована на спрощення, прискорення і здешевлення даної методики. У результаті проведених досліджень, нами було запропоновано:
- застосовувати предметні скельця з полілізиновим покриттям (найбільш ефективні для отримання препаратів розпластаних клітин);
- використовувати оптимальну концентрацію лейкоцитів 2х105 на препарат при об’ємі суспензії 0,20 – 0,25 мл;
- ефективним режимом для цитоцентрифугування є – 1500 об/хв, 7 хв;
- оптимальна концентрація оригінальних очищених моноклональних антитіл, для ефективного та специфічного застосування повинна складати - 1: 100.
У результаті запропонованих змін в тест зберігалась більша кількість морфологічно цілих лейкоцитів, а комплекс АГ-АТ, що виявлявся за допомогою методу пероксидазного зафарбування, мав чіткий колір та контури.
Для дослідження діагностичної ефективност тесту на виявлення антигенемії ми відібрали групу хворих, що складалась із 17 пацієнтів після трансплантації нирки. Лiмфоцитарні фракції та сироватки хворих досліджували на наявність вірусних антигенів трьома методами: за допомогою тесту на виявлення антигенемії, швидкого культурального методу та полімеразно ланцюгової реакції (табл. 3). Досліди проводились у трьох повторах.
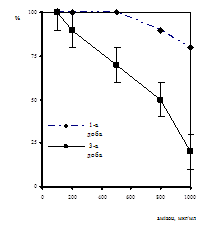
При порівнянні отриманих результатів встановлено, що методом ПЛР (якісний) у всіх 17-ти пацієнтів (100%) було виявлено ДНК ЦМВ (рис. 2). Дослідження лейкоцитів цієї групи хворих швидким культуральним методом виявило, що у 12 хворих (70%) було виявлено антиген ЦМВ, за допомогою тесту на виявлення антигенемії у лiмфоцитах крові, наявність раннього білку рр65 до ЦМВ було показано у 5-ти хворих (30%), при чому ці хворі мали клінічно виражені симптоми ЦМВІ знаходились на гемодіалізі. Ідентичність результатів, отриманих ШКМ та у тест на виявлення антигенемії спостерігалась у 10 хворих (59%) із них 5 позитивних та 5 негативних (рис. 3).
Таблиця 3
Порівняння результатів виявлення маркерів ЦМВ у крові паціентів після трансплантації нирки методами: тАГ, ШКМ та ПЛР
|
№ п/п лейкоцитарних фракцій сироваток |
Методи обстеження | ||
| ШКМ in vitro | тАГ | ПЛР | |
| антиген-позитивних клітин | антиген-позитивних клітин | ДНК | |
| 1 | - | - | + |
| 2 | - | - | + |
| 3 | 4 | - | + |
| 4 | - | - | + |
| 5 | 2 | - | + |
| 6 | - | - | + |
| 7 | 2 | - | + |
| 8 | 4 | - | + |
| 9 | 14 | - | + |
| 10 | 3 | - | + |
| 11 | 16 | 12 | + |
| 12 | 9 | 10 | + |
| 13 | 7 | 9 | + |
| 14 | 1 | - | + |
| 15 | 8 | 6 | + |
| 16 | 1 | 1 | + |
| 17 | - | - | + |
Примітка:
1. “+” - позитивний результат;
2. -“ - негативний результат.
У 12 хворих співпадав позитивний результат при діагностиці ШКМ та ПЛР, що складало 70% (рис. 3). Трьома методами однакові результати було отримано тільки у 5-ти випадках, що складало 30%. Швидкий культуральний метод та метод прямо детекції АГ у 5-ти випадках виявляв кількість антиген-позитивних клітин, що супроводжувалось наявністю клінічних симптомів у хворих і може характеризувати нфекцію як гостру, в наслідок реактивації персистентної інфекції (усі пацієнти приймали раніше анти-ЦМВ терапію). У 5-ти інших хворих ШКМ та методом детекц антигенемії ЦМВ виділено не було, а ДНК методом ПЛР виявлялось. Це також пояснюється тим, що метод ПЛР є дуже чутливим, і виявляє ДНК вірусу навіть коли нфекція перебуває у персистентній формі.
Аналіз результатів дозволяє зробити висновок, що отримані нами дані вказують на високу ступінь співпадання результатів тесту на виявлення антигенемії та швидкого культурального методу, а також клінічними проявами ЦМВІ. Висока чутливість тесту на виявлення антигенемії дає можливість швидко діагностувати гостру форму ЦМВІ у пацієнтів після трансплантації нирки, до того ж антигенемія може бути виявлена протягом 3-4 год.
Таким чином, отримані дані по виявленню ранніх білків ЦМВ за допомогою нових швидких діагностичних методів показали їх діагностичну цінність і дозволяють застосовувати їх у медичних закладах. Ефективність швидкого культурального методу становила 70% у хворих після трансплантації нирки.
Дослідження антивірусної активності 6-аzaC. Вивчали цитотоксичність 6-azaC у культурі ФЛЕЛ за дією на життєздатність клітин використовуючи барвник трипановий синій. Було встановлено, що на 3-ю добу культивування клітин з 6-azaC у концентраціях від 50000 мкг/мл до 30000 мкг/мл життєздатних клітин у дослідах не спостерігалось. У присутності 6-azaC у концентрації 26000 мкг/мл кількість життєздатних клітин складала - 20% від контролю клітин, а при концентрації 20000 мкг/мл - 80%. 6-azaC у концентрації 10000 мкг/мл виявляв незначну цитотоксичну дію, кількість життєздатних клітин складала - 95%. Нижч концентрації 6-azaC на життєздатність клітин протягом 3-х діб культивування не впливали. Отримані результати представлені на рис. 4. Життєздатність клітин у 100% зберігалася протягом 7-и діб у присутності у концентрації 2000 мкг/мл, протягом 10-и діб при концентраціях речовини 500 мкг/мл – 100 мкг/мл. Розрахунки зроблені за графіком показали, що цитотоксична доза (СD50) 6-azaC, тобто така, що не спричиняла незворотніх змін у морфології та життєздатності клітин на 3-ю добу складала – 24000 мкг/мл.
Дослідження цитотоксичної дії 6-azaC на синтез ДНК клітин ФЛЕЛ показало, що у контрольній культурі через 1 добу 30% клітин перебували у стадії синтезу ДНК. У процес культивування кількість мічених клітин у контрольній культурі поступово знижувалася. Через 3-и доби кількість мічених клітин складала 12%.
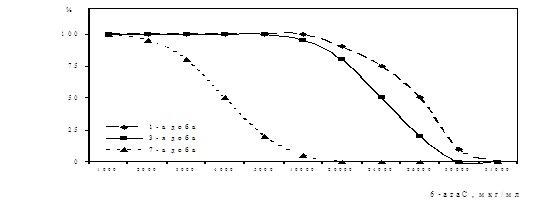
Рис. 4. Цитотоксичний вплив 6-azaC на кількість життєздатних клітин ФЛЕЛ
по осі ординат- % життєздатних клітин від контролю клітин,
по осі абсцис – концентрація 6-azaC, мкг/мл
У культурі, обробленій 6-azaC концентраціями від 12000 мкг/мл до 240 мкг/мл, число клітин, із пригніченим синтезом ДНК через 1 добу незначно відрізнялось від контролю (рис. 5). Однак, через 3 доби число клітин, що синтезували ДНК, знизилось щодо контрольної популяції на 50% у присутності 2400 мкг/мл 6-azaC, а при концентрації 24000 мкг/мл практично на 100%. Отримані дані показують, що на 3-ю добу 50% зниження числа клітин, що синтезують ДНК, відбувалося при концентрації 6-azaC - 2400 мкг/мл.
Таким чином, було встановлено, що концентрація препарату що на 50% пригнічувала синтез ДНК і на 50% інгібувала приріст клітин (CD50) для 6-azaC становила - 2400 мкг/мл, і виявилася значно нижче концентрації, що впливала на життєздатність клітин – 24000 мкг/мл.
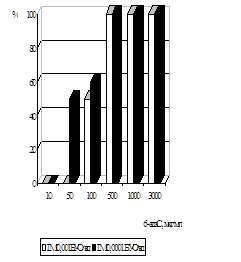
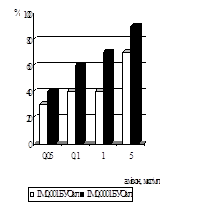
Дослідження антивірусної активності 6-azaC показало, що у терапевтичній схемі використання 6-azaC у концентраціях від 500 мкг/мл до 300 мкг/мл призводили до 100% пригнічення розвитку ЦПД вірусу при нфекційній множинності (ІМ) 0,001 БУО/кл і 0,0001БУО/кл. Аналіз дозозалежност дії 6-azaC показав, що 50% ефективна доза (ЕD50) при ІМ 0,001 БУО/кл складає 100 мкг/мл, при ІМ 0,0001 БУО/кл - 50 мкг/мл (рис. 6). При концентрац 6-azaC 10 мкг/мл і нижче інгібуючого ефекту не спостерігалось. ІS для 6-azaC у терапевтичній схемі при ІМ 0,001 БУО/кл складав 24, а при ІМ 0,0001БУО/кл – 48.
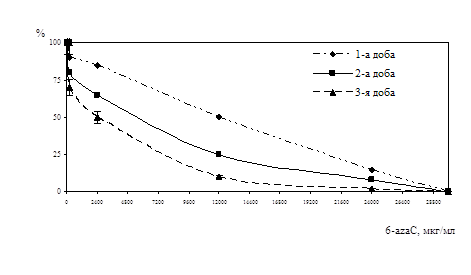 |
Рис. 5. Цитотоксична дія 6-azaC на пригнічення синтезу ДНК клітин ФЛЕЛ
по осі ординат- % від контролю клітин, що синтезують ДНК,
по осі абсцис – концентрація 6-azaC, мкг/мл.
При дослідженні впливу 6-azaC на розвиток вірусної ЦПД у профілактичній схемі було встановлено, що при ІМ 0,0001 БУО/кл концентрації 10мкг/мл і 100 мкг/мл призводили до пригнічення вірусоспецифічної ЦПД на 70%, при 1000 мкг/мл - на 90%, при ІМ 0,001 БУО/кл концентрація 10 мкг/мл пригнічувала ЦПД вірусу на 13%, 100 мкг/мл і 1000 мкг/мл - на 30% і 33% відповідно (рис. 7).
Вивчення антивірусної дії 6-azaC показало, що препарат ефективно пригнічує репродукцію ЦМВ у культурі клітин при профілактичній схемі застосування. Було встановлено, що інгібуюча доза ED70, що відповідає концентрації 6-azaC, при якій спостерігалося 70% пригнічення утворення включень ЦМВ, становила 10 мкг/мл. ІS даного засобу при ІМ 0,0001 БУО/кл складав 240.
|
|
|
|
Рис. 6. Анти-ЦМВ активність 6-azaC у терапевтичній схемі по ос ординат- % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація 6-azaC, мкг/мл |
Рис. 7. Анти-ЦМВ активність 6-azaC у профілактичній схемі. по ос ординат- % пригнічення формування включень від контролю вірусу, по ос абсцис – концентрація 6-azaC, мкг/мл |
Дослідження впливу 6-azaC на синтез вірусних білків показав, що у концентраціях 100 мкг/мл і 1000 мкг/мл число клітин інфікованих ЦМВ, що містили білки р72 і рр65 у присутності сполуки 6-azaC практично не відрізнялось як від контрольної популяції клітин, так і від культури, обробленої ганцикловіром.
Структурний білок gВ ![]() був зареєстрований
у 2,5% клітин контрольної культури через три доби після зараження, у той час як
у клітинах оброблених 6-azaC у концентраціях 1000 мкг/мл і 3000 мкг/мл
кількість клітин, що ситезували gВ складало 1% і 0,5% відповідно. Максимальне
розходження результатів у числі клітин, що синтезували gВ, було відзначено на
п’яту добу після зараження, коли число клітин, що містили вірусний білок у
необробленій популяції було у 10 разів більше, ніж у досліді. Під дією 6-azaC
ганцикловіру нагромадження пізнього структурного білку gВ було знижено
приблизно однаковою мірою.
був зареєстрований
у 2,5% клітин контрольної культури через три доби після зараження, у той час як
у клітинах оброблених 6-azaC у концентраціях 1000 мкг/мл і 3000 мкг/мл
кількість клітин, що ситезували gВ складало 1% і 0,5% відповідно. Максимальне
розходження результатів у числі клітин, що синтезували gВ, було відзначено на
п’яту добу після зараження, коли число клітин, що містили вірусний білок у
необробленій популяції було у 10 разів більше, ніж у досліді. Під дією 6-azaC
ганцикловіру нагромадження пізнього структурного білку gВ було знижено
приблизно однаковою мірою.
Таким чином було встановлено, що (СD50) 6-azaC, що не спричиняла незворотніх змін у морфології та життєздатност клітин на 3-ю добу складала – 24000 мкг/мл, а концентрація препарату що на 50% пригнічувала синтез ДНК (CD50) становила - 2400 мкг/мл. 50% ефективна доза (ЕD50) у терапевтичній схемі застосування при ІМ 0,001 БУО/кл відповідала 100 мкг/мл, при ІМ 0,0001 БУО/кл – ED50 - 50 мкг/мл. Індекс селективності (ІS) для 6-azaC в залежності від множинності інфікування складав 48-240.
Оцінка анти-ЦМВ активності амізону. Цитотоксичність амізону за дією на життєздатність клітин вивчали використовуючи сполуку у концентраціях 0,1 мкг/мл - 1000 мкг/мл. Протягом першої доби культивування амізон виявляв незначну цитотоксичну дію (рис. 8). На 3-ю добу культивування при концентрації амізону 1000 мкг/мл спостерігалася загибель 80% клітин. У присутності препарату амізон у концентрації 800 мкг/мл кількість життєздатних клітин становила 50% від загального числа клітин, а при концентрації 500 мкг/мл - 70%. Амізон у концентрації 200 мкг/мл виявляв незначну цитотоксичну дію, кількість нежиттєздатних клітин становила менше 10%. У нижчих концентраціях цитотоксичної дії препарату не спостерігалось. Цитотоксична доза (СD50), яка зменшувала кількість життєздатних клітин для амізону становила 800 мкг/мл.
Дію амізону на синтез ДНК клітин ФЛЕЛ з використанням методу мічення клітинної ДНК, досліджували в концентраціях 1 мкг/мл, 10 мкг/мл, 100 мкг/мл, 800 мкг/мл та 1000 мкг/мл (рис. 9). Підрахунок клітин, що містили ³Н-ТД-мітку, показав, що у культурі, не обробленій амізоном, через добу 30% клітин перебували у стадії синтезу ДНК. У процесі культивування кількість мічених клітин у контрольній культурі поступово знижувалась. Через три доби їх кількість становила 12%. У культурі, обробленій амізоном у концентраціях від 1 мкг/мл до 10 мкг/мл, число клітин, що містили ³Н-ТД-мітку, через добу культивування незначно відрізнялось від контролю. При концентраціях препарату 100 мкг/мл та 800 мкг/мл число мічених клітин щодо контролю становило 60% і 30% відповідно. Через три доби число клітин, що синтезують ДНК, знизилось щодо контрольно популяції на 50% у присутності 100 мкг/мл амізону, при концентрації 800 мкг/мл на 100%. Таким чином, отримані дані показали, що на 3-ю добу 50% зниження числа клітин, що синтезують ДНК (CD50), відбувається при концентрації амізону 100 мкг/мл.
|
|
|
|
Рис. 8. Цитотоксичний вплив амізону на кількість життєздатних клітин ФЛЕЛ по ос ординат- % життєздатних клітин від контролю клітин, по ос абсцис – концентрація амізону, мкг/мл |
Рис. 9. Цитотоксична дія амізону на пригнічення синтезу ДНК клітин ФЛЕЛ по ос ординат - % віл контролю клітин, що синтезують ДНК, по ос ординат- концентрація амізону, мкг/мл |
Крім того, вивчали приріст клітин у контрольній і дослідній культурах. Для цього проводили підрахунок числа клітин на одиницю площі. Через три доби культивування відбувалося зменшення числа клітин на 50% щодо контрольної популяції при концентрац амізону 100 мкг/мл. Таким чином, концентрація препарату, що пригнічувала синтез ДНК на 50% та інгібувала приріст клітин на 50% для амізону складала 100 мкг/мл, виявилася значно нижче концентрації, що впливала на життєздатність клітин – 800 мкг/мл.
Дослідження анти-ЦМВ активності амізону у терапевтичній схемі досліджували у концентраціях 10 мкг/мл, 5 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,1 мкг/мл та при ІМ вірусу 0,001 БУО/кл та 0,0001 БУО/кл. Ні при одній із досліджуваних концентрацій амізону та нфекційній множинності вірусу препарат не виявляв інгібуючої активност відносно ЦМВ.
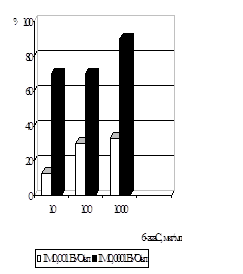
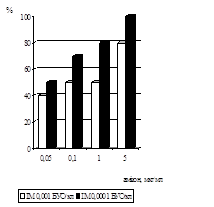
Дослідження впливу амізону на репродукції ЦМВ у профілактичній схемі було вивчено в присутності препарату у концентраціях 5 мкг/мл, 1 мкг/мл, 0,1 мкг/мл, 0,05 мкг/мл, з ІМ вірусу 0,0001 БУО/кл й 0,001 БУО/кл (рис. 10). Присутність амізону у концентрації 5 мкг/мл при зараженні ЦМВ з ІМ 0,0001 БУО/кл приводила до пригнічення вірусоспецифічної ЦПД через 5 діб на 90%, з ІМ 0,001 БУО/кл - на 70%. Амізон у концентрації 1 мкг/мл інгібував здатність вірусу до утворення антигенвмісних включень при ІМ 0,0001 БУО/кл на 70%, при ІМ 0,001 БУО/кл на 40%. Зменшення цитопатичної дії ЦМВ із ІМ 0,0001 БУО/кл було виявлено при концентрації 0,1 мкг/мл на 60%, із ІМ 0,001 БУО/кл - на 40%. Амізон у концентрації 0,05 мкг/мл інгібував здатність вірусу до утворення антигенвмісних включень при ІМ 0,0001 БУО/кл на 40% та при ІМ 0,001 БУО/кл на 30%.
Вплив амізону на розвиток ЦМВІ у клітинах ФЛЕЛ було вивчено також при використанні накопичувальної профілактичної схеми (рис. 11). Для цього препарат у концентраціях сполуки 5 мкг/мл, 1 мкг/мл, 0,1 мкг/мл, 0,05 мкг/мл та 0,001 мкг/мл тричі вносили у культуру клітин - за 48 год., за 24 год. і за 1 год. до внесення вірусу (ІМ 0,001 БУО/кл і 0,0001 БУО/кл). Дослідження концентрацій сполуки показало, що ефективна доза (ЕD50) зменшується до 10% при вивченні усіх концентрацій амізону у порівнянн з ЕD50 ЦМВ у звичайній профілактичній схемі.
Таким чином, вивчення антивірусної д амізону показало, що препарат ефективно пригнічував розвиток ЦМВІ у культур клітин при профілактичній схемі застосування. Було встановлено, що цитотоксична доза (CD50), що відповідає концентрації амізону, при якій спостерігалося 50% інгібування ЦПД ЦМВ, із ІМ 0,001 БУО/кл становила 1 мкг/мл, а з ІМ 0,0001 БУО/кл - 0,1 мкг/мл, IS в залежності від інфекційної множинност складав 100 – 1000.
|
|
|
|
Рис. 10. Анти-ЦМВ активність амізону у профілактичній схемі по ос ординат - % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація амізону, мкг/мл |
Рис.11. Анти-ЦМВ активність амізону у профілактичній накопичувальній схемі по ос ординат - % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація амізону, мкг/мл |
Результати дослідження дії амізону на синтез ЦМВ білків при ІМ 0,001 БУО/кл. показали, що протягом трьох діб спостереження число клітин, що містили білки р72 і рр 65 у культурі, попередньо обробленій амізоном, практично не відрізнялось як від контрольної популяц клітин, так і від культури, обробленої ганцикловіром. Кількість клітин, що містила структурний вірусний білок gВ, у контролі та у досліді вірогідно не відрізнялась протягом перших двох діб. Через три доби після зараження вірусний білок gВ у контрольній культурі був визначений у 2,5% клітин. У клітинах, оброблених амізоном, кількість клітин, що містили gВ, становила 0,5%. На п’яту добу після зараження спостерігалось найбільше розходження між контрольною дослідною культурами у кількості клітин, зафарбованих МКА до gВ. Так, число клітин, що синтезують gВ у культурі, обробленій aмізоном, ганцикловіром і у контрольній культурах склало 3%, 1,8% і 10%, відповідно. Таким чином, на п’яту добу після зараження, під дією aмізону накопичення пізнього структурного білку gВ було знижено приблизно у 3 рази щодо контрольної популяції. Таким чином, амізон пригнічував синтез пізніх структурних білків, продукція яких залежить від реплікації вірусної ДНК.
ВИСНОВКИ
У дисертаційній робот представлено вирішення актуального наукового завдання щодо удосконалення ранньої лабораторної діагностики цитомегаловірусної інфекції та визначення нових вітчизняних хіміотерапевтичних засобів, що володіють противірусними властивостями.
1. Показано високу діагностичну цінність застосування методу культур клітин ФЛЕЛ у лабораторній діагностиці, який дозволяє протягом 24 год. виявляти ранні білки (р72 та рр65) ЦМВ і цим підтвердити розвиток гострої форми ЦМВІ у 65%-70% обстежених хворих.
2. Доведено ефективність виявлення у лейкоцитах крові раннього білку ЦМВ рр65, за допомогою моноклональних антитіл, як маркеру активації ЦМВІ на прикладі хворих після трансплантації нирки.
3. Встановлено активність 6-аzaC проти ЦМВ та визначено критерії цієї активації: цитотоксичну дозу (CD50), по дії на ДНК - 2400 мкг/мл, ефективну дозу (ED50) - 50 мкг/мл та індекс селективності (IS) 48.
4. Встановлено активність амізону проти ЦМВ та визначено критерії цієї активації: цитотоксичну дозу (CD50) по дії на ДНК - 100 мкг/мл, ЕD50 (1 мкг/мл), IS (100).
5. Доведено, що механізм антивірусної д 6-azaC та амізону проявляється пригніченням синтезу пізнього структурного білку ЦМВ – gВ. Вивчені препарати не впливають на синтез ранніх білків р72 та рр65.
СПИСОК НАУКОВИХ РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Абдуллаєва М.В., Фролов А.Ф., Федорова Н.Е., Меджидова М.Г., Адуева С.М., Дегтярьова М.В., Воронцова Ю.Н., Алямовская Г.А., Кешищан Е.С., Кущ А.А. Лабораторна діагностика цитомегаловірусної інфекції у дітей раннього віку: порівняльний аналіз ефективності серологічного, швидкого культурального методів і полімеразно ланцюгової реакції // Вісник Київського національного університету імені Тараса Шевченка. – 2005.- N 44. - С. 4-6.
2. Абдуллаєва М.В., Фролов А.Ф., Алексеева И.В., Пальчиковская Л.И., Федорова Н.Е. Ингибирующее действие 6 - азацитидина на цитомегаловирусную инфекцию в клеточной системе // Біополімери клітина. - 2004. - Т. 20, N 4. - С. 337-343.
3. Меджидова М.Г., Абдуллаева М.В., Федорова Н.Е., Романова В.С., Кущ А.А. Противовирусная активность аминокислотных производных фулерена при цитомегаловирусной инфекции in vitro // Антибиотики и химиотерапия. Москва. – 2004. – N 49, - С. 8-9.
4. Деклараційний патент на винахід UA N 69986 А “Інгібітор цитомегаловірусу людини 2-(-D- рибофуранозил –5- аміно-1,2,4 триазин –3 (2Н)- ОН”. Абдуллаєва М.В., Кущ А. О., Федорова Н.Е., Фролов А.Ф., Алексеєва І.В., Пальчиківська Л.Г., Шаламай А.С., 2004 р., 2 с.
5. Деклараційний патент на корисну модель UA N 10889 “Застосування 4-(N-бензил)амінокарбонілу –1-метилпіридинію йодиду як профілактичного інгібітора цитомегаловірусної інфекції людини”. Абдуллаева М.В., Фролов А.Ф., Даниленко В.П., Бухтіарова Т.А., Федорова Н.Е., Кущ А.А., 2005 р., 3 с.
6. Абдуллаєва М.В., Меджидова М.Г., Баранова Ф.С., Федорова Н.Е., Кущ А.А. Використання швидкого культурального методу та прямого виявлення рр65 цитомегаловірусу в клітинах крові трансплантаційних хворих для встановлення активної форми цитомегаловірусної інфекції // Тези доповідей Х з’їзду мікробіологів України. Одеса. - 2004, - С. 349.
7. Абдуллаева М.В., Фролов А.Ф., Даниленко В.Ф, Фёдорова Н.Е., Кущ А.А. Подавление амизоном цитомегаловирусной инфекции в клеточной системе // Тезисы докладов ХІ Российского национального конгресса “Человек и лекарство”. Москва. - 2004, - С. 415.
8. Абдуллаева М.В., Фролов А.Ф., Меджидова М.Г., Федорова Н.Е., Кущ А.А. Выявление анти-ЦМВ антител и прямых маркеров цитомегаловируса у детей раннего возраста // Тези IV Міжнародно конференція “Біоресурси і віруси”. Київ. - 2004, - С. 45.
9. Абдуллаева М.В., Фролов А.Ф., Даниленко В.Ф, Фёдорова Н.Е., Кущ А.А. Амізон, як інгібітор синтезу білків цитомегаловірусу людини in vitro. / Тези XIV з’їзду мікробіологів, епідеміологів та паразитологів. Полтава. - 2005, - С. 155.
АНОТАЦIЯ
Абдуллаєва М.В. Дослідження антивірусної активності 6-азацитидину та амізону у модельній системі: цитомегаловірус – культура клітин фібробластів легень ембріона людини. - Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.06 вірусологія. — Київський національний університет імені Тараса Шевченка, Київ, 2008. Дисертація присвячена дослідженню ефективності методів ранньо лабораторної діагностики ЦМВ-інфекції, обгрунтуванню ефективності застосування монолональних антитіл, вивченню цитотоксичності та анти-ЦМВ активності 6-аzaC амізону, з точки зору їх здатності безпосередньо пригнічувати репродукцію ЦМВ. Виявлено здатність оригінальних моноклональних антитіла до раннього білку рр65 ЦМВ, застосованих у методі прямої детекції антигену виявляти антиген-позитивн комплекси безпосередньо у лейкоцитах людини in situ. Проведена оцінка ефективності ранніх лабораторних методів діагностики цитомегаловірусно нфекції. Встановлено високу діагностичну цінність швидкого культурального методу, який підтверджує у 65% дітей раннього віку гостру форму ЦМВ-інфекції із клінічними симптомами. Показано, що порівняльна характеристика діагностичних методів дозволяє віддиференціювати гостру і персистентну форми ЦМВ-інфекції у новонароджених та дітей раннього віку. Визначено параметри цитотоксичності: для 6-аzaC СD50 становить 2400 мкг/мл, для амізону СD50 складає 100 мкг/мл. 6-аzaC і амізон мають чітку анти-ЦМВ дію. При профілактичному та терапевтичному використанні ІS для 6-azaC становив 48, для амізону при профілактичному застосуванні ІS складав 100. Антивірусна дія вивчених засобів зумовлена інгібіцією трансляції пізніх білків. Це да можливість розглядати вказані сполуки як перспективні протицитомегаловірусн засоби, що вимагає подальшого вивчення їх дії.Ключові слова: моноколнальн антитіла, білки р72, рр65, gB, 6-azaC, ЦМВ-інфекція, антигенемія, швидкий культуральний метод, амізон, токсичність, антивірусна дія.
АННОТАЦИЯ
Абдуллаєва М.В. Исследование антивирусной активности 6-азацитидина и амизона в модельной системе: цитомегаловирус - культура клеток фибробластов лёгких эмбриона человека. — Рукопись.
Диссертация на соискание научной степени кандидата биологических наук по специальности 03.00.06 — вирусология. — Киевский национальный университет имени Тараса Шевченкo. Киев, 2008.
Диссертация посвящена исследованию эффективности методов ранней лабораторной диагностики ЦМВ-инфекции, обоснованию эффективности применения в ней монолональных антител, изучению цитотоксичности и анти-ЦМВ активности 6-аzaC и амизона, с точки зрения их способности непосредственно подавлять репродукцию ЦМВ.
Показана способность оригинальных моноклональных антител к раннему белку рр65 ЦМВ, примененных в методе прямого определения антигена, выявлять антиген-позитивные комплексы непосредственно в лейкоцитах человека.
Проведенна оценка эффективности ранних лабораторных методов диагностики ЦМВ-инфекции. Установлена высокая диагностическая ценность быстрого культурального метода, который подтверждает острую форму ЦМВ-инфекции у 65% детей раннего возраста с клиническими симптомами.
Показано, что сравнительная характеристика диагностических методов позволяет отдифференцировать острую и персистентну формы ЦМВ-инфекции у новорожденных и детей раннего возраста.
Определены параметры цитотоксичности для 6-аzaC СD50 составляет 2400 мкг/мл, для амизона - 100 мкг/мл. 6-аzaC и амизон имеют четкое анти-ЦМВ действие. При профилактическом и терапевтическом использовании IS для 6-azaC составлял 48, для амизона – 100.
Антивирусное действие исследованных соединений обусловлено ингибированием трансляции поздних белков. Это дает возможность рассматривать их как перспективные противоцитомегаловирусные средства и требует дальнейшего изучения.
Ключевые слова: моноколнальные антитела, белки р72, рр65, gB, 6-аzaC, ЦМВ-инфекция, антигенемия, быстрый культуральный метод, амизон, токсичность, антивирусное действие.
SUMMARY
Abdullaуeva M.V. Research on the anti-virus activity of 6 - -azacitidin and amizon in the model system: Cytomegalovirus-tissue culture fibroblast of human embryonic lung. Manuscript.
Thesis requirement for the degree of Doctor of Philosophy in Biology, specialities 03.00.06 – virology. Taras Shevchenko National University of Kyiv. Kyiv, 2008.
This thesis is dedicated to the research of efficient methods for the early laboratory diagnostics of CMV-infection and the basis of efficiency of application of monoсlonal antibodies, to the study of cytotoxic and anti-CMV activity of 6-azatsitidin and amizon from the perspective of their ability to directly to repress CMV reproduction.
The capacity of original monoclonal antibodies for the early albumen pp65 CMV is shown. Applied is the method of direct determination of antigen by exposing antigen-positive complexes directly to human leucocytes in situ.
Estimation of efficiency of early laboratory methods of diagnostics of CMV-infection. The high diagnostic value of a rapid culture method which confirms the acute form of CMV-infection of 65% children of early age with clinical symptoms is determined.
Comparative description of diagnostic methods demonstrates different acute and persistent forms of CMV-infection in newborns and children of early age.
The parameters of cytotoxicity are definite for 6-azaC CD50 makes 2400 mcg/ml, for amizon - 100 mcg/ml. 6-azaC and amizon is clear anti-CMV activity. At the prophylactic and therapeutic use IS for 6-azaC is 48 and for amizon 100.
Anti-virus action of the explored connections is conditioned to ingibition translation of late albumens. It enables to consider them as perspective anti-CMV facilities and requires further study.
Keywords: monoclonal antibodies, albumens p72, pp65, gB, 6-azaC, CMV-infection, antigenemiya, shell vaill method, amizon, cytotoxic, anti-virus activity.
© 2009 База Рефератов