
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Липидный эпидермальный барьер
Реферат: Липидный эпидермальный барьер
Реферативная работа студента 2 курса группы №42 Русина Ильи.
Московская медицинская академия им. Сеченова
Москва, 2008
Введение
Кожа человека выполняет множество жизненно важных функций. Занимая пограничное положение между организмом и внешней средой, она защищает его от вредных внешних воздействий, высыхания, проникновения частиц грязи, микроорганизмов, токсинов, а также является сенсорным органом, который отвечает за температурную, тактильную и болевую чувствительность. Кроме всего прочего, кожа как внешняя оболочка организма играет исключительно важную роль во взаимоотношениях людей.
Эпидермальный барьер – это собирательное название, подчеркивающее одну из основных функций эпидермиса – быть преградой на пути проникновения различных соединений, бактериальных и вирусных частиц в организм и из него. До 70-х годов XX века познания о составе и физиологии кожных покровов накапливались медленно. С внедрением в экспериментальную медицину биофизических и биохимических методов исследования удалось узнать многое о микроскопическом строении эпидермиса и рогового слоя, приоткрыть тайну о взаимоотношениях клеток и слоёв кожи, изучить влияние и методы проникновения различных экзогенных веществ через эпидермальный барьер.
С начала 80-х годов в дерматологии появились сведения о структурном и количественном состоянии липидов кожи в норме и патологии, пересматривались основные представления о роговом слое как о пассивном механическом барьере. Систематическое нарушение целостности барьерного слоя может привести к развитию хронических кожных заболеваний. И наоборот, вещества, способные взаимодействовать с липидными структурами рогового слоя и восстанавливать его целостность, могут использоваться при лечении большого спектра кожных заболеваний.
В начале XXI века исследования перешли на новый этап. Исследователи задались вопросом: «Как можно использовать данные о строении липидного барьера кожи для трансдермальной доставки лекарственных веществ, вакцин. Данные исследования могут иметь и обратную сторону – какие вещества и методы защиты можно разработать для защиты от возможных ядов, способных проходить через кожный барьер.
Морфологическое описание
Анатомия кожи.
Кожа (integumentum commune, cutis) покрывает всю поверхность тела, переходя в слизистую оболочку в области естественных отверстий рта, носа, мочеполовых органов и заднего прохода. Поверхность кожи у взрослого человека достигает 1,5—2 м2. Соединительными тяжами (retinaeula cutis) кожа прикрепляется к подлежащей фасции. Толщина кожи без подкожной жировой клетчатки составляет 0,5—4 мм. Толщина подкожножировой клетчатки колеблется в более широких пределах. У взрослого нормально развитого человека вес кожи составляет около 5% веса тела. (1)
На поверхности кожи имеются многочисленные складки, углубления, возвышения, то нежные, то более грубые бороздки. Бороздки делят поверхность кожи на ряд полей, большей частью треугольной или ромбической формы. К грубым бороздкам кожи относятся морщины на лице, складки ладоней, складки мошонки и бороздки на разгибательных поверхностях сочленений.
Гистология кожи.
Кожа состоит из двух различных по своему строению и развитию частей: наружной части эктодермального происхождения, представленной эпидермисом (epidermis), и внутренней мезодермального происхождения — соединительнотканной основы.
Внутренняя часть делится на два слоя:
средний собственно кожа (cutis propria, derma) и
самый глубокий слой — «подкожно-жировой (subcutis, hypoderma).
Эпидермис образован многослойным плоским ороговевающим эпителием (epithelium stratificatum squamosum cornificatum), который покрывает поверхность кожи. В нём проходит процесс ороговения (кератинизации), связанный с дифференцировкой эпителиальных клеток - кератиноцитов в роговые чешуйки наружного слоя эпидермиса. Дифференцировка кератиноцитов проявляется в их структурных изменениях в связи с синтезом и накоплением в цитоплазме специфических белков цитокератинов (кислых и щелочных), филлагрина, кератолинина и др. В эпидермисе различают несколько слоёв клеток – базальный, шиповатый, зернистый, блестящий и роговой. (1)
Роговой слой состоит из корнеоцитов — мертвых клеток, шестиугольных пластинок, заполненных фибриллярным белком кератином и аморфным веществом, и образующих роговые «чешуйки» толщиной 0.2–0.4 μм и ≈40 μм в диаметре. Корнеоциты – это прошедшие все этапы миграции (шиповатый, зернистый и блестящий слои) потомки базальных кератиноцитов. Корнеоциты соединены между собой корнеодесмосомами, связывающими клетки в прочную сеть. Непроницаемым роговой слой делает липидный матрикс, в который «погружены» корнеоциты; он состоит в основном из церамидов, холестерина и жирных кислот, образующих систему мультиламеллярных бислоев. Ниже находится слой живых эпидермальных клеток и слой дермы, пронизанной капиллярами, способными «разнести» проникшее через барьер вещество по всему организму.
Клеточная мембрана керотиноцитов в верхних слоях зернистого слоя становится прерывистой, а потом исчезает. Вместо неё остаётся белково-липидная структура – роговой конверт, ядро и органеллы исчезают. И с этого момента начинается слой роговых чешуек.
На границе зернистого слоя и слоя роговых чешуек липиды выходят из клеток и заполняют межклеточное пространство. Всё это напоминает торт «Наполеон» - липиды склеиваются в роговые чешуйки, как заварной крем склеивает коржи торта. В зарубежных публикациях такую модель рогового слоя называют «brick and mortar» - кирпич и цемент (3). Липидная прослойка эпидермиса играет исключительно важную роль в коже, так как именно она делает роговой слой водонепроницаемым. Благодаря липидной прослойке роговой слой становится проницаемым только для липофильных веществ.
Липиды эпидермиса
В роговом слое есть две разновидности липидов:
липиды кожного сала, располагающиеся на поверхности кожи и в верхних слоях рогового слоя;
эпидермальные липиды, которые обнаруживаются в средней и нижней части рогового слоя;
Согласно исследованиям, скорость секреции кожного сала не изменяется при обезжиривании кожи, а также кожа маленьких детей, почти не вырабатывающая кожного сала, не обезвоживается. Таким образом, единственным стимулом сальных желёз являются андрогены. (2)
В состав липидов рогового слоя входят церамиды[1] , холестерин и сульфат холестерина. Они формируют в роговом слое упорядоченные структуры. Было обнаружено, что в липидном матриксе присутствуют как структурированные участки, где существует гексагональная или орторомбическая упаковка молекул («кристаллическая фаза»), так и неструктурированные участки («жидкокристаллическая фаза»). Таким образом, прежняя модель «brick and mortar» претерпела дальнейшие усложнения и превратилась в доменно-мозаичную модель. И в такой модели каждая разновидность церамидов рогового слоя играет свою роль в формировании липидного барьера – от формирования жёстких водонепроницаемых участков церамидами с короткими насыщенными цепями, так и формирования гибких, текучих участков, которые допускают ограниченную диффузию водорастворимых веществ.
Таким образом, липидный барьер имеет определённое строение, структуру. Данная структура чем-то напоминает «стёганное одеяло» - липидные слои прошиты длинными цепями О-ацилцерамидов. Такие же сшивки существуют и между белково-липидными оболочками корнеоцитов и липидными пластами. При нарушении данной структуры барьер перестаёт частично или полностью справляться со своей задачей. (3)
Например, особенно важную роль в роговом слое играют О-ацилцерамиды (содержат линолевую кислоту). Недостаток в организме линолевой и линоленовой кислоты, она заменяется на олеиновую. Построение протяжённых и непрерывных липидных пластов становится невозможным (нет «сшивки»). В роговой слой попадают разрозненные липидные пузырьки. Изменяется не только проницаемость, но и нарушается нормальная дифференцировка кератиноцитов. Клинически это проявляется сухостью, шелушением, зудом и покраснением кожи.
Сквозь барьер
Абсорбция веществ, нанесённых на кожу - процесс пассивный, зависящий от физико-химических свойств рассматриваемого активного ингредиента, свойств рогового слоя в данном участке и от внешних факторов. Среди физико-химических факторов:
Липофильность и заряд;
Размер молекулы или частицы – не более 3 кДа, остальные не проходят через роговой слой вообще и остаются на поверхности;
Связывание со структурными компонентами кожи – если вещество будет соединяться со структурными компонентами корнеоцитов, скорость диффузии будет уменьшаться;
Основа, в которой находится рассматриваемое вещество (способность образовывать окклюзивный слой, поверхностная активность, термодинамическая активность, pH);
Что же касается свойств рогового слоя в разных участках тела человека – в июле 2006 года в журнале PLoS Genetics (4) были опубликованы результаты исследования, проведенного группой ученых с медицинского факультета Стэнфорда. В качестве объекта изучения были взяты фибробласты — основные клетки соединительной ткани, у которых определяли активность 337 генов. Было изучено 47 популяций фибробластов с 43 участков тела. Оказалось, что гены проявляют себя по-разному в зависимости от локализации клеток в организме. Но если разница между фибробластом, находящимся в соединительнотканной перегородке альвеол в легких, и фибробластом кожи не вызывает удивления, то разница в генной активности между дермальными фибробластами, расположенными на разных участках (например, предплечье и голень, заставляет призадуматься. В свете этих исследований стоит по-новому взглянуть на проблему создания дерматотропных препаратов с сигнальной активностью для кожи на разных частях нашего тела.
Интересы для медицины
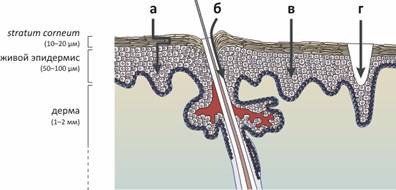
Рисунок 1. Методы трансдермальной доставки лекарств. Рисунок из (4).
Методы трансдермальной доставки, применяемые в данное время:
Извилистый» путь трансдермальной диффузии может быть облегчен с помощью химических энхансеров — веществ, сравнительно легко преодолевающих липидный барьер и «увлекающих» за собой молекулы доставляемого лекарства. Примером химических энхансеров могут быть липофильные ингредиенты (жирные кислоты, спирты), гидрофильные вещества (гликоли), поверхностно-активные вещества;
Низковольтный ионофорез облегчает проникновение веществ трансфолликулярным путем — через волосяные фолликулы и протоки потовых желез.
Высоковольтная электропорация временно дестабилизирует липидные бислои, «приоткрывая» дверь доставляемому веществу. Сонофорез (ультразвук) дополнительно может увеличить эффективность путей переноса А и В.
Микроиглы и термопорация создают в коже отверстия микронного размера, через которые может осуществляться транспорт. Из-за малости отверстий, эти процедуры безболезненны, а сами отверстия очень быстро затягиваются.
Биологический мир буквально наполнен наночастицами — это ферменты, молекулы ДНК и РНК, рибосомы, клеточные везикулы, вирусы и пр. Отличительной особенностью таких объектов является их способность к агрегации и самоорганизации. Это свойство активно используется при создании искусственных конструкций, имитирующих реальные биологические структуры. Яркий пример представляют собой различные однокомпонентные и мультикомпонентные липосомы, которые способны при определенных условиях формироваться из раствора смеси липидов. Часто на практике используют и уже существующие в природе биологические наночастицы. Например, различные вирусы активно применяют для генной модификации (трансфекции) клеток. Показано, что аденовирусы с подавленной системой репликации могут быть эффективно использованы и для местной неинвазивной вакцинации через кожу (доставке антигенов к клеткам Лангерганса, присутствующим в коже).
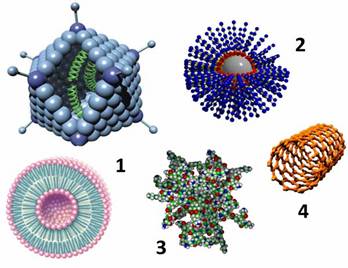
Рисунок 2. 1 — липосома и аденовирус; 2 — полимерная наноструктура; 3 — дендример; 4 — углеродная нанотрубка. Рисунок из (4).
Также к ним относят липидные нанотрубки, наночастицы и наноэмульсии, циклические пептиды, хитозаны, наночастицы на основе нуклеиновых кислот.
Полимерные материалы обладают рядом преимуществ, определяющих эффективность их применения в технологиях доставки, — биосовместимость, способность к биодеградации, функциональная совместимость. Типичными соединениями, которые представляют основу для создания ПнЧ, являются полимолочная и полигликолевая кислоты, полиэтиленгликоль (ПЭГ), поликапралактон и др., а также их различные сополимеры. ПЭГ часто используют для повышения стабильности различных молекулярных переносчиков. Например, липосомы, покрытые ПЭГ («стелс-липосомы»), по сравнению с обычными, менее подвержены биодеградации, в результате чего обладают заметным пролонгированным действием.
Дендримеры являются уникальным классом полимеров с сильно разветвлённой структурой. При этом их размер и форма могут быть очень точно заданы при химическом синтезе. Дендримеры получают из мономеров, проводя последовательные конвергентную и дивергентную полимеризации (в том числе используя методы пептидного синтеза). Типичными «мономерами», используемыми в синтезе дендримеров, являются полиамидоамин (ПАМАМ) и аминокислота лизин. «Целевые» молекулы связываются с дендримерами либо путём образования комплексов с их поверхностью, либо встраиваясь глубоко между их отдельными цепями. Контролируемые размеры и свойства поверхности, а также стабильность дендримеров делают их весьма перспективными для использования в качестве переносчиков. На животных моделях показана эффективность их применения для трансдермальной доставки ряда препаратов.
Нанотрубки и фуллерены являются одними из самых «узнаваемых» наноструктур — практически ни один популярный текст про нанотехнологии не обходится без их изображений. За открытие этой новой формы существования углерода Р. Керл, Р. Смолли и Г. Крото в 1996 г. были удостоены Нобелевской премии по химии. Эти структуры, образованные только атомами углерода, сегодня в промышленных масштабах получают термическим распылением углеродсодержащей сажи в атмосфере инертного газа при пониженном давлении в присутствии катализатора. Нанотрубки обладают повышенным сродством к липидным структурам; при этом они способны образовывать стабильные комплексы с пептидами и ДНК-олигонуклеотидами, и даже инкапсулировать эти молекулы. Это определяет их применение в области создания эффективных систем доставки вакцин и генетического материала.
Неорганические наночастицы. К этому классу обычно относят наноструктуры, полученные на основании оксида кремния, а также различных металлов (золото, серебро, платина). При этом часто такая наночастица имеет кремниевое ядро и внешнюю оболочку, сформированную атомами металла. Использование металлов позволяет создавать переносчики, обладающие рядом уникальных свойств. Так, их активность (и в частности, высвобождение терапевтического агента) может быть модулирована термическим воздействием (инфракрасное излучение), а также изменением магнитного поля (возможность адресной доставки). При этом показано, что металлические наночастицы могут эффективно проникать вглубь эпидермиса.
Использование описанных выше наночастиц в медицине позволит не только эффективно доставлять биологически активные молекулы сквозь различные барьеры организма, которые они не способны преодолевать самостоятельно (кожный, гематоэнцефалический), но и существенно изменять характер действия препарата. Например, трансдермальная доставка, по сравнению с доставкой через кровяное русло, позволяет избежать нежелательных побочных эффектов, снизить эффективную дозу препарата за счет существенного повышения его локальной концентрации. Кроме того, было показано, что у терапевтических молекул, доставляемых в организм с помощью наночастиц, меняется фармакокинетика. Если для препаратов, попадающих в организм перорально или в результате инъекции, увеличение концентрации во времени описывается характерной кинетической кривой первого порядка (концентрация экспоненциально увеличивается во времени), то в случае использования наночастиц наблюдается идеальная временная зависимость нулевого порядка (равномерное увеличение концентрации препарата во времени). Это позволяет более точно планировать дозировки препарата и пролонгировать его действие.
Клинические проявления
Псориаз
Псориаз - одно из самых часто встречающихся хронических кожных заболеваний и одно из самых загадочных. Несмотря на большие успехи в изучении псориаза, причина его по-прежнему остается неизвестной. Частота заболевания псориазом в разных странах варьируется от 0,1 до 7%. В России им страдает около 2% населения. Долгое время считалось, что псориаз является одной из форм проказы, и лишь к концу XIX столетия была установлена его абсолютная самостоятельность. Псориаз сопровождается появлением на ней ярко-розовых высыпаний с обильным шелушением на их поверхности. Обычно очаги псориаза возникают на локтях и на коленях. На этих местах высыпания могут сохраняться даже тогда, когда в результате лечения они исчезают на других участках кожи. Помимо локтей и коленей в процесс очень часто вовлекается волосистая часть головы. При этом волосы не изменяются и не выпадают.
Суть псориаза состоит в том, что клетки кожи больного начинают созревать и, соответственно, отмирать гораздо быстрее, чем это происходит у здорового человека. Так, если нормальный цикл созревания клеток поверхностных участков кожи составляет от 24 до 28 дней, то при псориазе это время сокращается до 4-5 дней. Изменения в состоянии кожи обычно сопровождаются нарушением кальциевого обмена в организме. В частности, у больных псориазом отмечается снижение содержания витамина D. Провоцирующими моментами могут являться нервно-психические факторы (стресс), травмы кожи, применение некоторых медикаментов (чаще антибиотиков), злоупотребление алкоголем, инфекционные заболевания (вызванные стрептококком, вирусами) и др.
Изменения иммунной системы при псориазе выявлены как на клеточном, так и на гуморальном уровне и заключаются в изменении содержания иммуноглобулинов основных классов, циркулирующих иммунных комплексов, пула лимфоцитов в периферической крови, В- и Т-популяций и субпопуляций лимфоцитов, клеток-киллеров, фагоцитарной активности сегментоядерных лейкоцитов.
Считается, что первичные изменения при псориазе происходят на уровне клеток как дермального слоя, так и эпидермиса. Нарушения регуляции в клетках дермы вызывают избыточную пролиферацию в основном нормального эпидермиса. Гиперпролиферация кератиноцитов приводит к секреции цитокинов и эйкозаноидов, которые обостряют кожное воспаление. В очагах поражения эпидермиса клетки, презентирующие антиген, продуцируют интерлейкин-1 (ИЛ-1). Вероятно, ИЛ-1 идентичен фактору активации Т-лимфоцитов эпидермиса (ETAF), который продуцируется кератиноцитами и активирует лимфоциты тимуса. ИЛ-1 обусловливает хемотаксис Т-лимфоцитов и за счет стимулирования их миграции в эпидермис может отвечать за инфильтрацию эпидермиса этими клетками. Интерлейкины и интерфероны, продуцируемые Т-лимфоцитами, сами могут быть медиаторами в процессах гиперпролиферации кератиноцитов, а также медиаторами воспаления и таким образом способствуют поддержанию порочного круга, который определяет хронический характер псориаза. (7)
Различают два типа псориаза. Псориаз I типа связан с системой HLA-антигенов (главного комплекса гистосовместимости тканей). Среди больных псориазом этот тип выявляется у 65%, причем заболевание у них начинается в молодом возрасте (18-25 лет). Псориаз II типа не связан с системой HLA-антигенов и возникает в более старшем возрасте.
Главной целью лечения псориаза является достижение такого состояния, которое приемлемо для конкретного больного. Из-за хронического течения и непредсказуемой природы заболевания ясный прогноз дать нелегко. В большинстве случаев, однако, псориаз протекает в легкой форме, затрагивая ограниченные участки кожи. В тяжелых случаях болезнь затрагивает социальные аспекты, появляются проблемы в семейной жизни, на работе и при общении с окружающими.
Основными патологическими процессами при псориазе являются гиперплазия эпидермиса с нарушением дифференцировки эпителиоцитов и воспалительная реакция в дерме. В соответствии с этим все методы патогенетической терапии в настоящее время направлены на подавление пролиферации эпителиоцитов, нормализацию нарушений дифференцировки эпителиоцитов, устранение воспалительного процесса.
Существует более 700 разнообразных методов лечения псориаза, появление нового метода лечения или медикамента не означает, что этот метод или медикамент лучше, чем применявшиеся ранее для терапии псориаза. Результаты научных исследований последних лет показывают, что пусковыми моментами для возникновения псориатических высыпаний могут быть инфекционные заболевания (часто псориаз начинается после тяжелых простудных состояний - ангин, гриппа и т.д.), различные травмы, повреждения кожи, нервно-эмоциональные стрессы, резкие изменения климата, прием некоторых лекарственных препаратов. Доказана также наследственная предрасположенность к псориазу.
В последние годы установлено, что нарушения иммунитета, особенно его клеточного звена, являются ведущим механизмом в развитии псориаза, особенно псориаза I типа. Современные исследователи определяют псориаз как системную болезнь, в патогенезе которой важную роль играют иммунологические нарушения. В экстрактах псориатических чешуек обнаружены антигенные компоненты, отсутствующие в коже здоровых лиц, а в сыворотке крови выявлены аутоантитела к ним. Это дает основание рассматривать псориаз как болезнь, в патогенезе которой играет роль и аутоиммунный компонент.
В 1996 году были проведены сравнительные исследования иммунологических показателей периферической крови и биоптатов "псориатической" кожи больных. С помощью проточного цитофлюориметра он выявил снижение в крови абсолютного и относительного количества Т-лимфоцитов за счет преимущественного уменьшения субпопуляции Т-хелперов по сравнению с субпопуляцией Т-супрессоров, что проявилось в снижении иммунорегуляторного индекса (Т-хелперы/Т-супрессоры). Количество В-лимфоцитов в периферической крови не претерпевало достоверных изменений. При гистохимическом исследовании биоптатов "псориатической" кожи с помощью моноклональных антител установлено, что основным клеточным компонентом дермальных инфильтратов являются Т-лимфоциты, тогда как В-лимфоциты встречаются лишь в виде единичных клеток в отдельных гистологических препаратах. Большая часть Т-лимфоцитов, инфильтрирующих дерму, относится к субпопуляции Т-хелперных клеток. Эти наблюдения дают основание предположить, что наблюдаемый в периферической крови дефицит Т-лимфоцитов, особенно хелперной субпопуляции, связан с их выходом из кровяного русла в кожу. Наряду с Т-лимфоцитами в инфильтратах дермы обнаружены клетки моноцитарно-макрофагального ряда и клетки Лангерганса. Отмечен высокий уровень экспрессии клетками воспалительных инфильтратов HLA-DR-антигена II класса основного комплекса гистосовместимости. (8)
Отмечено также проникновение в эпидермис из дермы хелперной субпопуляции Т-лимфоцитов и моноцитарно-макрофагальных клеток. Выявлено также увеличение числа клеток Лангерганса и экспрессия HLA-DR-комплекса на части кератиноцитов, что говорит об изменении их иммунологического фенотипа. По современным представлениям, это отражает способность HLA-DR-кератиноцитов активировать эпидермальные Т-лимфоциты, а также выделять цитокины, некоторые из которых обладают свойством вызывать гиперпролиферацию эпителиальных клеток.
Эпидермальная гиперпролиферация - это ключевое патологическое явление при псориазе, поэтому обнаружение ее пусковых механизмов является основополагающим моментом в изучении патогенеза и разработке методов терапии заболевания. В работе D. J. M. Leung et al (1995) было отмечено, что золотистый стафилококк и стрептококки секретируют большое количество экзотоксинов, играющих роль суперантигенов, способных связываться с белками главного комплекса гистосовместимости тканей на антигенпредставляющих клетках - кератиноцитах, Т-лимфоцитах и моноцитах. Эти суперантигены у больных псориазом могут опосредовать активацию HLA-DR на кератиноцитах, инфильтрирующих Т-лимфоцитах и моноцитах. Селективная экспансия популяций Т-клеток локально может приводить к выделению цитокинов, обусловливающих пролиферацию кератиноцитов. Также не исключено прямое воздействие суперантигенов на кератиноциты, которые экспрессируют цитокины с пролиферативной активностью.
Заключение
Упомянутые методики доставки на основе наночастиц, а также общий уровень развития современной молекулярной биологии, биотехнологии и фармакологии, существенно модифицируют представления о возможностях кожной терапии. С одной стороны, это обеспечивает заметный прогресс в области медицины (в частности, дерматологии), с другой — позволяет косметическим препаратам выйти на качественно новый уровень. Действительно, от нанокосметики будущего стоит ожидать, что в основе её действия будет лежать не маскировка нежелательных эффектов, как зачастую это происходит на сегодняшний момент, а устранение их биологической причины. Но как же в таком случае разграничить сферы косметики и медицины? Возможно, что такие границы и вовсе исчезнут в будущем, пока же отметим возможные точки их соприкосновения.
Обойдёмся без шприцов
Многочисленные прививки от всевозможных заболеваний стали привычными для современного человека. Однако сама методика практически не изменилась за последнее столетие. Впрочем, скоро пациентам можно будет по праву цитировать известный стишок С. В. Михалкова: «Я прививки не боюсь». На смену шприцам с раствором антигенов в ближайшем будущем придут нанопереносчики (размеры до 500 нм), способные доставлять антигены через stratum corneum к клеткам Лангерганса. Эффективность таких конструкций показана в лабораторных исследованиях, однако детальные механизмы до сих пор остаются неизвестными. Тем не менее, экспериментально установленные ограничения в размерах эффективных переносчиков позволяют предположить, что проникновение во внутренние слои кожи осуществляется через липидные каналы между корнеоцитами. Также было показано, что использование малых наночастиц (всего 40 нм) позволяет доставлять антигены непосредственно через волосяные фолликулы (рис. 2). Использование такого пути доставки является крайне перспективным, поскольку в области фолликулов находится не только скопление дендритных клеток, но также обнаружены и стволовые клетки. Это обеспечивает возможность не только кожной иммунизации, но также и направленной дерматотерапии, включающей стимуляцию клеточной пролиферации .
Список литературы
1. Афанасьев, Ю. И.; Юрина, Н. А.; Котовский, Е. Ф.;. Гистология: Учебник. Москва : Медицина, 2002. ISBN 5-225-04523-5.
2. Эрнандес, Елена; Марголина, Анна; Петрухина, Анна;. Липидный барьер кожи и косметические средства. Москва : Издательский дом "Косметика и медицина" (ООО "Фирма Клавель"), 2003.
3. Чугунов, Антон. Эпидермальная доставка будущего. Биомолекула.Ру. [В Интернете] 18 май 2008 r. [Цитировано: 21 июнь 2008 r.] http://www.biomolecula.ru.
4. LUMEN Virtual Histology. [Online] http://www.meddean.luc.edu/lumen/MedEd/Histo/virtualhistology.htm.
5. Bramson J, Dayball K, Evelegh C, Wan YH, Page D, Smith A. Enabling topical immunization via microporation: a novel method for pain-free and needle-free delivery of adenovirus-based vaccines. PUBMED. [Online] 05 15, 2008. http://www.ncbi.nlm.nih.gov/pubmed/12571633.
6. Lademann J, Richter H, Teichmann A, Otberg N, Blume-Peytavi U, Luengo J, Weiss B, Schaefer UF, Lehr CM, Wepf R, Sterry W. Nanoparticles--an efficient carrier for drug delivery into the hair follicles. PUBMED. [Online] November 1, 2006. [Cited: JUNE 12, 2008.] http://www.ncbi.nlm.nih.gov/pubmed/17169540.
7. Сестринское дело. 2001 r., Сестринское дело.
8. Марфунин, Дмитрий. О роли О 7-дегидрохолестерина в пролиферации кератиноцитов и развитии псориаза. Москва, Россия : б.н., 2005 r.
9. СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ ПСОРИАЗА. Владимиров, В. В. 2006 r., ДЕРМАТОЛОГИЯ, приложение к журналу "Consilium Medicum", стр. 23-26.
10. Кузнецов, С. Л.; Мушкамбаров, Н. Н.;. Гистология, цитология и эмбриология: Учебник для медицинских ВУЗов. Москва : ООО "Медицинское информационное агентство", 2005. ISBN 5-89481-238-0.
11. Кузнецов, С. Л.; Мушкамбаров, Н. Н.; Горячкина, В. Л.;. Атлас по гистологии, цитологии и эмбриологии. Москва : ООО "Медицинское информационное агенство", 2002. ISBN 5-89481-0555-8.
12. М.М. Шегай, З.Б. Кешилева, Г.А. Акышбаева. Роль некоторых цитокинов в развитии псориаза. Центральный кожно-венерологический институт, Москва : б.н., 2006.
13. Mark Gill, PharmD. Psoriasis. USA : U.S.C. School of Pharmacy, 2005.
14. Полянский, А. А. Через кожу? — Нет проблем! Несколько слов о косметике будущего. Косметика и медицина. 2008 r., 2.
15. Vogt, A. 40 nm, but not 750 or 1 500 nm, nanoparticles enter epidermal CD1a+ cells after transcutaneous application on human skin. J. Invest. Dermatol. 2006.
© 2009 База Рефератов