
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Опиоидергические механизмы тревожных расстройств
Реферат: Опиоидергические механизмы тревожных расстройств
ОПИОИДЕРГИЧЕСКИЕ МЕХАНИЗМЫ ТРЕВОЖНЫХ РАССТРОЙСТВ И ЭФФЕКТОВ АНКСИОЛИТИЧЕСКИХ ПРЕПАРАТОВ
автореферат
диссертации на соискание ученой степени
доктора биологических наук
Москва – 2007
Общая характеристика работы
Актуальность исследования. Тревога является эволюционно выработанной адаптационной реакцией, реализующейся в мобилизации ресурсов организма в ситуации угрозы и изменяющихся условиях существования. Как пониженный, так и повышенный уровень тревожности, не адекватный среде обитания, снижает вероятность выживания особи в природе, снижает качество жизни человека. Патологически повышенный уровень тревоги, представленный в расстройствах тревожного спектра, является одним из наиболее распространенных клинических проявлений психических заболеваний.
В фармакотерапии тревожных расстройств чаще всего используются препараты, модулирующие состояние ГАМК-бензодиазепиновой и серотониновой систем. Доказано также, что в регуляции тревожности принимают участие норадренергическая, ацетилхолиновая, дофаминовая и глутаматергическая системы (Belzung, Le Pape, 1994, Tanaka et al., 2000, Salgado-Pineda et al., 2005, Alt et al., 2006).
В последние годы растет количество сообщений о роли регуляторных пептидов как в реализации проявлений тревоги, так и в подавлении их. Суммируя литературные данные, к «протревожным» можно отнести около двух десятков нейропептидов, включая эндозепины, кортиколиберин, холецистокинин, нейротензин, вазопрессин, ангиотензин и другие. К группе пептидов, выполняющих «противотревожные» функции в ЦНС относятся нейропептид Y, галанин, пролактин, окситоцин, соматостатин, обестатин, нейропептид S и ряд других регуляторных пептидов. Биологические механизмы регуляции тревожности пептидами связаны, как правило, с модуляцией активности указанных выше нейрохимических систем, что позволяет поддерживать уровень тревожности, адекватный сложившейся ситуации. Логично предположить, что на начальных стадиях отклонения тревоги у психически здоровых лиц от нормы, в случае развития тревожных расстройств при пограничных психических нарушениях терапевтически эффективной может быть коррекция соответствующих регуляторных систем.
Исследованию роли опиоидных пептидов, эндогенной опиоидной системы в патогенезе тревоги к моменту начала диссертационного исследования были посвящены лишь немногочисленные и противоречивые публикации (Ng et al., 1996, Tsuda et al., 1996). Вместе с тем, важнейшая роль этой системы в регуляции эмоций, в реализации развития психоэмоциональных и соматических проявлений стрессовых реакций не вызывает сомнений. Кроме того, опиоидная система функционально тесно связана с серотониновой (Oomagari, 1989, Agmo, Belzung 1998, Yilmaz et al., 1998), ГАМК-ергической (Stanford, Cooper, 1999, Shen, Johnson, 2002, Roberto, Siggins, 2006), холецистокининовой (Hebb et al., 2005) и другими нейрохимическими системами, роль которых в развитии тревоги доказана.
В настоящее время особое внимание уделяется разработке лечебных психотропных препаратов пептидной природы. Преимуществом пептидных препаратов является крайне низкая вероятность токсичности при введении даже в больших дозах, поскольку продуктами их деградации являются природные аминокислоты. Кроме того, регуляторные пептиды выполняют, в основном, гомеостатические функции, что существенно снижает вероятность развития отрицательных побочных эффектов при их использовании. Результатом многолетнего целенаправленного исследования по поиску и изучению нейротропного действия пептидов явилось создание оригинального пептидного соединения – селанка (Thr-Lys-Pro-Arg-Pro-Gly-Pro) (Пономарёва-Степная и соавт., 1984). С использованием ряда поведенческих моделей в доклинических исследованиях были получены данные об эффективности селанка как анксиолитика, обладающего также ноотропным и стресс-протективным действием (Середенин и соавт., 1995, 1996, 1998). Вместе с тем, биологический механизм действия селанка до конца не изучен. Можно предположить, что один из механизмов анксиолитического эффекта селанка связан с его воздействием на эндогенную опиоидную систему. Изучение влияния селанка на опиоидную систему может быть интересно также с точки зрения уточнения показаний к его применению при лечении тревожных расстройств.
Целью настоящего исследования было выявление изменений в опиоидной системе при формировании тревожных состояний и изучение опиоидергических механизмов действия новых анксиолитиков.
В соответствии с поставленной целью были определены следующие задачи:
1. Экспериментальное исследование анксиолитических эффектов агонистов опиоидных рецепторов (ОР) дельта- и мю-типов.
2. Исследование параметров, характеризующих состояние опиоидной системы (константы связывания центральных ОР, активность эндогенных лигандов ОР и скорость ферментативной деградации лей-энкефалина в мозгу и крови), у животных с различными поведенческими проявлениями тревожности.
3. Определение параметров, характеризующих активность энкефалиндеградирующих ферментов (ЭДФ) в крови людей с различными конституционально-личностными характеристиками и у больных с разными формами тревожных расстройств.
5. Изучение влияния пептидного анксиолитика селанка и его отдельных пептидных фрагментов на активность ЭДФ in vitro.
6. Экспериментальное исследование роли опиоидной системы в механизмах поведенческих эффектов селанка: сопоставление выраженности этих эффектов с действием препарата на активность ЭДФ in vivo и изучение возможности блокирования анксиолитического действия селанка антагонистом ОР налоксоном.
7. Экспериментальное исследование способности синтетического аналога энкефалинов даларгина и селанка, параллельно с анксиолитическим действием, препятствовать развитию стресс-индуцированных соматических нарушений на уровне сердечнососудистой и иммунной систем.
8. Сопоставление клинических эффектов селанка и медазепама с изменением активности ЭДФ в крови больных генерализованным тревожным расстройством.
Научная новизна. Установлена принципиальная возможность и перспективность нового подхода к фармакотерапии тревожных расстройств, связанного с активацией опиоидной системы путем воздействия на ОР δ-типа и / или ингибирования ферментов деградации эндогенных опиоидных пептидов.
Впервые получены и опубликованы данные об анксиолитическом эффекте агониста δ-ОР даларгина.
Впервые обнаружено, что один их механизмов биологического действия нового пептидного анксиолитика селанка опосредован его влиянием на опиоидную систему.
Впервые продемонстрировано, что для животных с различным уровнем поведенческих проявлений тревоги характерны различия по ряду параметров функционального состояния опиоидной системы: характеристики связывания центральных ОР, концентрация и скорость гидролиза эндогенных лигандов ОР в мозге и крови.
Впервые продемонстрированы различия в состоянии опиоидной системы здоровых людей с различными конституциональными характеристиками и больных с разными формами тревожных расстройств. Эти данные позволяют понять один из механизмов конституционально обусловленной предрасположенности человека к заболеваниям, в патогенезе которых существенно нарушение опиоидной системы.
Практическая значимость. Разработана методика хроматографического разделения продуктов деградации равномерно меченного тритием лей-энкефалина, позволяющая одновременно оценивать активность всех групп ЭДФ в микроколичестве биологических жидкостей и тканей человека и животного. Методика информативна для диагностики пациентов с тревожно-фобическими расстройствами и другими заболеваниями, нуждающихся в коррекции эндогенной опиоидной системы. В результате проведенного исследования установлено, что при генерализованном тревожном расстройстве (ГТР) наблюдается изменение состояния опиоидной системы, которое в значительной степени нормализуется в процессе терапии селанком. Сопоставление этих данных с результатами клинической эффективности селанка и опиоидзависимым механизмом его действия свидетельствует о патогенетической обоснованности применения препарата при ГТР.
Поскольку опиоидная система участвует в регуляции широкого спектра функций организма, предполагается целесообразным расширение показаний к использованию селанка и даларгина в целях профилактики и терапии психических и соматических заболеваний, характеризующихся значимыми нарушениями состояния этой системы. Данные о кардиотропном эффекте селанка свидетельствуют о перспективности его использования при лечении заболеваний сердечно-сосудистой системы, сопровождающихся тревожными расстройствами. Практический интерес представляют также данные о нормализующем действии даларгина на иммунную систему животных в условиях хронического стресса, что дает основание рекомендовать использование этого препарата для иммунокоррекции при истощении опиоидной системы.
Внедрение результатов исследования. Результаты проведенных исследований внедрены в работу ГУ Научного центра психического здоровья РАМН, ГУ Научно-исследовательского института фармакологии им. В.В. Закусова РАМН, Российского государственного медицинского университета и ФГУ Национального научного центра наркологии Федерального агентства по здравоохранению и социальному развитию.
Апробация диссертации. Результаты исследования доложены и обсуждены на: Constituent Congress International Society for Pathophysiology, (Moscow, 1991); First Baltic See Conference of Psychosomatics and Psychotherapy (Kiel, Germany, 1992); First World Congress on Stress (Bethesda, USA, 1994); Second Baltic Sea Conference on Psychosomatic Medicine (Goteborg, Sweden, 1995), Third Annual Symposium on AIDS, Drugs of Abuse and Neuroimmune Axis (San Diego, USA, 1995); 13 съезде психиатров России (Москва, 2000); International conference on cell surface aminopeptidases (Nagoya, Japan, 2000); 3 международной конференции «Биологические основы индивидуальной чувствительности к психотропным средствам» (Суздаль, 2001); 9 Российском национальном конгрессе «Человек и лекарство» (Москва, 2002); 5 Международном симпозиуме «Химия протеолитических ферментов» (Москва, 2002); 2 съезде Российского научного общества фармакологов (М., 2003); Российском симпозиуме по химии и биологии пептидов (Москва, 2003); Сессии «Актуальные проблемы психоэндокринологии» Всероссийской научно-практической конференции памяти профессора А.И. Белкина» (Москва, 2004); 8th Eur. Congress of Neuropharmacology. Russia (Moscow, 2005); 14‑ый сьезд психиатров России (Москва, 2005); 4 Международной конференции «Биологические основы индивидуальной чувствительности к психотропным средствам» (Москва, 2006); 8th World Congress International Society for Adaptive Medicine (Moscow, 2006); Межлабораторном семинаре University of Pittsburgh (USA, 2006); Межлабораторном семинаре ГУ Научный центр психического здоровья РАМН, ГУ НИИ фармакологии им В.В. Закусова РАМН, Института биологии развития РАН, Института молекулярной генетики РАН, МГУ им. М.В. Ломоносова, Московского НИИ психиатрии, Московского государственного медико-стоматологического университета и Российского государственного медицинского университета Федерального агентства по здравоохранению и социальному развитию, Москва, 4 апреля 2007 г.
Публикации. По материалам диссертации опубликовано 64 печатные работы. Из них 34 статьи: 28 – в отечественных и 6 – в зарубежных журналах.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, изложения собственных результатов, их обсуждения, выводов и списка цитированной литературы, включающего 862 источника (86 отечественных и 776 зарубежных). Диссертация изложена на 300 страницах, включает 33 таблицы и 25 рисунков.
Основные положения, выносимые на защиту:
1. Фармакологическое воздействие на опиоидную систему путем введения агонистов ОР δ-типа и ингибиторов ферментов деградации опиоидных пептидов оказывает анксиолитическое действие, выраженность которого зависит от исходного состояния организма, определяемого как генотипическими факторами, так и воздействием окружающей среды.
2. Один из механизмов анксиолитического действия пептидного препарата селанка связан с активацией опиоидной системы, в частности, с ингибированием энкефалиндеградирующих ферментов.
3. Выраженный клинический эффект селанка наблюдается при генерализованном тревожном расстройстве, характеризующемся недостатком эндогенных ингибиторов ЭДФ, и сопровождается повышением среднего значения времени полупревращения лей-энкефалина в сыворотке крови больных.
4. Анксиолитическое действие селанка и даларгина на животных сопровождается коррекцией стресс-индуцированных соматических нарушений, в том числе, расстройств функций сердечно-сосудистой и иммунной систем.
Материалы и методы
Характеристика клинического материала. В работе всего изучено 225 человек. Из них 74 здоровых добровольца (39 женщин, 35 мужчин, средний возраст 30±2 года), 59 пациентов (29 женщин, 30 мужчин, средний возраст 31±2 года), у которых, в соответствии с критериями DSM‑4, диагносцировались тревожно-фобические расстройства (генерализованное тревожное расстройство, паническое расстройство или агорафобия)[1]. В рамках второй фазы клинических испытаний селанка было обследовано 30 больных, в состоянии которых имелись проявления тревоги. По МКБ‑10 у них было диагностировано ГТР (12 человек), смешанное тревожно-депрессивное расстройство и депрессивный эпизод (по 9 человек)[2]. В клинико-биологическое исследование, проводившееся в рамках третьей фазы клинических испытаний селанка в сравнении с медазепамом, были включены 62 пациента (13 мужч., 49 женщ., средний возраст 38,6±9,1 лет): 30 с генерализованным тревожным расстройством (F41.1) и 32 с неврастенией (F48.0). Продолжительность заболевания у всех пациентов равнялась 14,0±17,9 месяцев, у пациентов, страдающих ГТР и неврастенией – 12,0±10,0 и 15,9±23,0, соответственно[3]. Препарат селанк использовался в виде 0,15% раствора для интраназального применения, его суточная доза (2.7 мг) была разделена на 3 приема. Медазепам использовался в таблетированной лекарственной форме в суточной дозе 30 мг, разделенной на 3 приема.
Критериями, исключающими участие в исследовании как здоровых доноров, так обследованных больных, являлись: возраст старше 50 и моложе 18 лет, наличие в анамнезе острых и хронических заболеваний печени и почек, а также применение гипотензивных препаратов, фармакологическое действие которых основано на ингибировании ангиотензинпревращающего фермента (капотен, энап и т.п.).
Для оценки состояния пациентов использовались следующие методики: шкала оценки выраженности симптоматики, составленная на основе «Унифицированной системы оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами» (Александровский и соавт., 1984), шкала для объективной оценки тревоги Гамильтона (HAMA) (Hamilton, 1959), шкала самооценки тревоги Цунга (ASRS, Zung, 1971), шкала общего клинического впечатления (CGI) (National Institute of Mental Health, 1976). Степень дисфункции вегетативной нервной системы оценивали по методу А.М. Вейна (1998 г.). Сила и интенсивность панических атак оценивалась по шкале панических атак и приступов тревоги Шихана (Sheehan, Sheehan, 1983).
Психологическое тестирование. Оценку конституционально-личностных характеристик пациентов проводили при помощи Личностного опросника Айзенка (Eysenck Personality Inventory, или EPI) в адаптации И.Н. Гильяшевой (1983), предназначенного для диагностики двух базовых измерений личности: невротизм – эмоциональная стабильность и экстраверсия-интроверсия. Сочетание оценок по этим шкалам позволяет разделить испытуемых на 4 типа темперамента: меланхоликов, холериков, сангвиников и флегматиков. Граничное условие – 12 баллов по обеим шкалам.
Уровень личностной тревожности пациентов определяли по шкале Спилбергера в адаптации Ю. Ханина (1976).
Используемые животные. В эксперименте использовали 574 белых беспородных крысы (517 самцов и 57 самок), 123 крысы-самца популяции Wistar, полученных из питомника РАМН «Столбовая», а также 270 мышей-самцов линии Balb/с, 68 мышей-самцов линии C57Black/6 и 10 белых беспородных крыс-самцов, полученных из питомника «Крюково-Центральное». Животных содержали в стандартных условиях вивария по 10 в клетке МАK IV при температуре 220С, световом режиме 12:12 часов (свет с 8.00 до 20.00), питьевом и пищевом режиме ad libitum. В течение 3 недель до начала эксперимента животные адаптировались к условиям вивария.
Тестирование спонтанной двигательной активности животных. Тестирование спонтанной двигательной активности крыс проводили в течение пяти минут в компьютеризированной системе Auto Track System (ATS) фирмы Columbus Instruments (США), представляющей собой «мягкий вариант» системы «открытое поле»: слабое освещение и размеры камеры (42х42х20 см) близки к обычным условиям содержания животных. Тестирование проводили в соответствии с методикой, разработанной под руководством проф. Г.Г. Барсегяна (Кордзадзе и соавт. 1992).
При проведении всех фармакологических исследований животных разбивали на экспериментальные группы, гомогенные по параметру «горизонтальная двигательная активность в ATS» (ГДА). При статистическом анализе полученных данных, в зависимости от величины выборки экспериментальных животных, было использовано два критерия ранжирования крыс по ГДА. В случае относительно маленьких выборок использованных в эксперименте животных, исходя из значений медианы ГДА, выделялось две группы: высоко- и низкоактивных. При достаточно больших выборках животных разбивали на три группы по методу, описанному Р.Н. Кордзадзе и соавторами (1992). Критериями отбора служили точки перегиба на кривой нормального распределения, описывающей ГДА данной выборки крыс. Крысы, значения ГДА которых располагались на кривой до первой точки перегиба, считались «низкоактивными», после второй точки перегиба – «высокоактивными», а животные с двигательной активностью, укладывающейся в среднюю часть кривой – «средними».
Тестирование двигательной активности большой выборки (около 2000) животных, проведенное в НЦ ПЗ РАМН в нашей лаборатории и в лаборатории проф. Г.Г. Барсегяна за несколько лет, показало, что для крыс популяции Wistar, полученных из питомника Столбовая, точки перегиба на кривой нормального распределения соответствовали ГДА около 1100 и 1600, а для белых беспородных крыс из питомника Крюково – 1086 и 1860 см/5 мин.
Спонтанную двигательную активность мышей оценивали в течение 5 мин в аналогичной ATS автоматизированной системе Rat-o-Matic (Columbus Instruments, США), регистрирующей горизонтальное перемещение (аналог ГДА), количество стоек и встряхиваний животного.
Обучение и тестирование крыс в «челночной камере». Обучение крыс в «челночной камере» проводили с использованием экспериментальной компьютеризированной установки «Reflex‑16» фирмы «Columbus Instr» (США) по схеме, описанной в статье А.А. Зозуля и соавт. (1996). К избравшим активную стратегию избегания относились животные, преимущественно (>70% предъявлений) реагировавшие на условный сигнал, животные с пассивной стратегией реагировали на электрошок или у них наблюдалось отсутствие перехода (>70% предъявлений).
В эксперименте по изучению влияния даларгина на иммунный статус и поведение крыс в «челночной камере» через день после окончания обучения животным проводили пятидневный курс введения даларгина. Даларгин вводили внутрибрюшинно по 20 мкг/кг один раз в день. Контрольным животным в том же объеме вводили физиологический раствор. На следующий день после последнего укола крыс тестировали в «челночных камерах» и через 2 часа после тестирования забивали.
Конфликтный тест Вогеля проводился в анксиометре фирмы «Columbus Instr» (США), как описано в статье А.А. Зозуля и соавт. (1999).
Тест «открытое поле» (ОП) проводили по стандартной методике (Середенин С.Б. и соавт., 1998).
Тестирование животных в установке «приподнятый крестообразный лабиринт» (ПКЛ) проводили по стандартной методике в течение 5 мин. Установка для тестирования крыс была приподнята на высоту 50 см и состояла из двух открытых (45х10 см), двух закрытых рукавов (45х10х40 см) с открытой крышей и центрального квадрата (в месте соединения) со стороной 10 см. Мышей тестировали в подобной установке с размерами рукавов 23х4.5 см и высотой стенок закрытого рукава 17.5 см.
При изучении анксиолитических эффектов опиоидных пептидов на крыс на следующий день после тестирования в АТS часть животных лишали питья при пищевом режиме ad libitum. Одновременно начинали курс введения (5 дней, 1 раз в день) даларгина или ДАГО (20 мкг/кг внутрибрюшинно в 0,2 мл физиологического раствора), крысам контрольной группы – физиологический раствор. Налоксон (10 мг/кг внутрибрюшинно) в соответствующем эксперименте вводили одновременно с даларгином. При исследовании центрального эффекта даларгина за день до инъекции крысам под легким эфирным наркозом и новокаиновой блокадой сверлили отверстие в крыше черепа и на сутки помещали в одиночные клетки при питьевом и пищевом режиме ad libitum. Препарат вводили однократно в четвертый желудочек мозга в дозах 0,05; 1,00 и 20,00 мкг/кг в 5 мкл. BNTX и налтрибен (0.5 и 10 мкг/кг) вводили одновременно с даларгином (0.05 мкг/кг).
Тестирование влияния селанка на поведение мышей Balb/c в ПКЛ проводили без дополнительных стрессорных воздействий через 30 минут после внутрибрюшинного введения в объеме 0.2 мл физиологического раствора, селанка (600 мкг/кг), налоксона (10 мг/кг) и смеси селанка с налоксоном в тех же дозах.
Определение частоты сердечных сокращений (ЧСС). Для измерения ЧСС животным подкожно вводили микроэлектроды в районе ушей, помещали в стандартную клетку при стандартном освещении и подключали к полиграфу «Мингограф‑7» (ФРГ). ЧСС определяли по количеству R-R интервалов за 10 сек с периодичностью в 30 секунд в течение 5 минут.
Пролиферативную активность лимфоцитов крови крыс определяли по включению Н-тимидина в ДНК культивируемых клеток. Для этого кровь разводили в 10 раз средой 199, содержащей 10 мМ ХЕПЕС и 50 мкг/мл гентамицина, 100 мкл разведенной крови смешивали со 100 мкл обогащенной среды, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамин неспецифический Т-клеточный митоген КонА (в диапазоне концентраций от 0 до 25 мкг/мл). Культивирование проводили при 37оС в течение 96 часов. За 20 часов до окончания инкубации в пробы добавляли по 2 мкКи Н-тимидина. Разделение включенного в ДНК и свободного 3Н-тимидина проводили фильтрацией на стекловолокнистых фильтрах GF/C с помощью клеточного харвестера. Радиоактивность определяли на счетчике MiniBeta.
Мембранную фракцию головного мозга крыс, используемую в радиорецепторном анализе (РРА), получали модифицированным методом Simantov et al. (1976). Для получения Р2 мембранной фракции, использованной при определении активности мембраносвязанных энкефалиндеградирующих ферментов, мозг животных гомогенизировали в охлажденном 50мМ Трис-НСI буфере рН 7,7, содержащем 20% сахарозы, (соотношение вес/объем =1/20) в гомогенизаторе Potter (стекло / тефлон). Гомогенат центрифугировали при 1000 g 20 мин, 4оС. Полученный супернатант повторно центрифугировали (30000g, 30 минут, 4оС), осадок ресуспендировали в том же объеме 50мМ Трис-НСI буфера рН 7,7 и снова осаждали (30000g, 30 минут, 4оС).
Вытесняющую активность лигандов ОР определяли в плазме крови и гиппокампе крыс. При взятии крови качестве антикоагулянта использовали 3% раствор Na2ЭДТА (в соотношении 1:10) с добавлением бацитрацин (200 мкг/мл крови). Кровь центрифугировали при 1000g 10 мин, 40С. Плазму замораживали и хранили при -400С. Гиппокампы выделяли на холоду, замораживали в жидком азоте и хранили при -400С.
Экстракцию опиоидов проводили 0,25 М уксусной кислотой (15 мин., 1000С, 1:10). Раствор замораживали, пробы лиофилизировали и хранили при -400С. Непосредственно перед тестированием образцы растворяли в 50 мМ трис-НСl буфере (рН 7.7), центрифугировали при 8000g 15 мин., в супернатантах определяли вытесняющую активность лигандов ОР мю- и дельта-типов радиорецепторным методом.
Радиорецепторный анализ проводили, как описано ранее (Зозуля А.А. и соавт., 1994). Инкубационная смесь объемом 300 мкл содержала 50мМ Трис-HCI буфер рH 7,7 (20оC)3Н-ДАДЛЭ (0,5–4,0 нМ, «Amersham», Великобритания, 42 Ки/ммоль) или 3Н-ДАГО (4,0 нМ, «Amersham», Великобритания, 40 Ки/ммоль), 1,0–1,5 мг/мл белка мембран головного мозга крыс, 50 мкг/мл ингибитора протеаз бацитрацина. Величину специфического связывания определяли по разности связывания меченого лиганда в отсутствии и присутствии избытка (2мкМ) соответствующих холодных лигандов. Она составляла в 65–85% от общей величины связывания. В случае определения вытесняющей активности эндогенных опиоидов в плазме крови и гиппокампе крыс в инкубационную среду добавляли экстракты этих тканей в трех разведениях, а параллельно строили калибровочные кривые вытеснения 3Н-ДАДЛЭ (4,0 нМ) и 3Н-ДАГО соответствующими холодными лигандами и лей-энкефалином. Активность эндогенных опиоидов в экстрактах оценивали сопоставлением полученных результатов с калибровочной кривой и выражали в моль-эквивалентах.
Равновесные константы связывания (константа диссоциации (Кд) и максимальное число мест связывания (Вмах)) Н-ДАДЛЭ с ОР обонятельных луковиц и стриатума крыс определяли путем линеаризации кривых насыщения в координатах Скэтчарда.
Определение активности энкефалиндеградирующих ферментов (ЭДФ) проводилось in vitro в плазме и сыворотке крови животных и человека и в мозге животных. В этих тканях гидролиз энкефалина происходит по всем пептидным связям и катализируется целым рядом ферментов. Для оценки суммарной активности ЭДФ в тканях определяли: при насыщающих концентрации субстрата максимальную скорость реакции (Vmax, по кривой Михаэлиса-Ментен), являющуюся суммой активностей всех ЭДФ, и при малых концентрациях субстрата – время полупревращения энкефалина (τ1/2), отражающее реальную скорость гидролиза этого пептида в биологических объектах.
При определении τ1/2 лей-энкефалина инкубационная смесь (конечный объем 50 мкл) содержала 10‑кратно разведенную плазму или сыворотку крови, 25 мМ трис-HCl (pH=7,5), 0,15М NaCl, 1 мкКи (150 нМ) равномерно меченного тритием [G3Н] – лей-энкефалина с удельной активностью 120 Ки/моль. Инкубацию проводили при температуре 37°С и останавливали добавлением 5 мкл 0,2 М НСl. Vmax определяли при добавлении 1.5 мМ холодного лей-энкефалина в инкубационную среду. При определении активности ЭДФ мозга инкубационная смесь содержала Р2‑мембранную фракцию мозга крысы или фракции гомогената мозга мышей в концентрации по белку 0.05 – 3.0 мг/мл. Продукты гидролиза [G3Н] – лей-энкефалина разделяли методом тонкослойной хроматографии (ТСХ) в двух системах: этилацетат: изопропанол:вода: уксусная кислота 40:40:1:19 (для силикагельных пластинок Merck, Германия и SILICA GEL 6061, EASTMAN, Kodak Company, США) и 2‑бутанон: трет-бутанол: аммиак:вода 2:2,4:1:1 (для Silufol, Чехия).
Высокоэффективная жидкостная хроматография (ВЭЖХ) продуктов гидролиза [G3Н] – лей-энкефалина и [G3Н] – селанка. Для более четкого разделения всех возможных фрагментов [G3Н] – лей-энкефалина, образующихся в результате его ферментативного гидролиза, а также для анализа путей биодеградации селанка была использована ВЭЖХ по методу (Золотарев и соавт., 2006). Экстракцию пептидных фрагментов из биологических образцов проводили 4‑х кратным объемом ацетонитрила с дальнейшим переводом экстракта в 0.1% водный раствор трифторуксусной кислоты.
Методика определения содержания меченого пептида и его метаболитов основана на определении радиоактивности хроматографических пиков соответствующих немеченых фрагментов, предварительно введенных в исследуемый образец перед разделением и выделенных по данным УФ-детекции (спектрофотометр Beckman 165 (Altex) при одновременной детекции на длинах волн 254 и 280 нм). Хроматографию продуктов гидролиза [G3Н] – лей-энкефалина проводили на колонке «Kromasil С18» (4х150 мм) в смеси элюента А (5% ацетонитрил, содержащий 0.05% ТФУ и 0.05% гептафтормасляной кислоты) и элюента В (30% ацетонитрил в элюенте А). Использовали градиент В в А: от 0 до 10% (0–10 мин), от 10% до 50% за 12 мин, от 50% до 100% элюэнта В за 40 мин, – при скорости потока 1 мл/мин. Для хроматографии [G3Н] – селанка и его пептидных фрагментов использовали градиентное элюирование ацетонитрилом 15–35%, содержащим 0.1% гептафтормасляной кислоты, в течение 20 мин на той же колонке.
Концентрацию пептидов определяли по радиоактивности соответствующей фракции с учетом молярной радиоактивности данного фрагмента, которая была рассчитана по данным распределения тритиевой метки в исходном [G3H] – пептиде, полученным с помощью тритиевого ЯМР (Zolotarev et al., 2002).
Определение содержания белка в пробах проводили по методу M.M. Bradford (1976) с использованием наборов фирмы «Bio-Rad» (США). Для определения концентрации мембраносвязанного белка проводилась предварительная обработка мембран лизирующим буфером, содержащим 10 мМ Трис-НСl рН 7.4, 150 мМ NaCl, 1мМ ЭДТА, 0.1% додецилсульфат натрия, 1% Тритон Х‑100, 1% дезоксихолат натрия.
Общий кортизол в сыворотке крови определяли иммуно-ферментным методом с помощью наборов фирмы «DRG» (ФРГ).
Статистическую обработку результатов проводили с использованием пакета программ «Statgraphics» и «Statistica» для Windows. Достоверность отличия результатов между группами оценивали с помощью критерия Стъюдента. Кроме того, были использованы методы корреляционного анализа для параметрических данных по Пирсону (r), для непараметричеких – по Спирману (R).
Результаты и обсуждение
Влияние агонистов ОР на поведенческие проявления тревожности животных.
В качестве препаратов, воздействующих на опиоидную систему, в данном исследовании были использованы два пептидных соединения, созданных в нашей стране. Синтетический аналог лей-энкефалина, даларгин (Tyr-D-Ala-Gly-Phe-Leu-Arg), разработанный в Кардиологическом научном центре РАМН (Титов и соавт., 1985), является агонистом ОР преимущественно δ-типа. Селанк (Thr-Lys-Pro-Arg-Pro-Gly-Pro), синтезированный в ИМГ РАН (Пономарёва-Степная и соавт., 1984), – новый препарат с анксиолитическими свойствами, изученными в Институте фармакологии РАМН (Середенин и соавт., 1996).
Установлена способность даларгина при внутрибрюшинном (20 мкг/кг) введении снижать поведенческие проявления тревожности животных в тестах Вогеля, «челночная камера» и «приподнятый крестообразный лабиринт» (ПКЛ). В процессе статистической обработки результатов обнаружилось, что выраженность анксиолитического эффекта даларгина зависит от исходного поведенческого статуса животных, в частности, от их ГДА в ATS. Так, в конфликтном тесте Вогеля этот эффект наиболее выражен у крыс с низкой двигательной активностью (НА) в ATS. Курсовое введение даларгина оказывает анксиолитическое действие, выражающееся в переходе от активной стратегии избегания в «челночной камере» к пассивной, только у крыс с высокой исходной двигательной активностью (ВА) в ATS. Анксиолитическое действие даларгина в тесте ПКЛ наблюдалось лишь на фоне дополнительных стрессорных воздействий, сопровождавшихся повышением тревожности крыс, блокировалось налоксоном и было более выражено у ВА животных (табл. 1).
Таблица 1. Влияние курсового периферического (внутрибрюшинного) введения даларгина на поведение белых беспородных крыс-самцов в ПКЛ на фоне стресса питьевой депривации
| воздействие | Общая выборка | Высокоактивные | Низкоактивные |
| Интактные животные |
77±14 (а) 2.8±0.7 (б) (n=19) |
90±20 3.5+0.7 (n=11) |
58±18 1.9±0.6 (n=8) |
| Физ. р-р + стресс |
17±5 *** 0.8±0.2 *** (n=22) |
11±5 ** 0.4±0.2 *** (n=10) |
21±7 * 1.1±0.3 (n=12) |
| Даларгин (20 мкг/кг) |
48±12 # 1.8±0.4 # (n=23) |
76±20 ## 3.0±0.7## (n=11) |
22±8 @ 0.8±0.3 @@ (n=12) |
|
Даларгин + Налоксон (10 мг/кг) |
20±6 + 0.6±0.2 + (n=24) |
15±9 ++ 0.5+0.2 +++ (n=12) |
25±9 0.8+0.4 (n=12) |
(а) – время нахождения, (б) – количество выходов крыс в «открытый рукав» ПКЛ,
* – p<0.05, ** – p<0.01, *** – p<0.001 – достоверность отличия от интактных крыс;
# – p<0.05, ## – p<0.01, ### – p<0.001 – эффект даларгина;
@ – p<0.05, @@ – p<0.01 – отличие регистрируемых параметров у животных с высокой и низкой локомоторной активностью;
+ – p<0.05, ++ – p<0.01, +++ – p<0.001 – снятие налоксоном эффекта даларгина.
Приведены средние значения ± ошибка среднего.
В аналогичных тестах не было обнаружено анксиолитического действия селективного агониста ОР μ-типа ДАГО (Tyr-D-Ala-Gly-N-methyl-Phe-Gly-ol), то есть снижение тревожности животных под действием опиоидов, в первую очередь, опосредовано δ-ОР. Подтверждение этому было получено с использованием селективных антагонистов ОР δ1‑типа 7‑бензлиденналтрексон (BNTX) и δ2‑типа – налтрибен (NTB). При центральном введении даларгин оказывал анксиолитическое действие в дозах, в 1000 раз более низких, чем при внутрибрюшинном введении. Эффект также был более выражен у ВА крыс и блокировался селективными антагонистами δ-ОР. Причем BNTX блокировал анксиолитический эффект даларгина на ВА, но не на НА крыс (табл. 2).
Таким образом, даларгин как при внутрибрюшинном, так и при центральном введении оказывает блокируемое антагонистами ОР анксиолитическое действие на белых беспородных крыс в условиях стресса. Степень проявления и механизм этого действия зависит от исходной двигательной активности животных: более выраженный эффект пептида на крыс с высокой двигательной активностью опосредован ОР δ1 и δ2 типов. Анксиолитическое действие даларгина на НА животных наблюдается лишь при центральном введении и блокируется только высокими дозами антагониста δ2‑ОР.
Таблица 2. Влияние антагонистов δ1 (BNTX) и δ2 (NTB) ОР на анксиолитический эффект даларгина при центральном (внутрижелудочковом) введении
| воздействие | Общая выборка | Высокоактивные | Низкоактивные |
| Интактные животные |
38±9 (а) ** 2.4±0.5 (б) ** (n=14) |
46±9 * 3.4+0.7 * (n=7) |
30±16 * 1.3±0.3 (n=7) |
| Физ. р-р |
6±3 0.4±0.1 (n=23) |
9±6 0.4±0.3 (n=11) |
2±1.2 0.2±0.1 (n=12) |
| Даларгин (0.05 мкг/кг) |
42±6 ** 1.4±0.3 ** (n=44) |
64±10 * 2,2±0.4 * (n=19) |
26±7 * @ 1,0±0.3 (n=25) |
| Даларгин (0.05 мкг/кг) + BNTX (10 мкг/кг) |
14±5 # 0.8±0.2 (n=20) |
10±4## 0.6+0.2# (n=8) |
17±7 0.9+0.3 (n=12) |
| Даларгин (0.05 мкг/кг) + NTB (10 мкг/кг) |
7±2 ### 0.7±0.2 # (n=20) |
8±3 ## 0.8±0.3 # (n=9) |
6±3 # 0.6±0.3 (n=11) |
(а) – время нахождения, (б) – количество выходов крыс в «открытый рукав» ПКЛ,
* – p<0.05, ** – p<0.01, *** – p<0.001 – отличия от крыс, получавших физ. раствор;
# – p<0.05, ## – p<0.01, ### – p<0.001 – снятие эффекта даларгина антагонистами;
@ – p<0.05 – отличие регистрируемых параметров у ВА и НА животных
Приведены средние значения ± ошибка среднего.
Опиоидная система животных с различными проявлениями тревожности
Поведенческие проявления тревожности у животных и тревожные расстройства у людей, в первую очередь, определяются состоянием центральной нервной системы. Поэтому для оценки роли опиоидной системы в нейрохимических механизмах тревоги было исследовано состояние центральных ОР и активность эндогенных лигандов этих рецепторов и ферментов деградации опиоидных пептидов в мозгу животных с различными поведенческими характеристиками.
На первом этапе исследования была обнаружена взаимосвязь между уровнем тревожности крыс при тестировании их в «челночной камере» и вытесняющей активностью эндогенных опиоидов в гиппокампе, которую определяли радиолигандным методом, используя лей-энкефалин для построения калибровочной кривой. Было показано, что процесс тестирования в «челночной камере» в несколько раз повышает уровень эндогенных опиоидов в гиппокампе крыс. Причем максимальный выброс опиоидов происходит в гиппокампе тех животных, которые не переходят в безопасный отсек «челночной камеры» после условного сигнала (пассивная стратегия избегания) (рис. 1).
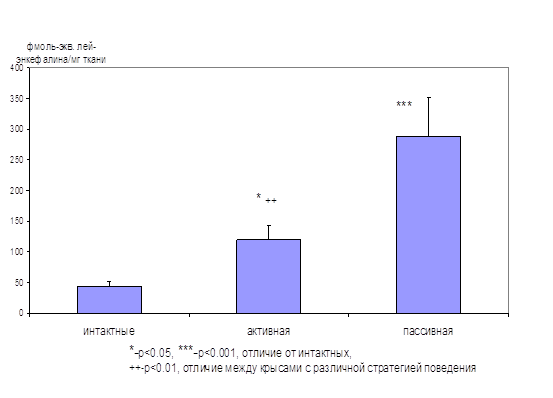
Рисунок. 1. Активность эндогенных лигандов ОР в гиппокампе крыс с различной стратегией поведения в «челночной камере»
Активная стратегия (19 крыс) – более 70% переходов в ответ на условный звуковой сигнал, пассивная (8 крыс) – остальные тестированные животные. Интактные животные (12) не были тестированы в «челночной камере». По оси ординат – способность уксуснокислых экстрактов из гиппокампов крыс вытеснять 3Н-ДАДЛЭ из ОР, нормированная в соответствии с калибровочной кривой, построенной с использованием лей-энкефалина.
Учитывая важную роль гиппокампа в регуляции эмоциональной сферы, но не болевой чувствительности, обнаруженные отличия скорее связаны с эмоциональным состоянием животных, уровнем их тревожности, чем с ноцицепцией. Отсутствие перехода на условный сигнал можно интерпретировать как сниженной способностью запоминать информацию об условном сигнале, так и пониженной тревожностью крыс. Результаты данного исследования дают основание утверждать, что противотревожную роль в этих условиях выполняют эндогенные опиоиды. Действительно, уровень опиоидов в гиппокампе крыс с пассивной стратегией поведения в 7 раз выше, чем у интактных животных (рис. 1), что, по-видимому, позволяет им преодолевать страх. Поэтому они не пытаются избегать боли и остаются в камере после условного сигнала. Косвенным подтверждением этому являются данные о том, что введение даларгина крысам приводит к изменению активной стратегии избегания на пассивную (Зозуля и соавт., 1996). Подобные эффекты обнаружены и при центральном введении селективного агониста δ1‑ОР (Ukai et al., 1997) и β-эндорфина (Flood et al., 1992).
Таким образом, у крыс с пассивной стратегией поведения в тесте «челночная камера», которую можно интерпретировать как относительно низкую тревожность, наблюдается значительно более высокий уровень эндогенных опиоидов в гиппокампе по сравнению с интактными животными и крысами с более высокой тревожностью. То есть, в условиях стресса в различных отделах мозга происходит усиление синтеза и секреции эндогенных опиоидов, которые оказывают анксиолитическое действие. В условиях хронического стресса, когда истощение запасов эндогенных опиоидов приводит к усилению поведенческих проявлений тревожности, становится более выраженным анксиолитическое действие их синтетических аналогов (табл. 1, Зозуля и соавт., 1999, Narita et al., 2006).
Для оценки состояния центральных ОР было проведено радиорецепторное определение констант связывания синтетического аналога лей-энкефалина Н-ДАДЛЭ с мембранной фракцией обонятельных луковиц и стриатума крыс. Стриатум был выбран как основной отдел мозга, отвечающий за двигательную активность, которая весьма существенна при тестировании поведения животных большинством использованных методов. Обонятельные луковицы, через которые поступает большая часть информации в мозг животных, особенно грызунов, являются одним из эмоциогенных отделов мозга.
Как было показано выше, при внутрибрюшинном введении агонист ОР даларгин оказывает анксиолитическое действие лишь в условиях стресса и не влияет на интактных животных. Поэтому в данном исследовании проводилось сравнение констант связывания ОР интактных и стрессированых животных. В качестве стрессорного воздействия были выбраны те же условия, что и для поведенческого тестирования, т.е. питьевая депривация крыс при пищевом режиме ad libitum. Перед началом стрессорного воздействия крысы были протестированы в ATS и в классическом варианте ОП, а по его окончании – в ПКЛ.
В нашем исследовании оказалось, что константы связывания ОР в стриатуме коррелируют с двигательной активностью крыс как в ATS, так и в ОП. Аффинность ОР стриатума к ДАДЛЭ у низкоактивных (НА) крыс выше, чем у высокоактивных (ВА) (табл. 3). Это соотношение отмечено как у интактных крыс, так и у крыс, подвергавшихся водной депривации. Cчитается, что Кд рецепторов может менять свои значения как из-за изменения микроокружения рецепторов (ионного состава среды, наличия оккупированных лигандами рецепторов других типов, липидного состава и состояния мембраны), так и по причине наличия нескольких типов или подтипов рецепторов, с которыми может взаимодействовать исследуемый лиганд. В нашем случае РРА проводится in vitro, поэтому причинами изменения Кд могли стать только изменение состояния мембраны или наличие нескольких подтипов ОР: μ-ОР, d1‑ОР и d2‑ОР.
Таблица 3. Константы связывания 3Н-ДАДЛЭ с центральными ОР у крыс с высокой (ВА) и низкой (НА) исходной двигательной активностью в ATS
| группы животных | Обонятельные луковицы | Стриатум | |||
| Кд (нМ) | Вмах (фмоль/мг белка) | Кд (нМ) | Вмах (фмоль/мг белка) | ||
| интактные | все | 2.9±0.2 (14) | 182±22 (14) | 2.4±0.2 (12) | 96±10 * (12) |
| ВА | 2.6±0.2 (8) | 179±33 (8) | 2.9±0.1## (7) | 114±27#* (7) | |
| НА | 3.0±0.3 (6) | 185±12 (6) | 2.0±0.3* (5) | 63±12** (5) | |
| стресс | все | 2.9±0.4 (9) | 170±27 (9) | 2.7±0.1 (14) | 100±7 (14) |
| ВА | 2.1±0.5## (4) | 152±14 (4) | 3.0±0.1#* (6) | 105±16 (6) | |
| НА | 3.8±0.3 (5) | 226±54 (5) | 2.4±0.2* (8) | 94±8* (8) | |
* – p<0.05, ** – p<0.01 – отличие констант связывания в различных отделах мозга,
# – p<0.05, ## – p<0.01 – отличие констант связывания ОР у НА и ВА животных
Приведены средние значения ± ошибка среднего.
По литературным данным сродство ДАДЛЭ к δ-ОР в 2 раза выше, чем к μ-ОР (Kd=1.5 и 3.2 нМ, соответственно, при тестировании методом вытеснения селективных лигандов из δ- и μ-ОР мозга крысы, Leslie, 1987). То же соотношение Кд при несколько других абсолютных значениях получено на трансгенных клетках, стабильно экспрессирующих эти рецепторы (Minami, Saton, 1995, George et al., 2000). Судя по значениям Кд, полученным в нашем исследовании (табл. 3), в стриатуме ВА крыс доминируют μ-ОР, а у НА δ-ОР вносят свой вклад в соотношение ОР. Полученные данные соответствуют представлению о том, что ОР стриатума принимают участие в регуляции локомоторной активности путем воздействия на дофаминергическую трансмиссию (Jang et al., 2001, Schad et al., 2002). Причем как на фармакологическом, так и на молекулярно-генетическом уровнях показано, что активация μ-, но не δ-ОР приводит к повышению локомоции (Jang et al., 2001, Gaveriaux-Ruff, Kieffer, 2002).
Анализ взаимосвязи состояния центральных ОР с уровнем тревожности в ПКЛ показал, что до стресса водной депривации у менее тревожных крыс (количество выходов в открытые рукава ПКЛ больше, чем среднее по выборке, >2), по сравнению с более тревожными, повышена плотность ОР как в стриатуме, так и в обонятельных луковицах (табл. 4). Это косвенно свидетельствует о том, что в норме ОР δ- и μ-типов опосредуют «противотревожные» функции эндогенных опиоидов.
Таблица 4. Константы связывания 3Н-ДАДЛЭ с центральными ОР крыс с различным уровнем тревожности в ПКЛ
| Число выходов в откр. рукава | Обонятельные луковицы | Стриатум | |||
|
Кд (нМ) |
Вмах (фмоль/мг белка) |
Кд (нМ) |
Вмах (фмоль/мг белка) | ||
|
ин- такт- ные |
0 | 2.6±0.3 (3) | 180±6## (3) | 2.3±0.3 (3) | 67±12#** (3) |
| 1–2 | 2.6±0.1# (6) | 178±28 (6) | 2.4±0.3 (4) | 81±9#* (4) | |
| 3–5 | 3.6±0.4 (3) | 261±15 (3) | 2.6±0.2 (4) | 132±12* (4) | |
| стресс | 0 | 3.8±0.1# (4) | 203±49 (4) | 2.5±0.5* (4) | 88±15* (4) |
| 1–2 | 2.6±0.5 (5) | 147±16 (5) | 2.7±0.5 (10) | 103±27 (10) | |
* – p<0.05, ** – p<0.01 – отличие констант связывания в различных отделах мозга,
#,## – p<0.05, 0.01 – отличие от низкотревожных (по соответствующей группе) животных
Приведены средние значения ± ошибка среднего.
В результате использованного типа стрессорного воздействия происходит выраженное увеличение тревожности крыс, на фоне которого, как показано нами ранее, проявляется анксиолитический эффект даларгина, при этом на интактных животных препарат не влияет (табл. 1). По-видимому, длительный выброс эндогенных опиоидов в результате хронического стресса приводит к истощению их запасов. Даларгин в этих условиях оказывает анксиолитическое действие по компенсаторному механизму.
С другой стороны, известно, что в результате длительного контакта с агонистами может происходить десенситизация рецепторов. В частности, выброс эндогенных опиоидов при хроническом стрессе приводит к десенситизации ОР, причем δ-ОР более подвержены этому процессу, чем μ-ОР (Gaudriault et al., 1997, Kim et al., 2003, Narita et al., 2006). В нашем исследовании радиолигандный анализ не выявил существенных изменений констант связывания 3Н-ДАДЛЭ в стриатуме крыс в результате стресса. В то же время Кд этого лиганда с ОР обонятельных луковиц у НА крыс значительно возросла и стала почти в 2 раза выше, чем у ВА крыс (табл. 4). Эта разница примерно соответствует литературным данным о соотношении аффинности ДАДЛЭ к μ- и δ-ОР (Leslie, 1987, Minami, Satoh 1995, George et al., 2000). То есть можно предположить, что в обонятельных луковицах ВА крыс доминируют δ-ОР, а у НА животных в этом отделе мозга в результате стресса произошла десенситизация этих рецепторов и доминируют μ-ОР. Обонятельные луковицы играют существенную роль как в исследовательской активности грызунов, так и в формировании тревоги и депрессии, что подтверждено в экспериментах с бульбектомией (Song, Leonard, 2005). Исследовательская активность является, одним из главных факторов, определяющих поведение животных в тесте ПКЛ. Десенситизация δ-ОР в обонятельных луковицах НА, но не ВА крыс (табл. 4), по-видимому, является одной из причин того, что даларгин, более селективный лиганд δ-ОР, чем μ-ОР, оказывает анксиолитическое действие только на ВА животных (табл. 1).
Известно также, ДАДЛЭ обладает более высокой аффинностью к δ1‑ОР, чем к δ2‑ОР (Minami, Satoh, 1995). Поэтому низкую аффинность ОР обонятельных луковиц НА крыс можно объяснить доминированием там δ-ОР второго типа. Фармакологические данные, полученные в данном исследовании подтверждают это предположение: анксиолитический эффект даларгина при центральном введении у ВА крыс блокируется антагонистами обоих подтипов δ-ОР, а у НА крыс – налтрибен, селективный антагонист δ2‑ОР, не блокирует анксиолитическое действие даларгина (табл. 2). Из литературных данных следует, что роль δ2‑ОР в противотревожном действии эндогенные опиоидов более существенна, чем δ1‑ОР, поскольку налтрибен, но не BNTX оказывает анксиогенное действие на животных (Saitoh et al., 2005). Схожесть некоторых функций δ2- и μ-ОР может быть следствием того, что свойствами δ2‑ОР обладает гетеродимер μ- и δ-ОР, связанных между собой внутриклеточными С-концевыми участками (Fan et al., 2005). В зависимости от активности синтеза отдельных рецепторных белков в различных органах и, возможно, отделах мозга варьируют формы олигомеризации ОР (George et al., 2000), что также может являться причиной вариабельности биологических эффект опиоидов, в частности, их участия в регуляции тревожности.
Как упоминалось ранее, в тесте Вогеля анксиолитическое действие даларгина более выражено у НА крыс. В этом тесте оценивается способность животных преодолевать конфликт между питьевой мотивацией и болевым раздражением, сопровождающим лизание поилки. Поэтому поведение животных в тесте Вогеля в значительной степени зависит от их болевой чувствительности, в регуляции которой μ-ОР играют более существенную роль, чем δ-ОР (Gaveriaux-Ruff, Kieffer, 2002). Можно предположить, что μ-ОР доминируют не только в обонятельных луковицах (табл. 4), но и в тех отделах мозга НА крыс, которые отвечают за ноцицепцию. Если это предположение верно, то анксиолитический эффект даларгина на НА крыс в тесте Вогеля можно отчасти объяснить его обезболивающим действием, опосредуемым μ-ОР.
Таким образом, в зависимости от состояния ОР, их соотношения в различных отделах мозга, анксиолитическое действие препаратов, взаимодействующих с этими рецепторами, может по-разному проявляться в разных тестах. Как исходный уровень тревожности, так и возможность воздействия на него экзогенно вводимыми опиоидами зависят от состояния ОР и от содержания эндогенных опиоидов в их микроокружении.
К эндогенным опиоидам, в первую очередь относят опиоидные пептиды, среди которых наиболее распространены и изучены энкефалины. Энкефалины – одни из самых короткоживущих регуляторных пептидов. Период их полураспада исчисляется минутами. Поэтому активность ферментов деградации энкефалинов может играть существенную роль как в поведенческих проявлениях тревожности у животных, так и в предрасположенности и формировании некоторых форм тревожных расстройств у людей. Попытка обнаружить взаимосвязь между активностью ЭДФ в целом мозгу мышей и выраженностью поведенческих проявлений тревожности в нашем исследовании не дала убедительных результатов. Это не удивительно, поскольку существует целый ряд ферментов, участвующих в деградации энкефалинов, и их активность существенно варьирует в различных отделах мозга (Gorenstein, Snyder, 1980). Более подробное исследование активности конкретных ферментов в различных отделах мозга, ответственных за реализацию отдельных поведенческих проявлений тревожности, безусловно, дадут положительные результаты.
Удалось также обнаружить взаимосвязь между поведенческими характеристиками и активностью ЭДФ, а также содержании эндогенных опиоидов в плазме крови животных. Так, разделение крыс на 3 группы в соответствии с исходной двигательной активностью в ATS продемонстрировало, что в условиях стресса тестирования в «челночной камере» у крыс с высокой двигательной активностью (ВА) содержание лигандов ОР μ-типа в плазме крови достоверно выше, чем у остальных животных. У низкоактивных (НА) крыс обнаружено пониженное содержание лигандов ОР δ-типа (табл. 5).
Таблица 5. Активность лигандов ОР (пмоль-экв. ДАГО или ДАДЛЭ/мл) в плазме крови крыс с различной двигательной активностью в ATS
| Тип лигандов ОР | Двигательная активность животных | ||
| низкая (n=28) | средняя (n=28) | высокая (n=28) | |
| μ – (3Н-ДАГО) | 55,5±3,1 ** | 57,8±3,0 | 70,7±4,1 |
| δ – (3Н-ДАДЛЭ) | 57.6±2.4 ** ++ | 76.6±6.1 | 82.0±5.1 |
** – p<0.01 – отличие от высокоактивных крыс,
++-p<0.01, +-p<0.05 – отличие от крыс со средней двигательной активностью,
Приведены средние значения ± ошибка среднего.
Обнаружены различия в активности ЭДФ плазмы крови мышей Balb/c и C57black/6 в условиях тестирования их в ОП, эмоционально-стрессовая реакция на которое у мышей этих линий кардинально отличается. Скорость деградации лей-энкефалина (150 нМ) в плазме крови мышей линии Balb/с, проявляющих повышенный уровень тревожности в ОП, составляет 50±6 нМ/мин, что на 30% выше (p<0.05), чем у низкотревожных в этом тесте мышей C57Black/6 (38±5 нМ/мин). Можно предположить, что повышенная скорость гидролиза эндогенных опиоидных пептидов является одной из биологических причин высокой тревожности животных, а фармакологические воздействия, направленные на замедление гидролиза энкефалинов, могут оказывать анксиолитическое действие.
Влияние селанка на опиоидную систему
Новый пептидный препарат селанк, синтезированный в ИМГ РАН, в преклинических испытаниях, проведенных в ГУ НИИ Фармакологии им. В.В. Закусова РАМН, проявил себя как анксиолитик, обладающий также ноотропным и стресс-протективным действием (Середенин и соавт., 1995, 1996, 1998). Вместе с тем, биологический механизм его действия до конца не изучен. Мы исследовали возможность участия опиоидной системы в механизме анксиолитического эффекта селанка.
Радиорецепторным способом было показано, что селанк и его тетрапептидный фрагмент тафтсин способны вытеснять Н-ДАДЛЭ из ОР головного мозга крыс, но в концентрациях, в 10000 и в 200 раз, соответственно, превышающих концентрацию метки. То есть мало вероятно, что механизм действия селанка опосредован его взаимодействием ОР, обладающими выраженной аффинностью к ДАДЛЭ (δ и μ-ОР).
В то же время, была продемонстрирована способность селанка и его пептидных фрагментов, тафтсина и Pro-Arg-Pro-Gly-Pro, замедлять скорость гидролиза лей-энкефалина ферментами плазмы крови человека и Р2 мембранной фракции мозга крысы (рис. 2). Способность ингибировать ЭДФ у селанка была более выражена, чем у таких известных ингибиторов энкефалиназ, как N-CMPL, D-PAM, лейпептин и пуромицин, но менее выражена, чем у бацитрацина (рис. 2).
Более подробное исследование с использованием ВЭЖХ продуктов гидролиза [G3H] – лей-энкефалина показало, что в тех условиях, когда селанк в 2 раза снижает активность аминопептидаз (основной группы ферментов, участвующих в деградации энкефалинов), он полностью блокирует гидролиз лей-энкефалина карбокси- и дикарбоксипептидазами (табл. 6). То есть можно предположить, что его сродство к ферментам последних двух групп выше, чем к аминопептидазам.

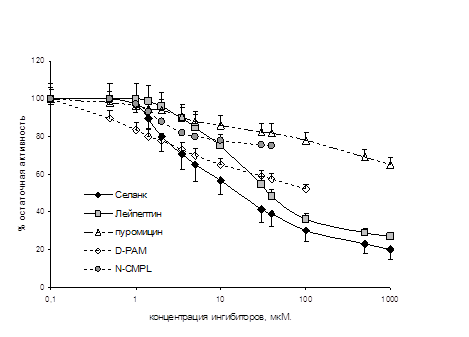 Б
Б
Рисунок 2. Ингибирующее действие селанка на энкефалиндеградирующие ферменты сыворотки крови человека (А) и Р2 мембранной фракции мозга крысы (Б)
При изучении процесса биодеградации [G3H] – селанка в плазме крови крысы in vitro обнаружилось, что в первую очередь его гидролиз происходит под действием дикарбоксипептидаз с последовательным отщеплением Gly-Pro, и Arg-Pro с С-конца. По этому же пути происходит гидролиз селанка в присутствии одной из основных дикарбоксипептидаз, участвующих в деградации энкефалинов – АПФ.
Таблица 6. Влияние селанка на активность ЭДФ плазмы крови человека in vitro
| Группы ЭДФ | фрагменты | Концентрация фрагментов (нМ) | |||
| t гидролиза (мин) | Контроль | селанк 15 мкМ | |||
| 30 | 30 | 90 | 120 | ||
| субстрат | YGGFL | 167 | 297 | 154 | 146 |
| Амино- | Y | 250 | 127 | 253 | 273 |
| пептидазы | GGFL | 216 | 100 | 202 | 228 |
| Диамино- | YG | 9 | 4 | 11 | 14 |
| пептидазы | GFL | 7 | 0 | 0 | 0 |
| Дикарбокси- | YGG | 19 | 1 | 3 | 5 |
| пептидазы | FL | 38 | 3 | 12 | 17 |
| Карбоксипептидазы | YGGF | 30 | 0 | 0 | 0 |
| другие фрагменты | GGF | 8 | 0 | 0 | 0 |
| GF | 21 | 0 | 0 | 0 | |
| F | 0 | 0 | 16 | 27 | |
Исходная концентрация 3Н-лей-энкефалина в инкубационной среде – 560 нМ.
Разделение продуктов ферментативного гидролиза проводили методом ВЭЖХ на колонке «Хромасил» 4x150 мм. Элюцию вели в линейном градиенте ацетонитрила в 0.1% ТФУ, скорость элюции 1 мл/мин при комнатной температуре.
Представлены типичные результаты одного из трех независимых экспериментов.
Среди продуктов деградации [G3H] – селанка в плазме крови крысы не обнаружен гексапептид KPRPGP, что свидетельствует о том, что моноаминопептидазы не участвуют в его гидролизе. Таким образом, селанк ингибирует ЭДФ, являясь субстратом для дикарбоксипептидаз, но не для моноаминопептидаз. Субстратами этих пептидаз являются, кроме энкефалинов, ряд других регуляторных пептидов, которые также участвуют в регуляции тревожности. Тем не менее, некоторые поведенческие эффекты селанка обусловлены его воздействием именно на опиоидную систему, о чем свидетельствует способность налоксона блокировать эти эффекты. Так, налоксон блокирует депримирующий эффект селанка на индуцированные апоморфином поведенческие проявления гиперфункции дофаминовой системы в тесте «вертикализации» мышей (Мешавкин и соавт., 2006).
Роль опиоидной системы в реализации анксиолитического действия селанка была подтверждена в экспериментальных исследованиях in vivo. На фоне повышенного уровня тревожности, вызванного процедурным стрессом внутрибрюшинного введения препарата, селанк оказывал блокируемое налоксоном анксиолитическое действие на мышей Balb/c в тесте ПКЛ (рис. 3). Причем этот эффект был значительно более выражен у мышей с исходно высокой спонтанной двигательной активностью в системе Rat-o-Matic (рис. 3), аналогично анксиолитическому эффекту даларгина, наблюдавшемуся в ПКЛ лишь у ВА (в ATS) крыс (табл. 1). Отсутствие снижения тревожности НА крыс под действием даларгина мы связывали с недостаточной экспрессией δ-ОР в некоторых отделах их мозга. Возможно, у НА мышей Balb/c наблюдается сходная картина: энкефалины, скорость гидролиза которых замедляет селанк, способны взаимодействовать как с δ-, так и с μ-ОР, оказывая через первые «противо-», а через вторые – «протревожное» действие. У НА мышей налоксон не блокирует, а наоборот, сам оказывает и усиливает анксиолитическое действие селанка (рис. 3), по-видимому, за счет блокады μ-ОР. Снижение тревожности при введении налоксона наблюдается у мышей с нокаут геном δ-ОР (Filliol et al., 2000), а также у высокотревожных мышей 129S2/SvHsd, не чувствительных к бензодиазепинам (Rodgers et al., 2006).
Анализ поведения мышей Balb/c в центральном квадрате ПКЛ, которое, с некоторой долей условности, можно рассматривать как аналог психомоторной активности животных, показал, что помимо анксиолитического селанк может оказывать психостимулирующее действие. Причем этот эффект более выражен у НА мышей и не блокируется, а наоборот усиливается налоксоном, хотя в данном случае сам налоксон не влиял на эту форму поведения животных. По литературным данным, как эндогенные (Gaveriaux-Ruff, Kieffer, 2002), так и экзогенно вводимые опиоиды влияют на локомоторную активность животных (Sandi, 1992, Baamonde et al., 1992, Jang et al., 2001, Schad et al., 2002). То есть психостимулирующий эффект селанка также может быть связан с активацией опиоидной системы.
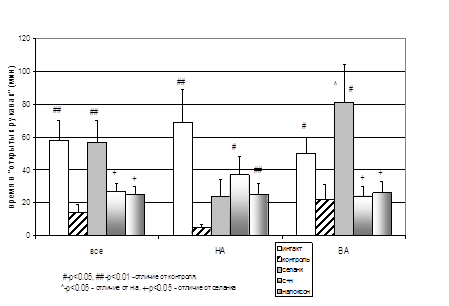
Рисунок 3. Влияние селанка на время нахождения в «открытых рукавах» ПКЛ мышей Balb/c с высокй (ВА) и низкой (НА) исходной двигательной активностью в системе Rat-o-Matic
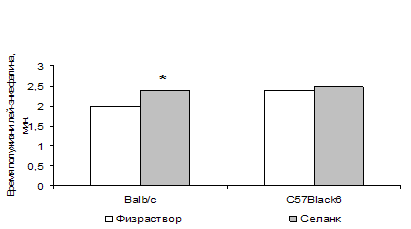
Рисунок 4. Влияние селанка на активность ЭДФ плазмы крови мышей Balb/с и C57Black/6, в условиях тестирования в «открытом поле» – эффект селанка, р<0.05
Как было продемонстрировано ранее, активность ЭДФ в плазме крови мышей Balb/с с фенотипом повышенной тревожности в тесте ОП существенно выше, чем у C57Black/6, эмоционально стабильных в этом тесте. При этом показано, что в тесте ОП селанк оказывает анксиолитическое действие на мышей Balb/с, но не C57Black/6 (Середенин и соавт., 1996). Мы воспроизвели вышеупомянутый поведенческий эксперимент, а затем у тех же животных измерили скорость гидролиза Н-лей-энкефалина в плазме крови и гомогенате мозга. Было установлено, что введение селанка (внутрибрюшинно, 100 мкг/кг) параллельно со снижением тревожности достоверно снижает скорость распада энкефалина в плазме крови мышей линии Balb/с. Вместе с тем, препарат не изменяет поведение мышей C57Black/6 и не влияет на активность энкефалиндеградирующих ферментов в плазме их крови (рис. 3). При этом достоверных изменений в активности ЭДФ гомогената мозга при введении селанка, ни у Balb/с, ни у C57Black/6 не наблюдается. Таким образом, можно утверждать, что один из механизмов поведенческих эффектов селанка связан с действием на опиоидную систему, поскольку анксиолитическое действие селанка на мышей Balb/с, регистрируемое в тесте ПКЛ, блокируется антагонистом ОР налоксоном, а анксиолитический эффект препарата на поведение мышей Balb/с, но не C57Black/6 в тесте «открытое поле» сопровождается снижением скорости распада энкефалинов в крови мышей Balb/с, но не C57Black/6.
Учитывая продемонстрированные в данном исследовании (табл. 1, 2) и неоднократно подтвержденные в дальнейшем другими авторами данные о «противотревожной» роли экзогенно вводимых агонистов δ-ОР (Vivian, Miczek, 1998, Saitoh et al., 2005, Perrine et al., 2006) и эндогенных опиоидных пептидов, в частности, энкефалинов (Ragnauth et al., 2001, Bilkei-Gorzo et al., 2004, McNally et al., 2004, Saitoh et al., 2004, 2005, Narita et al., 2006, Perrine et al., 2006), можно предположить, что высокая скорость гидролиза последних является одной из патогенетических причин повышенной тревожности. В связи с этим нами было проведено исследование активности ЭДФ в плазме крови здоровых людей с различными личностными проявлениями тревожности и больных с разными формами тревожных расстройств.
Известно, что гидролиз энкефалинов в организме происходит по всем пептидным связям и катализируется целым рядом ферментов. В данном разделе исследования оценивали суммарную активность ЭДФ в плазме крови людей in vitro по скорости гидролиза равномерно меченного тритием лей-энкефалина. Активность ЭДФ оценивали по двум параметрам: при насыщающих концентрации субстрата определяли максимальную скорость реакции (Vmax, по кривой Михаэлиса-Ментен), являющуюся суммой действующих концентраций всех ЭДФ, при малых концентрациях субстрата – время полупревращения энкефалина (τ1/2), отражающее реальную скорость гидролиза этого пептида в биологических объектах.
На первом этапе были рассмотрены возможные связи параметров энкефалиназной активности с данными психологического тестирования по тесту Айзенка. Данный тест позволяет определить уровень невротизации и интровертированности личности (рис. 5). Известно, что в зависимости от конституционально-личностных особенностей организма в условиях стресса возможно развитие широчайшего спектра психоэмоциональных и соматических реакций. На одном полюсе этого спектра «репрессивный стиль преодоления» людей-интровертов, сопровождающийся подавлением внешних проявлений эмоционального напряжения, угнетением секреции катехоламинов и активация гипофизарно-надпочечниковой системы, приводящая к выбросу опиоидных пептидов в кровь. На другом – «экспрессивная стратегия преодоления» экстравертов, сопровождающаяся высоким уровнем активации симпатоадреналовой системы при отсутствии выраженной реакции со стороны опиоидной системы (Bandura et al. 1990; Schroeder et al., 2000, Зозуля и соавт., 2006).
В подтверждение этого обнаружена обратная корреляционная связь уровня экстравертированности личности с τ 1/2 энкефалина по всей выборке обследованных людей (R = -0.41, p<0.01). Вероятно, у экстравертированных личностей, к которым относятся сангвиники, не существует, так называемой, сдерживающей реакции опиоидов, что подтверждается низким значением τ 1/2 лей-энкефалина. И, наоборот, у таких интровертов, как флегматики, реакция опиоидной системы гораздо более выражена, именно здесь она выступает в роли стресс-лимитирующей системы, подавляя вегетативные реакции на стресс или тревогу.
По-видимому, в условиях адекватного функционирования опиоидной системы не происходит избыточной активации симпатоадреналовой системы, эмоциональных срывов, перехода физиологической фазы стресса в патофизиологическую. Можно полагать, что высокое τ 1/2 лей-энкефалина в плазме крови флегматиков является фактором, повышающим их адаптационные возможности. Напротив, у меланхоликов τ 1/2 лей-энкефалина достоверно ниже, чем у флегматиков (рис. 5). Адаптационные возможности людей с этим типом темперамента снижены и они наиболее предрасположены к тревожным расстройствам (Gershuny, 1998).
Аналогичное предположение можно было бы сделать и относительно холериков и, особенно, сангвиников, обладающих минимальным τ 1/2 лей-энкефалина (рис. 5). Однако, существуют данные, что у экстравертов (холериков и сангвиников) опиоидная система в условиях развития хронической стрессовой реакции, по-видимому, не играет ключевой роли (Bohnen et al., 1991; Biondi et.al, 1994; Bruehl et al., 1994). Здесь, возможно, стресс-лимитирующую роль играют другие системы.
Обнаруженная зависимость τ 1/2 лей-энкефалина от темперамента людей не распространяется на Vmax, значение которого во всех группах неизменно (рис. 5). То есть, высокое значение τ 1/2 лей-энкефалина в крови флегматиков обусловлено, по-видимому, не низкой активностью ферментов, а повышенным содержанием их эндогенных ингибиторов. Полученные данные согласуются с данными Marini и соавт. (1999), также обнаружившими индивидуальную вариабельность в активности ЭДФ плазмы крови здоровых доноров, связанную, по мнению авторов, с различиями в концентрации эндогенных ингибиторов. Однако попыток связать полученные данные с определенными конституционально-личностными характеристиками обследованных доноров авторы не предприняли.
Шкала невротизма (эмоциональной нестабильности) в определённой степени отражает уровень тревожности, предрасположенности к тревожным расстройствам, которые формируются под воздействием как генетически обусловленных факторов, так и факторов окружающей среды. В подтверждение этому, в нашем исследовании была обнаружена корреляционная связь между уровнем личностной (врожденной) тревожности по тесту Спилбергера и показателями теста Айзенка у обследованных людей: положительная с невротизмом и отрицательная с экстравертированностью. Свидетельством компенсаторной роли опиоидной системы, видимо, можно считать достоверную прямую корреляцию между τ 1/2 лей-энкефалина в плазме крови и уровнем личностной тревожности, определяемой по тесту Спилбергера, т.е. высокий уровень врожденной тревожности у здоровых людей компенсируется низкой скоростью деградации энкефалина (табл. 7). Как видно из таблицы 7, высокий уровень врожденной тревожности по Спилбергеру сопровождается максимально высоким τ 1/2 энкефалина в крови, а лица с низким уровнем врожденной тревожности характеризуются минимальным значением этого параметра. При этом высокая скорость гидролиза лей-энкефалина в плазме крови людей с низким уровнем тревожности не связана с повышенным содержанием ЭДФ, т. к. значение Vmax, отражающее истинную концентрацию этих ферментов, в плазме крови этих людей достоверно ниже, чем у лиц с умеренной тревожностью. По-видимому, относительно высокое τ1/2 лей-энкефалина у людей с умеренной и высокой тревожностью поддерживается за счет наличия в их крови эндогенных ингибиторов энкефалиназ.
Таблица 7. Зависимость активности ЭДФ плазмы крови человека от уровня личностной тревожности, определяемой по тесту Спилбергера
| Уровень личностной тревожности | |||
| низкая | умеренная | Высокая | |
|
τ1/2, (мин) |
2.50±0.20* # (n=12) |
3.11±0.18 (n=24) |
3.65±0.22* (n=14) |
| Vmax, (мМ/мин) |
0.14±0.02* (n=12) |
0.21±0.02 (n=26) |
0.17±0.03 (n=14) |
* – p < 0.05, отличие от лиц с умеренной тревожностью,
# – p < 0.01, отличие между людьми с высокой и низкой тревожностью.
Итак, энкефалиназная активность плазмы крови связана с темпераментом здоровых людей (рис. 5), τ1/2 лей-энкефалина в плазме крови обратно коррелирует с уровнем экстравертированности и прямо – с уровнем личностной тревожности (табл. 7). Предполагается, что эти отличия, в первую очередь, обусловлены уровнем эндогенных ингибиторов энкефалиназ.
На следующем этапе были обследованы больные с различными формами тревожно-фобических расстройств по DSM‑4 (табл. 8). Выяснилось, что достоверные отличия показателей активности ЭДФ от регистрируемых в контроле величин наблюдаются при генерализованном тревожном расстройстве (ГТР). При паническом расстройстве значения параметров приближаются к норме, а при агорафобии даже превышают контрольный уровень (таблица 8), что, по-видимому, отражает поведенческую адаптацию: поведение избегания позволяет исключить стрессогенную при агорафобии ситуацию. Обнаружены корреляционные связи показателей активности ЭДФ со степенью выраженности вегетативных расстройств по Вейну и характеристиками панических атак, определяемых по методу Шихана, которые являются, по-видимому, отражением компенсаторной роли опиоидов в условиях реактивных расстройств, наблюдаемых у обследуемых больных.
Следует отметить, что при ГТР наблюдается одновременное снижение величин τ 1/2 и Vmax лей-энкефалина в плазме крови (табл. 8), что может быть связано с недостатком ингибиторов энкефалиназ при ГТР. То есть, истощение эндогенной опиоидной системы, выражающееся в недостатке эндогенных ингибиторов ЭДФ, по-видимому, является одним из механизмов стресс-индуцированных нарушений, существенных в патогенезе некоторых видов тревожных расстройств. Полученные в нашем исследовании данные позволяют предполагать, что ГТР является одной из таких нозологий. То есть стимуляция опиоидной системы с использованием синтетических аналогов опиоидных пептидов и / или ингибиторов энкефалиназ может рассматриваться в качестве патогенетически обоснованной терапии ГТР.
Таблица 8. Активность ЭДФ плазмы крови больных с разными формами ТФР
|
Диагноз по DSM‑4 |
τ1/2 (мин) |
Vmax, (мМ/мин) |
|
Генерализованное тревожное расстройство (n=13) |
2.6±0.2 # | 0.12±0.03 # |
|
Паническое расстройство (n=14) |
3.2±0.2 * | 0.16±0.04 |
|
Агорафобия (n=11) |
4.0±0.3 * ´´ | 0.18±0.04 |
| Здоровые доноры (n=15) | 3.1±0.3 | 0.20±0.02 |
# – p < 0.01 отличие от здоровых доноров, * – р < 0.01 отличие от ГТР, ´´ – р < 0.05 отличие от панического расстройства.
Приведены средние значения ± ошибка среднего.
Было высказано предположение, что для этих больных терапия селанком может оказаться эффективной (Зозуля и соавт., 2001). Действительно, вторая фаза клинических испытаний селанка показала его эффективность при лечении ГТР (Neznamov et al., 2005). Более того, по данным, любезно предоставленным А.В. Андрющенко (НЦ ПЗ РАМН), эффективность селанка при ГТР более выражена, чем при смешанном тревожно-депрессивном расстройстве и депрессивном эпизоде. Изучение зависимости биологических эффектов селанка от темперамента больных показало, что в результате лечения этим препаратом τ 1/2 лей-энкефалина в плазме крови интровертированных (по Айзенку) больных возрастает. Напротив, у больных с преобладанием экстраверсии этот параметр после лечения селанком не изменяется или даже снижается.
Данные, полученные в рамках третьей фазы клинических испытаний этого препарата, показали, что у больных ГТР и неврастенией наблюдается пониженный уровень τ 1/2 лей-энкефалина в сыворотке крови, который коррелирует с длительностью заболевания и выраженностью проявлений тревоги, астении и ряда других симптомов, а также вегетативных расстройств. Обнаруженный в данном исследовании преимущественно положительный характер корреляций между τ 1/2 и клиническими показателями можно трактовать двояко. На первый взгляд, тот факт, что чем ниже скорость деградации лей-энкефалина в крови больных, тем сильнее выражена тревожность и / или другие сопутствующие ей симптомы, свидетельствует о противотревожной роли энкефалиндеградирующих ферментов. Однако в настоящее время существуют многочисленные экспериментальные данные о том, что эндогенные опиоидные пептиды, в частности, энкефалины выполняют противотревожные функции в ЦНС, а ингибиторы ферментов деградации энкефалинов оказывают анксиолитическое действие (Gaveriaux-Ruff, Kieffer, 2002, Perrine, 2006).
В данном исследовании мы оценивали скорость гидролиза лей-энкефалина в сыворотке крови больных, что является косвенным отражением процессов, происходящих в ЦНС. Известно, что опиоидная система, наряду с другими пептидергическими системами, выполняет стресс-лимитирующие функции в организме. В частности, в условиях стресса происходит выброс опиоидных пептидов, в том числе, энкефалинов в кровь, через которую они реализуют свои компенсаторные функции на периферии. Наличие эндогенных энкефалинов в сыворотке крови должно уменьшать наблюдаемую скорость гидролиза меченого лей-энкефалина, по которой мы определяем τ 1/2 в данном исследовании. Возможно, в регуляции тревоги опиоидная система играет такую же компенсаторную роль, как и в стресс-реакции. Для адекватного функционирования организма в условиях повышенной тревожности нормальным является пропорциональная активация стресс-реализующих (катехоламины и глюкокортикоиды) и стресс-лимитирующих (регуляторные пептиды) систем. Примером может служить полученная нами ранее положительная корреляция между τ 1/2 лей-энкефалина в плазме крови здоровых людей и уровнем их врожденной тревожности по Спилбергеру (R=0.32, p<0.05, n=27) и концентрацией кортизола в плазме крови (r=0.58, p<0.05, n=27). По-видимому, в норме этой компенсаторной функции достаточно, для предотвращения развития патологических симптомов, а при ГТР, на фоне сниженного среднего значения τ ½, т.е. повышенной скорости ферментативного гидролиза энкефалинов, опиоидная система не обеспечивает подобной компенсации.
Кроме того, известно, что эти ферменты участвуют в гидролизе не только энкефалинов, но и многих других регуляторных пептидов, секретируемых в кровь в условиях стресса (Соколов и соавт., 2007). Эти пептиды могут замедлять процесс деградации лей-энкефалина по механизму субстратной конкуренции. Многие регуляторные пептиды, как и энкефалины выполняют стресс-лимитирующие функции, а в сумме они играют роль буфера, поддерживающего нормальное функционирование организма в условиях отклонения от гомеостаза. Таким образом, исследуемый нами параметр косвенно отражает степень активации системы регуляторных пептидов, ее способность поддерживать гомеостаз в условиях повышенной тревожности.
Клинические испытания продемонстрировали высокую эффективность селанка при терапии больных ГТР и неврастенией. Анксиолитическое действие этого препарата сравнимо с действием бензодиазепинового транквилизатора медазепама (рис. 9). При этом в отличие от медазепама селанк также оказывает антиастеническое и психостимулирующее действие (рис. 9). Как упоминалось ранее, один из механизмов анксиолитического действия селанка связан с ингибированием ферментов деградации энкефалинов, а также других пептидов, выполняющих противотревожные функции в ЦНС (Кост и соавт., 2007). Энкефалины могут участвовать и в реализации психостимулирующего эффекта селанка, поскольку в эксперименте с использованием других ингибиторов ферментов, их расщепляющих, показана способность этих пептидов стимулировать двигательную активность животных (Michael-Titus, 1990, Cordonnier, 2005). Этот механизм действия селанка кажется более вероятным при его интраназальном введении, сопровождающемся непосредственным попаданием препарата в мозг (Золотарев и соавт., 2006).
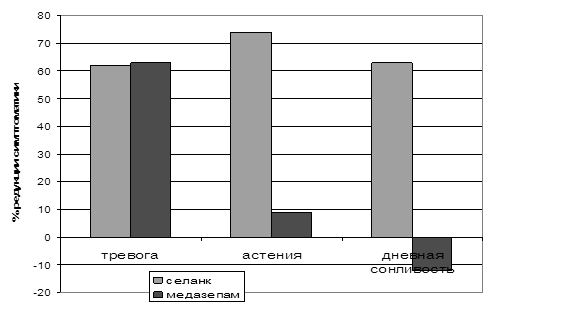
Рисунок 9. Процент редукции выраженности основных симптомов, характерных для ГТР и неврастении в результате терапии селанком и медазепамом
Изменение τ ½ лей-энкефалина в сыворотке крови больных в результате лечения скорее является косвенным отражением процессов, происходящих в ЦНС, чем результатом действия селанка на периферические ферменты деградации энкефалинов. Тем не менее, в результате лечения селанком, но не медазепамом происходит повышение среднего значения τ 1/2 лей-энкефалина в сыворотке крови больных (рис. 10). Увеличение этого параметра происходит преимущественно у больных ГТР. Анализ индивидуальных данных выявил возрастание τ 1/2 лей-энкефалина в сыворотке крови 13 из 16 больных ГТР. Следует отметить большую продолжительность заболевания у 3 больных ГТР, τ 1/2 лей-энкефалина в сыворотке крови которых в результате лечения снизилось (>1 года). Возможно, при длительном течении ГТР происходит более основательная перестройка пептидергических систем, косвенным подтверждением чему можно считать положительную корреляцию между τ 1/2 и продолжительностью заболевания. У больных неврастенией увеличение τ 1/2 лей-энкефалина в сыворотке крови в результате лечения селанком происходит лишь в половине случаев, а у остальных больных наблюдается снижение значений этого параметра. В результате при этой нозологии клинический эффект селанка не сопровождается увеличением среднего времени циркуляции регуляторных пептидов в крови (рис. 10).
О положительном прогностическом значении исследуемого параметра свидетельствует корреляция между исходными величинами τ 1/2 лей-энкефалина в сыворотке крови больных и степенью редукции астении и гиперестезии при терапии селанком (табл. 9). При терапии медазепамом (n=14) такая закономерность наблюдалась для ряда симптомов: тревога (по шкале Гамильтона, R=0.66, p=0.01), повышенная раздражительность (R=0.79, p<0.001), аффективная лабильность (R=0.61, p=0.02), локальные витальные ощущения (R=0.85, p=0.0001). По общей выборке больных исходные значения τ ½ коррелируют с эффективностью терапии к концу курса, оцениваемой по одноименной субшкале шкалы общего клинического впечатления (R=-0.30, p<0.05, n=48), и величиной изменения «выраженности заболевания» по той же шкале (R=0.29, p<0.05, n=47).
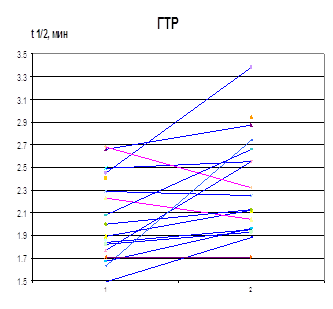
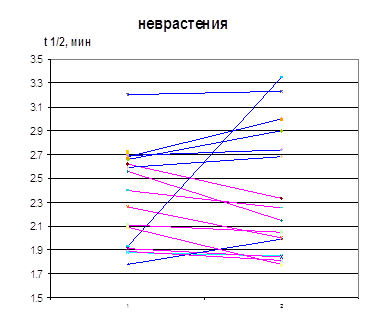
Рисунок 10. Влияние терапии селанком на период полупревращения лей-энкефалина в сыворотке крови больных ГТР и неврастенией (1 – до, 2 – после терапии)
Степень редукции выраженности тревоги, астении, гипотимии и ряда других симптомов в результате терапии селанком коррелирует с τ 1/2 лей-энкефалина в сыворотке крови больных после лечения (табл. 9). Характер этих корреляций свидетельствует о том, что при низкой степени редукции симптоматики сохраняется повышенная активность симпатоадреналовой и гипоталамо-гипофизарной систем, которая, в случае терапии селанком компенсируется относительно высоким содержанием регуляторных пептидов в крови. По-видимому, в наибольшей степени это касается тревоги, потому что степень редукции преимущественно ее симптомов коррелирует со степенью увеличения времени полужизни энкефалина в крови (Δτ ½) (табл. 9).
Таблица 9. Взаимосвязь редукции показателей выраженности симптоматики и активности ЭДФ в крови больных при терапии препаратом селанк
| Степень редукции симптомов | τ ½ до | τ ½ после | Δτ ½ |
| Тревога по шкале Цунга | -0,37 * (34) | -0.38 * (33) | |
| Тревога по ШОВС (N) | -0.52 ** (30) | ||
| Повышенная раздражительность (N) | -0,41 * (31) | -0.37 * (30) | |
| Аффективная лабильность (N) | -0,39 * (30) | ||
| Пониженное настроение (N) | -0.56 * (20) | ||
| Астения | 0,34 * (36) | ||
| Апатия (N) | -0,49 * (20) | ||
| Сонливость | -0,34 * (34) | ||
| Гиперестезия | 0,39 * (36) | -0.40 * (33) |
достоверность корреляций * р<0.05, ** р<0.01
(N) – степень редукции данного симптома нормирована на исходное значение показателя шкалы
Приведены лишь достоверные показатели значений коэффициента корреляции (R).
Итак, экспериментальные и клинико-биологические данные свидетельствуют о наибольшей выраженности анксиолитического эффекта селанка в условиях повышенной активности энкефалиндеградирующих ферментов. При этом эффект селанка сопровождается увеличением времени полужизни энкефалина в крови. Это является дополнительным подтверждением связи одного из механизмов действия селанка с его способностью влиять на активность ферментов деградации энкефалина.
Воздействие на эндогенную опиоидную систему как способ коррекции соматических проявлений тревоги
Поведенческие проявления тревоги у животных и тревожные расстройства у людей, как правило, сопровождаются различного рода изменениями на соматическом уровне. Нами на уровне экспериментальных исследований было продемонстрировано, что анксиолитическое действие селанка и даларгина у животных сопровождается коррекцией стресс-индуцированных соматических нарушений сердечно-сосудистой и иммунной систем. На данном этапе работы были выбраны те же условия, в которых проводилось тестирование анксиолитического действия даларгина и селанка.
Так, ранее при тестировании тревожности мышей Balb/c в ПКЛ было обнаружено, что внутрибрюшинные уколы физиологического раствора значительно повышают их тревожность и на этом фоне селанк оказывает выраженное анксиолитическое действие, которое блокируется налоксоном (рис. 3). В исследовании, проведенном по той же схеме на 48 мышах-самцах линии Balb/c, удалось обнаружить кардиотропный эффект селанка. Повышение тревожности, вызванное введением физиологического раствора, сопровождалось стойким повышением ЧСС мышей по сравнению с контрольными животными (632±25 и 527±16 ударов/мин в среднем за 5 мин наблюдения, соответственно, p<0.01). На этом фоне однократное введение селанка (100 мкг/кг) достоверно снижает ЧСС мышей (496±26 ударов/мин в среднем за 5 мин наблюдения) по сравнению с животными, получившими уколы физиологического раствора (p<0.01).
На рисунке 11 представлена динамика сердечного ритма мышей, наблюдавшаяся в течение 5 мин с момента введения электродов мышам, не получавшим до этого никаких инъекций («интактные»), и животным, которым за 30 мин до этого ввели физиологический раствор или селанк. Из рисунка видно, что непосредственно после введения электродов ЧСС «интактных» мышей значительно выше, чем на 2–5 минутах наблюдения (622±17 и 478±23 ударов/мин в первые и последние 30 сек из 5 мин наблюдения, соответственно, p<0.01). Очевидно, это связано с процедурным стрессом введения электродов. Судя по ЧСС, этот стресс сопоставим со стрессом уколов физиологический раствор. Однако, в отличие от «интактных» животных, у мышей, получивших укол физиологический раствор в течение 5 мин тестирования не наблюдается релаксации (снижения сердечного ритма), что соответствует поведенческим данным о повышенной тревожности мышей этой линии, наблюдаемой через 30 мин после укола физиологический раствор (рис. 3).
Введение селанка предотвращает повышение ЧСС мышей в момент введения электродов (460±34 ударов/мин в первые 30 сек наблюдения, p<0.01 по сравнению с тем же показателем у «интактных» животных) и на всем протяжении тестирования достоверно снижает ЧСС мышей по сравнению с животными, получившими уколы физиологический раствор. Сердечный ритм мышей, получивших селанк, в течение 5 минут тестирования достоверно не меняется и остается на уровне ЧСС «интактных» мышей к моменту релаксации после процедурного стресса.
Таким образом, в данном исследовании нам удалось обнаружить кардиотропный эффект селанка, который проявляется в том, что введение этого препарата снижает тахикардию, вызванную как анксиогенным для мышей Balb/c стрессом внутрибрюшинно введения физиологический раствор, так и процедурным стрессом введения электродов.
Рисунок 11. Влияние селанка на динамику сердечного ритма мышей Balb/c в условиях процедурного стресса. ЧСС измеряли в течение 5 мин с момента подкожного введения электродов «интактным» мышам и мышам, получившим внутрибрюшинно инъекции физиологический раствор или селанка (100 мкг/кг) за 30 мин до начала тестирования
*, **, *** – p<0.05, 0.01, 0.001 отличие от ЧСС мышей, получавших физиологический раствор, измеренной в тот же временной интервал.
В настоящее время доказано, что эндогенные опиоидные пептиды, в частности, лей- и мет-энкефалины обладают кардиопротективными свойствами. Помимо центрального действия на эмоциогенные зоны мозга и ядра, отвечающие за вегетативную регуляцию сердечно-сосудистой системы, опиоидные пептиды влияют на симпатическую и парасимпатическую регуляцию сердца и кровеносных сосудов, предотвращая избыточный выброс медиаторов из нервных окончаний соответствующих вегетативных нейронов и нивелируя гиперактивацию адренергических рецепторов на уровне трансмембранной передачи. Считается, что таким путем эндогенные опиоиды предотвращают развитие аритмии, гипертрофии сердца и апоптоз кардиомиоцитов в условиях гиперактивации симпатической нервной системы, например, при хроническом стрессе (Pepe et al., 2004). Кроме того, опиоидные пептиды играют существенную роль в кардиогенезе, выживаемости кардиоцитов в условиях ишемии, репаративных процессах при инфаркте миокарда (Peart et al., 2005).
Таким образом, использование Селанка как ингибитора ферментов деградации эндогенных опиоидных пептидов (энкефалинов) при лечении больных, у которых тревожные расстройства сопровождаются сердечно-сосудистыми заболеваниями, патогенетически вполне обоснованно.
Исследование иммуномодулирующего действия даларгина также проводили в условиях анксиогенного стресса, сопровождающего тестирование животных в «челночных камерах». Изучали пролиферативную активность лимфоцитов крови 84 крыс-самцов популяции Wistar, прошедших обучение в «челночной камере» и получивших после этого пятидневный курс внутрибрюшинного введения физиологического раствора (контрольная группа) или даларгина (20 мкг/кг). В процессе исследования определяли спонтанную пролиферацию лимфоцитов и пролиферативную активность, стимулированную КонА в различных дозах. Затем экстраполяцией кривой доза-эффект вычисляли ту дозу митогена, при которой наблюдается максимальная пролиферация, и определяли индекс стимуляции лимфоцитов по соотношению оптимальной и спонтанной пролиферации. По общей выборке не было обнаружено достоверных отличий между уровнем пролиферации лимфоцитов крови контрольных крыс и крыс, получавших даларгин. Введение даларгина лишь понизило чувствительность клеток к митогену: оптимальная концентрация КонА повысилась от 10.8±1.2 (в контрольной группе) до 14.1±1.0 мкг/мл (p<0,05).
В процессе статистической обработки результатов животные были разбиты на 3 подгруппы в соответствии с их исходной двигательной активностью в ATS. В результате обнаружилось, что спонтанная пролиферация лимфоцитов крыс со «средней» двигательной активностью (СА) значительно ниже, чем у высоко – (ВА) и низко (НА) активных животных (табл. 10). Величина спонтанной пролиферации в значительной степени отражает функциональную активность лимфоцитов in vivo. Ее изменение может происходить не только под воздействием попадающих в организм антигенов (вирусы, бактерии, искусственная иммунизация и т.д.), но и в результате действия стрессогенных факторов, воздействующих на иммунную систему через ЦНС и нейроэндокринную систему (Pedersen, 1991). Повышение спонтанной пролиферации лимфоцитов НА и ВА крыс по сравнению с СА животными говорит о включении последнего механизма, поскольку с точки зрения антигенных воздействий все животные находились в одинаковых условиях. Возможно, это результат стресса, вызванного обучением в «челночных камерах».
Таблица 10. Влияние даларгина (внутрибрюшинно, 5 дней, 20 мкг/кг ежедневно) на пролиферативную активность лимфоцитов крови крыс популяции Wistar, прошедших курс обучения в «челночной камере»
| показатели пролиф. активн. | Вводимый препарат | Двигательная активность животных | ||
| низкая (n=28) | средняя (n=28) | высокая (n=28) | ||
| Спонтанная пролиферация | физ. р-р | 1114±172 ** | 453±98 | 783±110 * |
| даларгин | 639±55 ** # | 399±44 | 834±135 ** | |
| Оптимальная пролиферация | физ. р-р | 18380±3873 ** | 39680±3490 | 55247±10860++ |
| даларгин | 38899±9375 # | 38502±5073 | 39871±8231 | |
| Индекс стимуляции | физ. р-р | 24±6 ** | 128±26 | 80±19 * ++ |
| даларгин | 49±8 ** # | 102±13 | 63±12 * | |
| Оптимальная конц. КонА | физ. р-р | 11.4±1.6 | 10.4±1.5 | 10.6±1.2 |
| даларгин | 15.9±1.7 | 12.2±0.8 | 14.2±1.0 # | |
** p<0.01, * p<0.05 – отличие от среднеактивных,
++ p<0.01 – отличие между высоко- и низкоактивными,
# p<0.05 – эффект даларгина.
Приведены средние значения ± ошибка среднего.
Введение даларгина практически в 2 раза снижает спонтанную пролиферацию лимфоцитов крови НА крыс и не влияет на этот параметр у СА и ВА животных (табл. 10).
Пролиферативный ответ лимфоцитов крови на оптимальную дозу КонА возрастает по мере увеличения исходной двигательной активности исследуемых животных. Оптимальная пролиферация лимфоцитов крови НА крыс в 2 раза ниже, чем у СА крыс, и в 3 раза ниже, чем в группе ВА животных (табл. 10). Введение даларгина оказывает нормализующий эффект на этот параметр: в 2 раза увеличивает его у НА, не влияет на СА и снижает, хотя и в виде тенденции, у ВА крыс. В результате после введения даларгина пролиферация лимфоцитов в присутствии оптимальной дозы КонА во всех группах крыс становится одинаковой (табл. 10). Еще один параметр пролиферативного иммунного ответа – индекс стимуляции лимфоцитов оптимальной дозой митогена – отражает функциональный резерв ответа иммунокомпетентных клеток на митогенный стимул с учетом их исходного состояния. С точки зрения «резервных» способностей лимфоцитов крови, оцениваемых по этому параметру, в наиболее выгодном состоянии находится иммунная система СА крыс: по сравнению с ними индекс стимуляции лимфоцитов у ВА крыс снижен в 1.5 раза, а у НА – в 5 раз (табл. 10). Курсовое введение даларгина в 2 раза повышает индекс стимуляции в группе НА и не влияет достоверно на остальных животных (табл. 10).
Анализ индивидуальных величин концентраций КонА, при которых наблюдается максимальный пролиферативный ответ лимфоцитов крови, показал отсутствие различий по этому параметру между животными выделенных групп (табл. 10). Введение даларгина понизило чувствительность лимфоцитов к митогену у всех животных, но наиболее выражено этот эффект наблюдался у ВА крыс (табл. 10).
Обучение в «челночной камере» является тестом, основанным на выработке условного рефлекса, подкрепляемого аверсивным стимулом, предъявление которого, по определению, сопровождается тревожной реакцией у животного. Анксиолитический эффект даларгина в этом тесте, выражающийся в снижении реактивности на условный сигнал, был обнаружен лишь у ВА крыс. В этой же группе животных под действием даларгина снизилась повышенная в результате стресса реактивность лифоцитов на КонА (табл. 10). Несмотря на отсутствие видимых поведенческих эффектов даларгина на НА крыс в тесте «челночная камера», этот пептид оказал выраженное стимулирующее влияние на иммунную систему НА животных, подавленную в результате хронического анксиогенного воздействия.
Таким образом, анксиолитическое действие селанка и даларгина на животных сопровождается коррекцией стресс-индуцированных соматических нарушений на уровне сердечно-сосудистой и иммунной систем. Селанк снижает тахикардию, индуцированную процедурным стрессом у мышей Balb/c, а курсовое введение даларгина оказывает нормализующий иммуномодулирующий эффект на фоне стресса, вызванного обучением в «челночной камере».
Заключение
Таким образом, собственные и литературные данные свидетельствуют об участии опиоидной системы в регуляции уровня тревожности. Биологические механизмы вариабельности анксиолитических эффектов препаратов, воздействующих на опиоидную систему, связаны с гетерогенностью опиоидных рецепторов, соотношением процессов экспрессии и десенситизации различных их подтипов, синтеза и деградации эндогенных опиоидов. Так, связанный с модуляцией опиоидной системы анксиолитический эффект селанка проявляется в условиях повышенной активности ферментов деградации эндогенных опиоидов. Установлено, что коррекция состояния опиоидной системы с использованием пептидных препаратов может с успехом применяться при терапии некоторых форм тревожных расстройств, сопровождающихся истощением эндогенной опиоидной системы, в частности, ГТР. В заключение можно сказать, что стимуляция опиоидной системы агонистами ОР дельта-типа и ингибиторами ЭДФ сопровождается анксиолитическим эффектом на фоне генетически обусловленной или определяемой внешней средой недостаточности функциональной активности эндогенной опиоидной системы.
Выводы
1. Синтетический аналог энкефалинов даларгин, преимущественно взаимодействующий с опиоидными рецепторами (ОР) дельта-типа, но не ДАГО, лиганд ОР мю-типа, снижает поведенческие проявления тревожности животных в тестах «Открытое поле», «Приподнятый крестообразный лабиринт» (ПКЛ), «Конфликтный тест Вогеля», «Челночная камера» как при центральном, так и при периферическом введении. Анксиолитический эффект даларгина наблюдается на фоне дополнительных стрессорных воздействий, приводящих к повышению уровня тревожности, и зависит от исходного поведенческого статуса животных.
2. Обнаружены отличия в плотности и аффинности центральных ОР к лиганду δ- и μ-ОР ДАДЛЭ, активности эндогенных лигандов ОР в гиппокампе и в плазме крови, скорости деградации лей-энкефалина в плазме крови животных с различными поведенческими проявлениями тревожности.
3. Обнаружена взаимосвязь между активностью энкефалиндеградирующих ферментов (ЭДФ) плазмы крови и конституционально-личностными характеристиками людей. Время полупревращения (τ1/2) лей-энкефалина в плазме крови здоровых людей прямо коррелирует с уровнем личностной тревожности по Спилбергеру и обратно – с уровнем экстравертированности по Айзенку. В условия развития генерализованного тревожного расстройства (ГТР) различия по τ1/2 между пациентами с различным уровнем экстравертированности нивелируются. При этом τ1/2 лей-энкефалина в плазме крови больных ГТР положительно коррелирует с выраженностью ряда симптомов тревожной, астенической и гипотимической групп, а также вегетативных расстройств, присущих этому заболеванию.
4. В плазме крови больных ГТР достоверно снижено как τ1/2, так и максимальная скорость реакции гидролиза лей-энкефалина по сравнению со здоровыми донорами и больными агорафобией и паническим расстройством, что свидетельствует о недостатке эндогенных ингибиторов ЭДФ у больных ГТР.
5. Селанк и его пептидные фрагменты, тафтсин и Pro-Arg-Pro-Gly-Pro, ингибируют активность ЭДФ плазмы крови человека и мембранной фракции мозга крысы in vitro. Наиболее выражено ингибирующее действие селанка на дикарбоксипептидазы, которые, в частности, ангиотензинпревращающий фермент, непосредственно участвуют в его гидролизе.
6. Один из механизмов поведенческих эффектов селанка связан с действием на опиоидную систему: анксиолитическое действие селанка на мышей Balb/с, регистрируемое в тесте ПКЛ, блокируется антагонистом ОР налоксоном. Анксиолитический эффект препарата на мышей Balb/с, с фенотипом повышенной тревожности в тесте «открытое поле» сопровождается снижением скорости распада энкефалинов в их крови. Ведение селанка резистентным к анксиолитическому действию этого препарата мышам C57Black/6 не влияет на активность ЭДФ в их крови.
7. Выраженный клинический эффект селанка наблюдается при ГТР, характеризующемся недостатком эндогенных ингибиторов ЭДФ. В результате терапии селанком, но не медазепамом происходит повышение среднего значения τ 1/2 лей-энкефалина в сыворотке крови больных ГТР.
8. Анксиолитическое действие селанка и даларгина на животных сопровождается коррекцией стресс-индуцированных соматических нарушений на уровне сердечно-сосудистой и иммунной систем. Селанк снижает тахикардию, индуцированную процедурным стрессом у мышей Balb/c. На фоне стресса, вызванного обучением в «челночной камере», курсовое введение даларгина оказывает нормализующий эффект на Т-клеточное звено иммунитета крыс.
9. Стимуляция опиоидной системы агонистами ОР дельта-типа и ингибиторами ЭДФ вызывает анксиолитический эффект на фоне генетически обусловленной или определяемой внешней средой недостаточности функциональной активности эндогенной опиоидной системы. Использование подобных препаратов патогенетически обосновано при терапии и профилактике тревожных расстройств и стресс-индуцированных нарушений сердечно-сосудистой и иммунной систем.
Список основных публикаций по теме диссертации
1. Зозуля А.А., Пацакова Э., Кост Н.В. Изучение взаимодействия эндогенных опиатов с лимфоцитами периферической крови человека. Журн. невропат. и псих., 1982, Т. 82, №5, с. 60–63.
2. Kost N.V., Pacakova E., Zozulya A.A. A comparative study of the morphine effect on the level of cyclic AMP in lymphocytes of smokers and nonsmokers. Biol. Psychiatry, 1983, V. 18, №7, р. 763–769.
3. Pacakova E., Kost N.V., Zozulya A.A. Interakcia opiatov s lymfocytmi cloveka. Československa psychiatrie. 1985, V. 81, N.1, p. 45–47.
4. Зозуля А.А., Пацакова Э., Кост Н.В., Иванушкин А.М., Воронкова Т.Л. Исследование влияния β-эндорфина и миелопептидов на уровень цАМФ и пролиферацию лимфоцитов in vitro. Бюлл. Эксп. Биол. Мед., 1986, Т.102, №12, С. 731–733.
5. Zozulya A.A., Kost N.V., Pshenichkin S. Ph., Shurin M.R., Toropov A.V., Meshavkin V.K., Smolkin Yu.S. Opioid system in neuroimmunomodulation: methods and mechanisms of immunocorrection Abs. of 1 Baltic See Conference of Psychosomatics and Psychotherapy. – Kiel (Germany), 1992. – P.34.
6. Zozulya A.A., Kost N.V. Hierarchy of mechanisms determining the variability of opioids neuroimmunomodulation. Abs. 2nd In-ternational Congress ISNIM, Paestum (Saleno), Italy, 1993, P.135.
7. Kost N., Toropov A., Meshavkin V., Lukacher N., Butenko O., Barsegyan G., Zozulya A. The synthetic opioid and stimulation of endogenous opioid system in stress-protection: multifactor study of immunomodulative effects variability Abs. 2nd International Congress ISNIM, Paestum (Saleno), Italy, 1993, P.155.
8. Кост Н.В., Мешавкин В.К., Щурин М.Р., Торопов А.В., Зозуля А.А. Стресс-лимитирующее иммуномодулирующее действие транскраниальной электростимуляции опиоидергических структур головного мозга. Бюлл. СО РАМН, 1994, №4, С. 71–74.
9. Kost N., Toropov A., Meshavkin V., Butenko O., Barsegyan G., Zozulya A. Reactivity of nervous and immune system of rats with different locomotor activity: the significance of endogenous and synthetic opioids Abs. of The Congress «Immuno Neuroendocrine Interactions in Autoimmune and Infectious Diseases», Rio De Janeiro, 1994.
10. Kost N., Toropov A., Meshavkin V., Butenko O., Barsegyan G., Zozulya A. The influence of dalargin on stress-induced alteration of immunity in rats with different locomotor activity Abs. of the First World Congress on Stress, Bethesda, USA, 1994.
11. Kost N.V., Zozulya A.A. Immunomodulative effects of opioids: mechanisms of variability Abs. Second Baltic Sea Conference on Psychosomatic Medicine, Goteborg, Sweden, 1995.
12. Zozulya A., Kost N., Toropov A., Sokolov O., Meshavkin V., Shurin M., Gurevich K., Surkina I. Possible role of opioids in relationship between reactivities of nervous and immune systems Abstr. Third Annual Symposium on AIDS, Drugs of Abuse and Neuroimmune Axis, San Diego, USA, 1995, P.38.
13. Kost N., Zozulya A. Opioids in immunocorrection: sources of variability Abstr. of Symposium on AIDS, Drugs of Abuse and Neuroimmune Axis, San Juan, USA, 1995, P.21.
14. Зозуля А.А., Кост Н.В., Торопов А.В., Мешавкин В.К., Бутенко О.Б., Барсегян Г.Г. Зависимость иммуномодулирующих и поведенческих эффектов опиоидного пептида даларгина от характеристик высшей нервной деятельности крыс Иммунология, 1996, №5, С. 25–29.
15. Мешавкин В.К., Торопов А.В., Кост Н.В., Ильинский О.Б., Суркина И.Д., Зозуля А.А. Повышение физической работоспособности под влиянием транскраниальной электростимуляции Бюлл. Эксп. Биол. Мед., 1996, Т.122, №8, С. 128–130.
16. Sokolov O., Kost N., Koptelov O., Surkina I., Toropov A., Mouhin A., Gurevich K., Zozulya A. Stress-related mental disorders: anxiety and possible role of opioids Abstr. of Symposium on AIDS, Drugs of Abuse and Neuroimmune Axis, San Juan, USA, 1996, P.42.
17. Суркина И.Д., Кост Н.В., Торопов А.В., Масликов А.Т., Мешавкин В.К., Гуревич К.Г. Активность опиоидной системы в условиях острого психоэмоционального стресса и возможность ее коррекции. Вестн. спорт. мед., 1997, 2 (15), с. 36.
18. Зозуля А.А., Кост Н.В., Суркина И.Д., Мешавкин В.К., Гуревич К.Г., Торопов А.В., Зорин В.Ю., Соколов О.Ю., Мухин А.А. Возможная роль опиоидной системы в развитии тревожных расстройств В кн. «Тревога и обсессии» (ред. А.Б. Смулевич) Москва, 1998, С. 332–333.
19. Гуревич К.Г., Торопов А.В., Кост Н.В. Поэтапный статистический анализ свободного поведения животных Журнал ВНД, 1998, т. 48, Вып.6, С. 1123–1128.
20. Зозуля А.А., Мешавкин В.К., Торопов А.В., Гуревич К.Г., Кост Н.В. Анксиолитическое действие даларгина на поведение крыс в конфликтном тесте Вогеля и «Приподнятом крестообразном лабиринте». Бюлл. Эксп. Биол. Мед., 1999, Т.127, N2, С. 211–214.
21. Зозуля А.А., Степура О.Б., Кост Н.В., Акатова Е.В., Пак Л.С., Мартынов А.И. Эндогенные опиоиды при заболеваниях сердечно-сосудистой системы Кардиология 1999, Т. 7, С. 40–48.
22. Eshe C., Makarenkova V.P., Kost N.V., Lotze M.T., Zozulya A.A., Shurin M.R. Functional delta-type opioid receptors on dendritic cells Ann. N.Y. Acad. Sci., 1999, V 885, P.387–390.
23. Eshe C., Makarenkova V.P., Kost N.V., Lotze M.T., Zozulya A.A., Shurin M.R. Opioid Peptides Other Immune Targets: Dendritic Cells Neuroimmunomodulation, 1999, V.6, P.216–217.
24. Соколов О.Ю., Габаева М.В., Иванов С.В., Кост Н.В., Алфимова М.В., Гуревич К.Г., Зозуля А.А., Смулевич А.Б. Связь общей энкефалиназной активности плазмы крови с конституционально-личностными характеристиками человека Тезисы 13‑го съезда психиатров России, Москва, 2000, стр. 370.
25. Зозуля А.А., Соколов О.Ю., Иванов С.В., Кост Н.В., Габаева М.В., Акатова Е.В., Пак Л.С., Степура О.Б., Смулевич А.Б., Мартынов А.И. Энкефалиназная активность и уровень кортизола в крови больных с тревожно-фобическими расстройствами Тезисы 13‑го съезда психиатров России, Москва, 2000, стр. 359.
26. Sokolov O, Gabaeva M, Kost N, Alfimova M, Gurevich K, Zozulya A Blood plasma total «enkephalinase» aсtivity depends on human personality Abs. At. International conference on cell surface aminopeptidases, 2000, Nagoya, Japan, P.55.
27. Sokolov O, Gabaeva M, Kost N, Alfimova M, Gurevich K, Zozulya A. Blood plasma total «enkephalinase» aсtivity depends on human personality. In Book «Cell-surface aminopeptidases: basic and clinical aspects», by Elsevier Science, Amsterdam, 2001, P.413–415.
28. Makarenkova V.P., Esche C., Kost N.V., Shurin G.V., Rabin B.S., Zozulya A.A., Shurin M.R. Identification of delta – and mu-type opioid receptors in human and murine dendritic cells. Journal of Neuroimmunology, 2001, V.117, P.68–77.
29. Кост Н.В., Соколов О.Ю., Габаева М.В., Гривенников И.А., Андреева Л.А., Мясоедов Н.Ф., Зозуля А.А. Ингибирующее действие семакса и селанка на энекефалиндеградирующие ферменты сыворотки крови человека. Биоорганическая химия. 2001, Т.27, №3, С. 180 – 183.
30. Зозуля А.А., Кост Н.В., Соколов О.Ю., Габаева М.В., Гривенников И.А., Андреева Л.А., Золотарев Ю.А., Иванов С.В., Андрющенко А.В., Мясоедов Н.Ф., Смулевич А.Б. Ингибирующий эффект селанка на активность энкефалиндеградирующих ферментов как один из возможных механизмов его анксиолитического действия. Бюл. Эксп. Биол. Мед., 2001, т. 131, №4, С. 376–378.
31. Зозуля А.А., Кост Н.В., Соколов О.Ю., Габаева М.В., Гривенников И.А., Андреева Л.А., Золотарев Ю.А., Иванов С.В., Андрющенко А.В., Мясоедов Н.Ф., Смулевич А.Б. Ингибирование энкефалиндеградирующих ферментов – новый подход к терапии тревожных расстройств невротического уровня. Тезисы 3‑ей международной конференции «Биологические основы индивидуальной чувствительности к психотропным средствам», г. Суздаль 15 -18 мая, 2001 г., С. 66.
32. Соколов О.Ю., Кост Н.В. Лекарство для меланхоликов Химия и жизнь 2001, №10, С. 20–25.
33. Макаренкова И.П., Кост Н.В., Щурин М.Р. Система дендритных клеток: роль в индукции иммунитета и в патогенезе инфекционных, аутоиммунных и онкологических заболеваний. Иммунология. 2002 г., Т.23, №2, С. 68–76.
34. Соколов О.Ю., Мешавкин В.К., Кост Н.В., Зозуля А.А. Сравнительный анализ поведенческих эффектов селанка и его действия на активность энкефалиндеградирующих ферментов плазмы крови мышей с различным фенотипом эмоционально-стрессовых реакций. Бюл. Эксп. Биол. Мед., 2002 г., Т.133, №2, С. 158–161.
35. Зозуля А.А., Кост Н.В., Соколов О.Ю., Золотарев Ю.А., Мясоедов Н.Ф., Смулевич А.Б., Вариабельность анксиолитического эффекта пептидных препаратов, взаимодействующих с опиоидной системой. Тезисы 9 го Российского национального конгресса «Человек и лекарство», Москва, 2002 г., С. 618.
[1] Отбор больных с тревожно-фобическими расстройствами проводили на основании клинических данных, полученных сотрудниками отдела пограничной психической патологии и психосоматических расстройств ГУ НЦ ПЗ РАМН д.м.н. С.В. Ивановым и другими (руководитель отдела – академик РАМН, профессор А.Б. Смулевич)
[2] Больные были выявлены по обращению в амбулаторный отдел ГУ НЦ ПЗ РАМН сотрудниками отдела пограничной психической патологии и психосоматических расстройств к.м.н. А.В. Андрющенко и другими.
[3] Исследование происходило на базе отдела пограничной психической патологии и психосоматических расстройств ГУ НЦ ПЗ РАМН с участием сотрудников отдела к.м.н. А.В. Андрющенко, Е.В. Серебряковой и к.м.н. О.А. Сиранчиевой и на базе ГКПБ №12 сотрудниками ГУ НИИ фармакологии им. В.В. Закусова РАМН к.м.н. С.А. Сюняковым, к.м.н. Е.В. Телешовой и Т.С. Сюняковым (под руководством проф. Г.Г. Незнамова)
© 2009 База Рефератов