
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Понятие и роль в патологии цитокинов
Реферат: Понятие и роль в патологии цитокинов
Понятие и роль в патологии цитокинов
Иммунология и аллергология
ОГЛАВЛЕНИЕ
История
Общее понятие
Полная классификация
Свойства
Общий механизм действия
Основные свойства некоторых цитокинов
Провоспалительные цитокины
Роль
Литература
ИСТОРИЯ
В процессе эволюции живых существ возникли многоклеточные организмы. По мере усложнения их строения происходила специализация функций разных клеток и состоящих из них органов: пищеварения, дыхания и других. На определенном этапе эволюции в многоклеточном организме появились клетки, призванные защищать организм от микробов-паразитов. Постепенно сформировалась особая система органов и клеток, обеспечивающих защиту (иммунитет) организма от микробов-паразитов, которая получила название иммунной системы. Клетки, входящие в состав иммунной системы, были названы иммунокомпетентными.
Все эти клетки происходят из единой родоначальной стволовой клетки костного мозга, которая дает начало разным линиям клеток: гранулоцитов, моноцитов, Т-лимфоцитов, В-лимфоцитов и других (рис. 1). Т-лимфоциты для окончательного созревания перемещаются из костного мозга в тимус, а оттуда расселяются в селезенку и лимфоузлы, проходя через кровоток и лимфоток. В-лимфоциты, так же как гранулоциты и моноциты, проходят созревание в костном мозге, откуда зрелые клетки выходят в кровяное русло. В-лимфоциты также могут покидать кровяное русло, оседая в селезенке и лимфоузлах, и превращаться в плазматические клетки. Моноциты, выходя из кровеносных сосудов, попадают в разные органы и ткани, превращаются в тканевые макрофаги. Гранулоциты проходят свой жизненный цикл внутри сосудов, циркулируя в крови, а покидают сосудистое русло только в случае особой необходимости, то есть непосредственной угрозы вторжения и распространения по организму микробов-паразитов. Такая угроза возникает, например, при ранении, когда нарушается целостность защитного барьера кожи или слизистой оболочки. Рана служит входными воротами для микробов-паразитов. Проникновение микробов через входные ворота, их размножение в тканях организма служат сигналом мобилизации защитных клеток на борьбу с микробами [ 1].
Каким образом защитные клетки, циркулирующие в крови или осевшие в органах и тканях иммунной системы, отдаленных от входных ворот, получают и воспринимают сигнал опасности микробной агрессии? Как обеспечивается строгая последовательность включения отдельных типов клеток в борьбу с инфекцией? Откуда узнает иммунная система, какие именно защитные механизмы следует использовать при данной инфекции?
Чтобы найти ответы на эти вопросы, необходимо познакомиться с семейством молекул, получивших название цитокины. Название отражает основное назначение этих молекул, которые являются переносчиками, передатчиками сигналов от клетки к клетке (по латыни клетка называется cytos). В геноме клетки имеются специальные гены, ответственные за синтез определенных цитокинов. До поры до времени эти гены молчат, ничем не проявляя своего присутствия. Однако стоит только клетке распознать внедрение в организм микробов-паразитов, гены цитокинов переходят в активное состояние. С этих генов считывается информация о структуре соответствующих молекул, идет белковый синтез, и готовые молекулы цитокинов начинают выделяться (секретироваться) клеткой в окружающую среду. Для восприятия и распознавания различных сигналов, в том числе от внедрившихся микробов-паразитов, клетки несут на своей поверхности специальные сложно устроенные молекулы-рецепторы. Для каждого цитокина существует свой особый рецептор, к которому молекула цитокина подходит, как ключ к замку. Как только ключ-цитокин входит в скважину предназначенного для него замка-рецептора, с поверхности клетки к ядру передается соответствующий сигнал включения определенных генов в этой клетке: информация передана, воспринята и реализуется.
Цитокины, являясь своеобразным межклеточным языком, позволяют клеткам общаться, взаимодействовать, объединяя свои усилия в борьбе с микробами-паразитами. На внедрение и размножение микробов организм отвечает мобилизацией защитных клеток и продукцией защитных молекул - иммунным ответом. Чтобы иммунный ответ состоялся, оказался достаточно эффективным, выполнил свои защитные функции и был своевременно выключен за ненадобностью, необходимы четкие межклеточные взаимодействия, которые обеспечиваются цитокинами.
История изучения цитокинов началась в 40-е гг. ХХ века. Именно тогда были описаны первые эффекты кахектина — фактора, присутствовавшего в сыворотке крови и способного вызывать кахексию или снижение веса тела. В дальнейшем данный медиатор удалось выделить и показать его идентичность фактору некроза опухолей (TNF). В то время изучение цитокинов проходило по принципу обнаружения какого-либо одного биологического эффекта, служившего отправной точкой для названия соответствующего медиатора. Так в 50-е гг. назвали интерферон (IFN) из-за способности интерферировать, т.е. мешать размножению вируса, и тем самым повышать сопротивляемость при повторной вирусной инфекции.
Следующий этап изучения цитокинов, относящийся к 60–70 гг., связан с очисткой природных молекул и всесторонней характеристикой их биологического действия. К этому времени относится открытие Т-клеточного ростового фактора, известного теперь как IL-2, и целого ряда других молекул, стимулирующих рост и функциональную активность Т-, В-лимфоцитов и других типов лейкоцитов. В 1979 г. для их обозначения и систематизации был предложен термин "интерлейкины", то есть медиаторы, осуществляющие связь между лейкоцитами. Однако очень скоро выяснилось, что биологические эффекты цитокинов распространяются далеко за пределы иммунной системы, и поэтому более приемлемым стал ранее предложенный термин "цитокины", сохранившийся и по сей день. Революционный поворот в изучении цитокинов произошел в начале 80-х гг. после клонирования генов интерферона мыши и человека и получения рекомбинантных молекул, полностью повторявших биологические свойства природных цитокинов. Вслед за этим удалось клонировать гены и других медиаторов из данного семейства. Важной вехой в истории цитокинов стало клиническое применение рекомбинантных интерферонов и особенно рекомбинантного IL-2 для лечения рака. 90-е гг. ознаменовались открытием субъединичного строения рецепторов цитокинов и формированием понятия "цитокиновая сеть", а также открытием новых цитокинов путем генетического анализа.
ОБЩЕЕ ПОНЯТИЕ
Цитокины — небольшие пептидные информационные молекулы. Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Термин предложен англ. S. Cohen в 1974 г.
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
· провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
· противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
· регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
ПОЛНАЯ КЛАССИФИКАЦИЯ
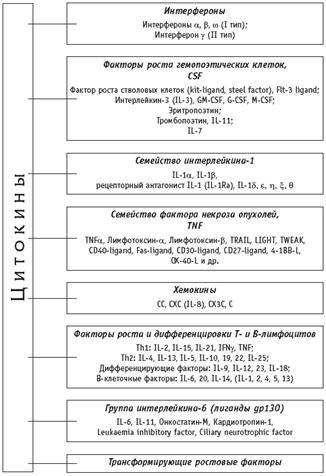
СВОЙСТВА
1. Цитокины являются полипептидами или белками, часто гликозилированными, с молекулярной массой (ММ) от 5 до 50 кДа. Для сравнения: ММ IgG составляет 160 кДа.
2. Цитокины не имеют антигенной специфичности биологического действия. Они влияют на функциональную активность клеток, принимающих участие в реакциях врожденного и приобретенного иммунитета. Тем не менее, воздействуя на Т- и В-лимфоциты, цитокины способны стимулировать антиген-зависимые процессы в иммунной системе.
3. Синтез цитокинов является индуцибельным процессом. Большинство цитокинов не синтезируется клетками вне воспалительной реакции и иммунного ответа. Экспрессия генов цитокинов начинается в ответ на проникновение в организм патогенов, антигенное раздражение или повреждение тканей. Одними из наиболее сильных индукторов синтеза цитокинов служат компоненты клеточных стенок бактерий: липополисахариды, пептидогликаны и мурамилдипептиды.
4. Цитокины синтезируются в ответ на стимуляцию через короткий промежуток времени. Синтез прекращается за счет разнообразных механизмов ауторегуляции, включая повышенную нестабильность РНК, и существования отрицательных обратных связей, опосредуемых простагландинами, кортикостероидными гормонами и другими факторами.
5. Один и тот же цитокин может продуцироваться различными по гистогенетическому происхождению типами клеток организма в разных органах.
6. Цитокины обладают плейотропностью биологического действия. Один и тот же цитокин может действовать на многие типы клеток, вызывая различные эффекты в зависимости от вида клетокмишеней.
7. Для цитокинов характерна взаимозаменяемость биологического действия. Несколько разных цитокинов могут вызывать один и тот же биологический эффект либо обладать похожей активностью.
8. Биологические эффекты цитокинов опосредуются через специфические клеточные рецепторные комплексы, связывающие цитокины с очень высокой аффинностью, причем отдельные цитокины могут использовать общие субъединицы рецепторов. Каждый цитокин связывается со своим специфическим рецепторным комплексом, однако, все рецепторы цитокинов, представляющие собой трансмембранные белки, могут быть разделены на 5 основных типов. Наиболее распространен так на зываемый первый тип рецепторов, имеющих два экстраклеточных домена, один из которых содержит общую последовательность аминокислотных остатков WSXWS. Второй тип рецепторов также имеет два внеклеточных домена с большим количеством консервативных цистеинов. Третий тип представлен рецепторами цитокинов, относящихся к группе фактора некроза опухолей. Четвертый тип рецепторов цитокинов принадлежит к суперсемейству иммуноглобулиновых рецепторов, имеющих внеклеточные домены, напоминающие строение доменов молекул иммуноглобулинов. Наконец, пятый тип рецепторов, связывающих молекулы семейства хемокинов, представлен трансмембранными белками, пересекающими клеточную мембрану в 7 местах. Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способность связывать лиганды.
9. Цитокины индуцируют либо подавляют синтез самих себя, других цитокинов и их рецепторов, участвуя в формировании цитокиновой сети.
10. Цитокины могут быть ассоциированными с мембранами синтезирующих их клеток, обладая в виде мембранной формы полным спектром биологической активности.
11. Цитокины могут влиять на пролиферацию, дифференцировку и функциональную активность клеток-мишеней. Существует несколько вариантов проявления биологической активности в зависимости от участия различных внутриклеточных систем в передаче сигнала от рецептора, что связано с особенностями конкретных клеток-мишеней. Цитокины могут оказывать антиапоптотическое действие посредством проведения сигнала с участием bcl2 и связанных с ним белков. Митогенное действие с активацией синтеза ДНК осуществляется с участием c-Myc, mTOR, CdK. Оба описанных сигнала приводят к поддержанию жизнеспособности и длительному росту клеток. Напротив, сигнал к апоптозу проводится с участием специфического участка рецепторов группы TNF, так называемого домена "смерти" (death domain). Дифференцировочный сигнал, приводящий к выбору пути развития либо терминальной дифференцировки клеток, осуществляется с участием внутриклеточных белков STAT (сигнальные трансдукторы и активаторы транскрипции). G-белки участвуют в передаче сигнала от хемокинов, что приводит к усилению миграции и адгезии клеток.
12. Цитокины действуют на клетки различными путями: аутокринно — на клетку, синтезирующую и секретирующую данный цитокин; паракринно — на клетки, расположенные вблизи клетки-продуцента, например, в очаге воспаления или в лимфоидном органе; эндокринно — дистантно на клетки любых органов и тканей после попадания цитокина в циркуляцию. В последнем случае действие цитокинов напоминает действие гормонов.
ОБЩИЙ МЕХАНИЗМ ДЕЙСТВИЯ
Влияние цитокина осуществляется путем его взаимодействия со специфическим мембранным рецептором клетки-мишени. Для цитокинов характерно плейотропное действие, которое объясняется наличием специфических рецепторов на поверхности клеток различного гистогенеза. В большинстве случаев рецепторы для цитокинов представлены одной, двумя или тремя пептидными или гликопротеидными цепями, встроенными в клеточную мембрану. При этом цитокин взаимодействует с внешней, экстрацеллюлярной, частью рецептора. Сигнал о такого рода взаимодействии передается внутрь клетки интрацеллюлярной частью рецептора, которая обладает ферментативной активностью. Эффективность действия рецептора зависит от его аффинности, т. е. от того, какое минимальное келичество лиганда необходимо для образования прочного комплекса и как следствие для передачи специфического сигнала внутрь клетки. Как правило, аффинность зависит от числа белковых цепей, входящих в состав рецептора. При этом вторая цепь может быть общей у ряда рецепторов с разной специфичностью.
ОСНОВНЫЕ СВОЙСТВА НЕКОТОРЫХ ЦИТОКИНОВИЛ-1. Этот интерлейкин могут синтезировать различные клетки соединительной ткани, как связанные с системой кроветворения, так и не имеющие к ней никакого отношения. ИЛ-1 существует в виде двух полипептидов ИЛ-la и ИЛ-1b, синтез которых кодируется различными генами. Обе эти формы образуются из соответствующих молекул-предшественников, имеющих одинаковую молекулярную массу (31 000). Предшественник ИЛ-la (про-ИЛ-la) биологически активен и способен соединяться с рецептором в форме димера. ИЛ-1b приобретает способность связываться с рецептором для ИЛ-1 только после ферментативного расщепления, в результате которого образуется конечный продукт с молекулярной массой 17 500. Этот процесс катализируется определенным ферментом — ИЛ-1b-конвертирующим энзимом (ICE).
Преобладающей формой ИЛ-1 является ИЛ-1b (количество соответствующей мРНК, обнаруживаемое в активированных клетках, в 10—50 раз превышает количество мРНК для ИЛ-la). Описано два вида рецептора для ИЛ-1 (ИЛ-1Р). ИЛ-1Р с молекулярной массой 80000 (рецептор I типа) выявляется на Т-лимфоцитах и фибробластах. ИЛ-1Р с молекулярной массой 68 000 (рецептор II типа) характерен для нейтрофилов, моноцитов, клеток костного мозга и В-лимфоцитов (интактных и трансформированных вирусом Эпштейна — Барр). Оба рецептора, принадлежащих к суперсемейству иммуноглобулинов, хотя и кодируются различными генами, имеют идентичную ИЛ-1-связывающую область.
Биологические свойства ИЛ-1 ярко демонстрируют его полифункциональность. ИЛ-1 играет одну из центральных ролей в воспалительной реакции, в ответе на бактериальную инфекцию и тканевые повреждения, вызванные ультрафиолетовым излучением. ИЛ-1 проявляет свойства нейроэндокринного гормона, стимулируя продукцию АКТГ, простагландинов и являясь митогеном для астроцитов. ИЛ-1 стимулирует продукцию ИЛ-2 Т-лимфоцитами, а также повышает экспрессию рецептора для ИЛ-2. ИЛ-1 усиливает пролиферацию В-лимфоцитов, секрецию антител и экспрессию мембранного иммуноглобулинового рецептора. Есть данные, указывающие на участие ИЛ-1 в регенерации печени. Кроме того, ИЛ-1 стимулирует секрецию гепатоцитами сывороточных амилоидов А и Р, С-реактивного белка, гаптоглобина, a, -антитрипсина и церулоплазмина. ИЛ-1 участвует в регуляции температуры тела, а повышенная его продукция приводит к развитию лихорадки.
Известны факторы, снижающие биологическую активность ИЛ-1. К ним прежде всего относятся глюкокортикоиды и простагландины. Из экзогенных факторов следует указать на циклоспорин А. В сыворотке крови лиц, которым был введен эндотоксин, в моче лихорадящих больных, а также в культуральной жидкости моноцитов, активированных in vitro, может быть обнаружен полипептид, специфически снижающий активность ИЛ-1. Из мочи больных моноцитарным лейкозом выделен фактор с молекулярной массой 23 000, идентифицированный как антагонист ИЛ-1Р. ИЛ-1Р II типа могут обнаруживаться в растворимой форме в виде мономера. Такой растворимый ИЛ-IP может связывать ИЛ-1, нейтрализуя его биологическую активность.
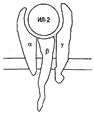
Строение высокоаффинного рецептора для ИЛ-2.
Для проведения сигнала требуется гетеродимеризация цитоплазматических доменов b- и g-цепей.
ИЛ-2. Этот цитокин с молекулярной массой 15 000 (25 000 у мышей) также играет исключительно важную роль в реализации механизмов иммунного ответа. Как уже отмечалось, продуцентами ИЛ-2 являются Th1 -клетки. Помимо участия ИЛ-2 в дифференцировке и пролиферации Т-лимфоцитов, этот лимфокин принимает непосредственное участие в реализации механизмов противоопухолевой защиты. Так, ИЛ-2 повышает литическую активность NK-клеток, а также индуцирует клетки системы ЛАК (лимфокинактивированные киллеры). Кроме того, ИЛ-2 индуцирует пролиферацию ЦТЛ. Под действием ИЛ-2 усиливается секреция ИНФg Т-лимфоцитами.
Рецептор для ИЛ-2 (ИЛ-2Р) состоит из трех полипептидных цепей, которые могут быть экспрессированы как вместе, так и по отдельности (рис. 12). В зависимости от того, из скольких цепей будет составлен рецептор, изменяется его аффинность. Так, при экспрессии только одной a-цепи (молекулярная масса 55 000) рецептор обладает наиболее низкой аффинностью с константой диссоциации (Кd) около 10 нМ. Такой рецептор, обозначаемый иногда как ТАС-антиген, имеет очень небольшую цитоплазматическую часть и после связывания ИЛ-2 не способен проводить сигнал внутрь клетки. При изолированной экспрессии b-цепи (молекулярная масса 75 000) формируется рецептор средней аффинности (Кd около 1 нМ). Такой рецептор при наличии достаточно высоких концентраций ИЛ-2 способен проводить сигнал. Есть основания полагать, что р-цепь экспрессируется вместе с g-цепью (молекулярная масса 64 000), так как для проведения сигнала требуется гетеродимеризация цитоплазматических доменов b- и g-цепей. При совместной экспрессии всех трех цепей формируется рецептор высокой аффинности (Кd около 10 пкМ).
Функция ИЛ-2Р может быть заблокирована с помощью фармакологических препаратов. Так, показано, что циклоспорин А подавляет синтез мРНК для а-цепи ИЛ-2Р. Есть данные, указывающие на то, что нецитотоксические дозы алкилирующих препаратов способны избирательно блокировать р-цепь ИЛ-2Р.
ИЛ-3. Этот белок относится к семейству гемопоэтических ростовых факторов (молекулярная масса 15 000 — 28 000), является колониестимулирующим фактором гранулоцитов-макрофагов. ИЛ-3 вместе с эритропоэтином поддерживает рост и дифференцировку клеток эритроидного ростка. В то же время ИЛ-3 способен регулировать раннюю стадию дифференцировки В-лимфоцитов, поддерживает рост пре-В-клеток, а также усиливает секрецию IgG.
ИЛ-4. Этот лимфокин (молекулярная масса 15000—20000) продуцируется Т-клетками (Th2) и является фактором дифференцировки для Т- и В-лимфоцитов. Кроме того, ИЛ-4 служит кофактором пролиферации покоящихся В-лимфоцитов, а также индуцирует в этих клетках синтез IgE и IgG.,. Известна способность ИЛ-4 генерировать активность ЛАК и усиливать противоопухолевую активность макрофагов.
ИЛ-5. Этот димерный белок с молекулярной массой 50 000—60 000 продуцируется Т-клетками (Th2). ИЛ-5 усиливает пролиферацию активированных В-лимфоцитов, а также экспрессию на них рецептора для ИЛ-2 и синтез IgA. В нестимулированных В-клетках ИЛ-5 индуцирует секрецию IgM и IgG. ИЛ-5 является фактором дифференцировки эозинофилов, усиливает их хемотаксис.
ИЛ-6. Этот мономер с молекулярной массой 19 000— 34 000 является фактором дифференцировки В-клеток, способствуя созреванию В-лимфоцитов в антителопродуцирующие клетки. ИЛ-6 индуцирует синтез белков острой фазы, в связи с чем, как и ИЛ-1, и TNF, может быть отнесен к цитокинам воспаления.
Фактор некроза опухолей (TNF). Этот фактор был впервые получен в результате введения мышам бактериальных эндотоксинов. В сыворотке крови было обнаружено вещество, обладающее цитотоксической активностью по отношению к опухолевым клеткам. TNF представляет собой полипептид с молекулярной массой около 17 000. TNF продуцируют клетки моноцитарно-макрофагальной системы, которые под воздействием бактериальных эндотоксинов активируются и начинают синтезировать TNF, ИЛ-1, ИЛ-6 и вещества прокоагулянтного действия. TNF является мощным модификатором воспалительной и иммунной реакции. Он способен тормозить клеточную пролиферацию, дифференцировку и функции клеток почти всех типов, служит медиатором цитотоксичности. В результате высвобождения TNF повышается проницаемость капилляров, повреждается эндотелий сосудов, возникает внутрисосудистый тромбоз. В настоящее время признано, что TNF играет ведущую роль в патогенезе септического шока.
Интерфероны. Эти белки обладают противовирусной и иммуномодулирующей активностью. В зависимости от происхождения и соответственно строения молекулы интерферона (ИФН) человека делятся на 3 типа: ИФНa, продуцентами которого преимущественно являются макрофаги и В-клетки, ИФНb, продуцируемый фибробластами, и ИФНg, который синтезируют главным образом активированные Т-хелперы, относящиеся к субпопуляции Th1. Продукция ИФНg Т-клетками происходит в результате стимуляции последних Т-клеточными митогенами, антителами против CD3, специфическими вирусными антигенами, а также аллоантигенами МНС.
ИФНg "придает" клеткам непермиссивность для репликации вируса, проникшего в них путем непосредственного межклеточного транспорта. Кроме того, ИФНg оказывает необратимое цитотоксическое действие на трансформированные клетки, тогда как его цитостатическое влияние на нормальные клетки обратимо. ИФНg усиливает цитотоксические реакции, опосредованные Т-лимфоцитами, К- и NK-клетками. Одновременно ИФНg селективно повышает резистентность нормальных клеток к цитопатическим эффектам NK-клеток. За счет ИФНg возможна индукция цитотоксичности у нормальных макрофагов. Активность ИФНg в 10—300 раз выше, чем активность ИФНa и ИФНb.
ИЛ-10. Этот лимфокин (молекулярная масса 17000—21000), продуцируемый Т-клетками (Th2), может рассматриваться как антагонист ряда цитокинов. Так, ИЛ-10 подавляет продукцию ИФНg Th1-клетками. Кроме того, он тормозит пролиферативный ответ Т-клеток на антигены и митогены, а также подавляет секрецию активированными моноцитами ИЛ-1р, TNF и ИЛ-6. В то же время ИЛ-10 стимулирует секрецию иммуноглобулинов В-клетками. ИЛ-10 предотвращает апоптоз ИЛ-2 зависимых ЦТЛ, лишенных ИЛ-2.
ИЛ-12 человека состоит из двух субъединиц с молекулярной массой 40 000 и 35 000, удерживаемых дисульфидной связью. Субъединица р40 гомологична рецептору для ИЛ-6, а субъединица р35 отдаленно напоминает ИЛ-6 и гранулоцитарный колониестимулирующий фактор. ИЛ-12 повышает литическую активность клеток системы ЛАК, а также специфическую цитотоксичность ЦТЛ. ИЛ-12 действует как ростовой фактор при активации Т- и NK-клеток. При этом он действует в качестве индуктора секреции ИФНg и ингибитора синтеза IgE индуцированного ИЛ-4.
ПРОВОСПАЛИТЕЛЬНЫЕ ЦИТОКИНЫВ случае несостоятельности местных защитных реакций воспалительная реакция развивается, возрастает синтез цитокинов, они попадают в циркуляцию, и их действие проявляется на системном уровне. Начинается системная воспалительная реакция или острофазовый ответ на уровне организма. При этом провоспалительные цитокины оказывают влияние практически на все органы и системы организма, участвующие в регуляции гомеостаза.
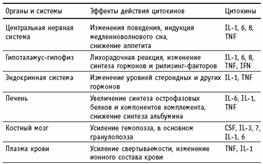
Действие провоспалительных цитокинов на ЦНС приводит к снижению аппетита и изменению всего комплекса поведенческих реакций. Временное прекращение поиска пищи и снижение сексуальной активности выгодно в плане экономии энергии для одной лишь за дачи — борьбы с внедрившимся патогеном. Этот сигнал обеспечивают цитокины, так как их попадание в циркуляцию, безусловно, означает, что местная защита не справилась с патогеном и требуется включение системной воспалительной реакции. Одно из первых проявлений системной воспалительной реакции, связанное с действием цитокинов на терморегуляторный центр гипоталамуса, заключается в подъеме температуры тела. Увеличение температуры является одной из эффективных защитных реакций, так как при повышенной температуре снижается способность ряда бактерий к размножению, и, напротив, возрастает пролиферация лимфоцитов.
В печени под влиянием цитокинов увеличивается синтез острофазовых белков и компонентов системы комплемента, нужных для борьбы с патогеном, но одновременно снижается синтез альбумина. То есть на уровне регуляции экспрессии отдельных генов цитокины направляют энергетические потоки, выбирая только то, что нужно для развития защитных реакций. Видимо, такая система регуляции сформировалась эволюционно и несет безусловные выгоды для наиболее оптимального защитного ответа макроорганизма. Другим примером избирательного действия цитокинов служит изменение ионного состава плазмы крови при развитии системной воспалительной реакции. При этом происходит снижение уровня ионов железа, но повышение уровня ионов цинка, а ведь хорошо известно, что лишить бактериальную клетку ионов железа — значит снизить ее пролиферативный потенциал (на этом основано действие лактоферрина). С другой стороны, увеличение уровня цинка нужно для нормальной работы иммунной системы, в частности, это необходимо для образования биологически активного сывороточного фактора тимуса — одного из основных тимических гормонов, обеспечивающих дифференцировку лимфоцитов. Влияние цитокинов на кроветворную систему связано с существенной активизацией гемопоэза. Увеличение числа лейкоцитов, конечно, необходимо для наращивания количества клеток, непосредственно убивающих патогены, и для восполнения потерь нейтрофильных гранулоцитов в очаге гнойного воспаления. Действие на системусвертывания крови направлено на усиление свертываемости, которое необходимо для остановки кровотечения и для прямого блокирования патогена. Наконец, в рамках иммунной системы цитокины осуществляют взаимосвязь между неспецифическими защитными реакциями и специфическим иммунитетом, действуя в обоих направлениях. Таким образом, на уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и ре гуляцию единой защитной реакции. Цитокины как раз и служат той организующей системой, которая формирует и регулирует весь комплекс защитных реакций организма при внедрении патогенов. Приведенные данные ясно указывают, что нельзя ограничить понятие защитных реакций только участием неспецифических механизмов резистентности и специфического иммунного ответа. В единой защитной реакции участвует весь организм и все системы, на первый взгляд не относящиеся к поддержанию иммунитета. Увеличение уровней цитокинов не может продолжаться бесконтрольно, так как гиперпродукция цитокинов служит причиной развития ряда патологических состояний, в частности, септического шока. Появление цитокинов в кровотоке сразу приводит к увеличению синтеза стероидных гормонов, причем IL-1 и другие провоспалительные цитокины вызывают как усиление синтеза рилизинг-факторов, так и стимуляцию продукции гормонов клетками коры надпочечников. Стероидные гормоны, известные как одни из наиболее мощных иммуносупрессоров, блокируют синтез цитокинов и не позволяют их уровню превысить предельные значения. Это является эффективным механизмом отрицательной обратной связи для контроля гиперпродукции цитокинов. Тем не менее, в ряде случаев уровни цитокинов превышают физиологические концентрации. Цитокины в низких концентрациях нужны для правильного формирования местного воспаления, более высокие дозы вызывают развитие системной воспалительной реакции, но патологически высокие концентрации приводят к состоянию септического шока и гибели организма.
РОЛЬ
Как уже отмечалось, большинство цитокинов не играет никакой роли в нормальной физиологии организма, а синтезируются лишь при развитии защитных реакций. Тем не менее, некоторые цитокины в небольших количествах синтезируются постоянно, регулируя различные этапы нормального гемопоэза, либо только на определенных этапах развития организма. Так, в онтогенезе цитокины группы TNF и ряд хемокинов регулируют нормальное развитие клеток, миграцию лимфоидных предшественников и закладку органов иммунной системы. Не менее важную роль цитокины играют и в регуляции дифференцировки и функциональной активности лимфоцитов, а значит, в регуляции специфического иммунитета. В настоящее время признано, что типы иммунного ответа связаны с одним из вариантов активации лимфоцитов с преимущественным участием клонов Т-лимфоцитов хелперов первого типа (Th1) или второго типа (Th2), которые различаются по паттернам продуцируемых цитокинов и ролью в стимулировании развития иммунного ответа по клеточному или гуморальному типу.
В последние годы активно дискутируется роль цитокинов в патологии, в частности, участие хемокинов в патогенезе СПИДа. Оказалось, что отдельные рецепторы хемокинов могут служить кофакторами для проникновения вируса иммунодефицита человека (ВИЧ) в клетки. Штаммы ВИЧ, тропные к моноцитам, используют рецепторы СС хемокинов, тогда как штаммы ВИЧ, тропные к Т-лимфоцитам и доминирующие на более поздних стадиях прогрессии СПИДа, используют рецепторы СХС хемокинов, в частности, рецептор CXCR4. Такие СС хемокины, как RANTES, MIP-1α и MIP-1β, блокируют вход некоторых штаммов ВИЧ в клетки макрофагального ряда посредством рецептора CCR5, а СХС хемокин SDF-1, взаимодействующий с рецепторомCXCR4, блокирует инфицирование лимфоцитов лимфотропными штаммами ВИЧ. Лица, гомозиготные по делеции определенного участка из 32 пар оснований в аллелях гена рецептора хемокинов CCR5, оказались высокорезистентны к инфицированию ВИЧ, потому что дефектный рецептор не способен экспрессироваться на мембране клетки. Лица, гетерозигот ные по данной делеции, подвержены инфицированию ВИЧ, но СПИД прогрессирует у них значительномедленнее. ВИЧ использует клеточные рецепторы хемокинов для инфицирования клеток, и это лишь один из случаев приспособления микроорганизмов с целью обойти пагубное влияние иммунной системы или, более того, использовать молекулы иммунной системы для своего развития и размножения. Сейчас накоплено достаточно фактов, указывающих на активное использование микроорганизмами рецепторов цитокинов в своих целях и модификацию биологического действия цитокинов, меняющую противоинфекционную направленность их биологической активности. Ряд вирусов, в частности, вирус герпеса и цитомегаловирус, экспрессируют белки, имеющие высокую степень гомологии с рецепторами хемокинов. Вероятно, таким способом вирусы синтезируют белки, служащие ловушками для хемокинов, что ведет к снижению концентрации хемокинов и противодействию развития защитных реакций. Другое предположение заключается в том, что кодируемый вирусным геномом хемокиновый рецептор может экспрессироваться на мембране инфицированной клетки. Активация клетки через данный рецептор может служить дополнительным сигналом для усиления вирусной репликации. Движущей силой интенсивного изучения цитокинов всегда была многообещающая перспектива их клинического использования для лечения широко распространенных заболеваний, в том числе рака. Сейчас многие цитокины применяются в клинической практике в виде лекарственных препаратов. Существует три принципиальных варианта применения цитокинов в клинической практике: 1. Лечение препаратами цитокинов, а именно, усиление действия эндогенных цитокинов путем введения в организм природных или рекомбинантных молекул цитокинов (IL-1, IL-2, CSF, IFN и др.) либо заместительная терапия (эритропоэтин). 2. Цитокиновая генотерапия рака путем введения генов цитокинов в опухолевые клетки для усиления их иммуногенности и повышения воспа лительной реакции в области опухолевого узла и иммунного отторжения опухоли. 3. Антицитокиновая терапия, направленная на удаление или блокирование действия эндогенных цитокинов с использованием специфических ингибиторов (в том числе членов семейства цитокинов, например IL-1Ra для блокирования действия IL-1), моноклональных антител к цитокинам, а также растворимых рецепторов.
В настоящее время цитокины находят все более широкое применение в клинической практике для лечения различных онкологических, инфекционных и иммунодефицитных заболеваний. Этот новый класс регуляторных молекул создан природой в ходе миллионов лет эволюции и обладает неограниченными возможностями для употребления в качестве лекарственных препаратов. Нужно только научиться грамотно использовать эти мощные регуляторы на благо человека.
ЛИТЕРАТУРА
· Atkins E., Wood W. Studies on the pathogenesis of fever // J. Exp. Med. —1955.— Vol. 102. — P. 499–516.
· Baggiolini M., Dewald B., Moser B. Human chemokines: an update // Annu. Rev. Immunol. — 1997. — Vol. 15. — P. 675–705.
· Brightbill H., Modlin R. Toll_like receptors: molecular mechanisms of the mammalian immune response // Immunology. 2000.
· Cohen S., Bigazzi P., Yoshida T. Similarities of T cell function in cell_mediated immunity and antibody production // Cell. Immunol. — 1974. — Vol. 12. — P. 150–159.
· Dinarello C. The biological properties of interleukin_1 // Eur. Cytokine Netw. — 1994. — Vol. 5. — P. 517–526.
· Fernandez_Botran R., Chilton P., Ma Y. Soluble cytokine receptors: their roles in immunoregulation, disease and therapy // Adv. Immunol. — 1996. —Vol. 63. — P. 269–336.
· Heim M. The Jak_STAT pathway: specific signal transduction from the cell membrane to the nucleus // Eur. J. Clin. Invest. — 1996. — Vol. 26. — P. 1–12.
· Ihle J., Witthuhn B., Quelle F. et al. Signaling through the hematopoietic cytokine receptors // Annu. Rew. Immunol. 1995. — Vol. 13. — P. 369–398.
· Isaack A., Lindenmann J. Virus interference. I. The Interferon // Proc. Roy. Soc. Series B. — 1957. — Vol. 147. — P. 258–267.
· Lee B., Montaner L. Chemokine immunobiology in HIV_1 pathogenesis //J. Leukocyte Biol. — 1999. — Vol. 65. P. 552–565.
· Mantovani A., Bussolino F., Introna M. Cytokine regulation of endothelial cell function: from molecular level to the bed side // Immunol. Today. — 1997. —Vol. 18. — P. 231–239.
· Morgan D., Ruscetti F., Gallo R. Selective in vitro growth of T_lymphocytes from normal human bone marrows // Science. — 1976. — Vol. 193. — P. 1007–1008.
· Mosmann T., Cherwinski H., Bond M. et al. Two types of murine helper t cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins // J. Immunol. — 1986. Vol. 136. — P. 2348–2357.
· Oppenheim J., Feldman M. (Eds) Cytokine Reference. — London: Academic Press, 2000. — 2015 p.
· Romagnani S. The Th1/Th2 paradigm // Immunol. Today. — 1997. — Vol. 18.— P. 263–266.
· Ройт А. Основы иммунологии (пер. с англ.). М.: Мир, 1991. 328 с.
© 2009 База Рефератов