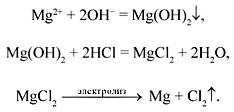Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Дипломная работа: Исследование возможности наполнения темы "Элементы II группы периодической системы Д.И. Менделеева" прикладным и экологическим содержанием посредством проведения интегрированных уроков
Дипломная работа: Исследование возможности наполнения темы "Элементы II группы периодической системы Д.И. Менделеева" прикладным и экологическим содержанием посредством проведения интегрированных уроков
Дипломная работа
Исследование возможности наполнения темы «Элементы II группы периодической системы Д.И. Менделеева» прикладным и экологическим содержанием посредством проведения интегрированных уроков
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Глава I. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
Глава II. ЭЛЕМЕНТЫ II ГРУППЫ ТАБЛИЦЫ Д.И. МЕНДЕЛЕЕВА.
ХИМИЯ И ЭКОЛОГИЯ
2.1 Общая характеристика
2.2 Химия и экология
2.2.1 Общие сведения о ртути
2.2.2 Распространенность ртути в природе
Глава III. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «ЭЛЕМЕНТЫ II ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.Менделеева»
3.1 Урок по теме «Металлы Главной Подгруппы II Группы»
3.2Урок по теме «Бериллий, магний и щелочноземельные Металлы»
3.3 Задачи и тесты по теме: «Щелочноземельные металлы»
3.3.1 Тест по теме: «Щелочноземельные металлы и их соединения»
3.3.2 Задачи
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ. ВЫВОДЫ
ЛИТЕРАТУРА
ВВЕДЕНИЕ
В настоящее время все более осознается опасность, которая может привести человечество к гибели – это экологическая катастрофа. Сегодня наша планета находится в состоянии экологического кризиса, который, если не принять срочных и действующих мер неминуемо приведет его катастрофе. Но кризис – это состояние обратимое.
В этих условиях особенно необходима психологическая перестройка людей в отношениях с природой. Воспитание бережного, внимательного отношения к природе людей окружающей среде, расширение знаний и навыков, необходимых для ее охраны, должны стать неотъемлемой частью общей системы просвещения, образования, подготовки кадров.
Большая роль в этом деле принадлежит образовательной школе, которая охватывает подрастающее поколение людей. Современному учителю необходимо проникнуть в сущность актуальных проблем взаимодействия природы и общества, увидеть их социальную основу, конкретно представить, какими средствами и способами решать задачи воспитания ответственного отношения школьников к природной среде.
Актуальность выбранной темы очевидна, так как элементы II группы таблицы Менделеева относятся к наиболее часто используемым в различных отраслях науки, техники, промышленности, быту и т.д. Их содержание в литосфере, атмосфере и гидросфере различно, но все они в силу своих химических и физических свойств играют очень большую роль в биохимических процессах, а значит, оказывают большое влияние на состояние биосферы вообще. Поэтому представляет интерес как рассмотрение этой группы элементов с точки зрения химика-эколога, так и с точки зрения формирования экологического мышления и культуры при обучении химии в школе.
Объект курсовой работы элементы II группы периодической системы Д. И. Менделеева охватывают большое количество элементов с богатым спектром свойств.
Основной целью данной дипломной работы являлось исследование возможности наполнения темы «Элементы II группы периодической системы Д. И. Менделеева» прикладным и экологическим содержанием посредством проведения интегрированных уроков.
В связи с этим в работе решались следующие конкретные задачи:
1) обзор и анализ существующих школьных программ по изучению темы «Элементы II группы периодической системы Д. И. Менделеева»;
2) разработка различных форм организации занятий в рамках темы «Элементы II группы периодической системы Д.И. Менделеева»;
3) составление банка контрольных заданий по изучаемой теме.
Предмет исследования выбор соответствующих форм организации занятий, обеспечивающих введение прикладных и экологических аспектов в процесс изучения темы «Элементы II группы периодической системы Д. И. Менделеева».
Объект исследования процесс изучения темы: «Элементы II группы периодической системы Д.И. Менделеева» в средней школе.
Гипотеза – Разумное сочетание в процессе обучения теоретических и прикладных знаний обеспечивает понимание школьниками важности теоретических понятий, способствует более глубокому усвоению материала и формированию полноценных представлений об экологических аспектах химии.
глава I. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
Для осознанного понимания химических процессов огромное значение имеет представление об элементах, их свойствах, способах получения, применения и экологических проблемах.
В школьной программе элементы 2 гр. упоминаются при изучении темы: «Первоначальные химические понятия» в 8 кл. [1] и в 9, 11 кл. следующим образом [2,3]:
| 9 кл.Тема: Общие свойства металлов. | ||||||
|
№ урока п/п |
Тема, содержание урока |
Сроки прохождения учебного материала |
Домашнее задание |
|||
| 60. |
Положение металлов в периодической системе и особенности строения атомов. Общие способы получения металлов. |
Глава У1, § 40, 41. | ||||
| 61-62. | Электролиз растворов и расплавов солей: законы, составление схем и уравнений. | Глава У1, § 42. з.1-3 с.120. | ||||
| 63. | Общие физические и химические свойства металлов. | Глава У1, § 43, 44, в. 7-11 с.120, з. 4-5. | ||||
| 64. | Сплавы. Лабораторный опыт. «Рассмотрение образцов металлов». | Глава У1, § 45, примеры сплавов, их применение. | ||||
| 65. | Коррозия металлов и её предупреждение. | Глава У1, § 46. | ||||
| 66. | Контрольная работа № 6. «Общие свойства металлов». | |||||
|
9 кл. Тема: Металлы главных подгрупп 1-111 групп периодической системы элементов Д.И. Менделеева. |
||||||
| 67-68. | Характеристика щелочных металлов. | Глава У11, § 47, в.1-12, с.126, з. 1,2. | ||||
| 69-70. | Характеристика магния и кальция. Соединения кальция. | Глава У11, § 48, 49, в.1-12 с.132-133, з.1-2. | ||||
| 71. | Жёсткость воды и способы её устранения. | Глава У11, § 49, с. 131-132, в.13-15 с.133. | ||||
| 72-73. | Алюминий. Важнейшие соединения алюминия. | Глава У11, § 50, в.1-11 с.138., з.2. | ||||
| 74. | Практическая работа № 6. «Решение экспериментальных задач». | |||||
| 75. | Контрольная работа № 6. «Металлы главных подгрупп». | |||||
| 11 кл. Тема: Металлы | ||||||
| Общая характеристика металлов. | Глава У, с.94-95, схема 9. | |||||
| Общие способы получения металлов. | Глава У, § 1, таблица 10. | |||||
| Металлы главных подгрупп. | Глава У, § 2, табл.11-13, вопр. и упр. 5-8 с. 120, зад.1-2. | |||||
| Металлы побочных подгрупп: медь, цинк, титан, хром, железо, никель, платина. |
Глава У, § 3,4,5,6,7,8. Табл.14, вопр. и упр. 9-17 с.121. зад.1,2 с. 140. |
|||||
| Сплавы металлов. | Глава У § 9, вопр.18-20 с. 121. табл. 16, 17, 18 с.116,117. | |||||
| Оксиды и гидроксиды металлов. | Глава У, § 10, табл.19,20 с.118,119. | |||||
| Решение задач и упражнений по теме «Металлы». |
Повт. учебный материал гл.У, решить задачи. |
|||||
| Контрольная работа №4 по теме: «Металлы». | ||||||
| Анализ контрольной работы, коррекция знаний, умений. | ||||||
При изучении этой темы пользуются учебником химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман [1], также учебником за 8 - 9 класс под редакцией Н. С. Ахметова [4]. Дидактическим материалом служит книга по химии для 8 - 9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной работы по химии за 9 класс под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко.
Появление большого числа учебников по химии для основной школы, их разнообразие вызвало большие трудности в их оценке. Чтобы избежать субъективности в экспертной оценке учебника были разработаны специальные требования, которым, по мнению педагогической общественности, должны отвечать современные учебники химии: соответствие адресату: типу учебного заведения, профилю класса, ступени обучения;
—соответствие возрастным возможностям учащихся;
—способствование пониманию научного метода химии и языка химической науки;
—раскрытие экологических проблем;
—возможности для самостоятельного изучения учащимися отдельных вопросов;
—использование современных способов изложения материала;
—условия для контроля и самоконтроля;
—плотность введения понятий.
Учебник под редакцией Р.Г. Ивановой, А.А. Кавериной «Химия-9» [5] полностью отвечает этим требованиям. Курс начинается с изложения периодического закона и периодической системы химических элементов Д.И. Менделеева, дано определение понятий «закон» и «система». Для ознакомления учащихся с эмпирическим методом познания в учебнике прослеживаются этапы открытия закона от накопления эмпирических фактов к выявлению закономерностей, от менделеевского этапа (химического) до современного (физического). Такая логика подачи материала способствует осознанию роли теории, пониманию значения периодического закона и изменения его функций от обобщающей до объясняющей и прогнозирующей.
Возможность применения теоретических знаний предоставляется учащимся при характеристике металлов в зависимости от их положения в периодической системе и особенностей строения атомов.
Далее следует раздел, посвященный общим и особенным свойствам металлов, которые также рассматриваются на основе теоретических представлений о строении атомов, химической связи, процессов окисления-восстановления, ионного обмена в реакциях соединения металлов в растворах.
Особенностью этого учебного издания является то, что знания о веществах (неметаллах и металлах) позволяют рассмотреть в учебнике промышленные способы получения важнейших веществ, подвести учащихся к пониманию сущности сырьевой, природосберегающей и экологической проблем, осознанию роли химии в их решении.
Заканчивается учебник разделом, цель которого — обобщение и систематизация знаний по неорганической химии.
В учебнике есть Приложение 1 «Лабораторные опыты и практические работы и Приложение 2 «Для любознательных».
В приложении для любознательных помещен материал, расширяющий знания о строении металлов, об аллотропии олова, об электрохимических свойствах металлов (ряд напряжений), о токсичности ртути и способах устранения загрязнений окружающей среды, о минералах, комплексных соединениях, истории металлургии, металлах в окружающей среде, проблеме защиты окружающей среды [4].
В некоторых учебниках вместо познавательной задачи ставятся вопросы для актуализации знаний, полученных ранее. Такой прием тоже полезен, потому что способствует осознанию связей между параграфами, восприятию содержания предмета как единого целого, т. е. системности. Такой прием мы находим у Н. С. Ахметова [4], Н. Е. Кузнецовой, И. М. Титовой, Н. Н. Тары, А. Ю. Жегина [6].
В учебнике под редакцией Ахметова Н.С. [4] в каждой главе и параграфе цели конкретизированы в форме познавательных задач, которые могут носить проблемный характер, но, к сожалению, это пособие рассматривает только вопросы получения щелочноземельных металлов, их физические и химические свойства, применение, содержит материал для углубленного изучения, но не затрагивает экологические проблемы. Отличительностью особенностью этого учебника является высокий уровень упражнений и задач для закрепления изученного материала. Задания рассчитаны на самостоятельную работу учащихся и носят поисковый характер.
В настоящее время делаются попытки создать учебники, обеспечивающие дифференцированный подход к учащимся, так называемые двухуровневые и даже трехуровневые учебники. Примером могут служить учебники Л. С. Гузея, Р. П. Суровцевой и В. В. Сорокина [7], а также Е. Е. Минченкова и Л. С. Зазнобиной [8]. В них наряду с текстом, предназначенным для каждого ученика, специально отчеркнуты вертикальной чертой слева абзацы, в которых изложен материал для более глубокого изучения химии. Этот текст будут читать ученики, заинтересовавшиеся химией. Он значительно превышает обязательный минимум содержания. Такая же дифференциация предусмотрена и в системе заданий.
Учебник под редакцией Фельдмана Ф.Г., Рудзитиса Г.Е. представляет собой своего рода справочник, где приводится характеристика, свойства элементов, применение, способы получения. Задания и упражнения носят классический характер. Вопросы производства освещены слабо, экологические проблемы, связанные с элементами и их соединениями приводятся в общих чертах.
Таким образом, рассмотрение основных школьных пособий по химии позволяет сделать вывод, что в условиях экологизации химического образования возрастает роль теоретического и практического материала экологической направленности. Эта проблема должна решаться через экологизацию школьных учебников по химии, где должны рассматриваться сущности экологических проблем и способы их решения, что будет способствовать формированию экологического мировоззрения учащихся.
Глава II. ЭЛЕМЕНТЫ II ГРУППЫ ТАБЛИЦЫ Д.И. МЕНДЕЛЕЕВА. ХИМИЯ И ЭКОЛОГИЯ
2.1 Общая характеристика
К щелочноземельным металлам относятся следующие элементы главной подгруппы II группы Периодической системы: кальций, стронций, барий и радий. Магний имеет ряд сходных со щелочными металлами свойств, бериллий по химическим свойствам ближе к алюминию. Щелочноземельные металлы являются электронными аналогами, внешний электронный уровень имеет строение ns2, в соединениях наиболее характерная степень окисления +2. В соединениях с неметаллами основой тип связи – ионный. Соединения щелочноземельных металлов окрашивают бесцветное пламя газовой горелки: кальция – в оранжево-красный, стронция в темно-красный, бария – в светло-зеленый цвет. В природе щелочноземельные металлы встречаются только в виде соединений, основные минералы кальция кальцит (известковый шпат, известняк, мрамор, мел) СаСО3, доломит CaMg(CO3)2, гипс CaSO42H2O, флюорит CaF2, гидроксиапатит (фосфорит) Ca5(PO4)3(OH), апатит Ca5(PO4)3F,Cl. Основные минералы стронция – стронцианит SrCO3 и целестин SrSO4, бария витерит BaCO3 и барит BaSO4.
Физические свойства. Внешне серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов. Твердость по группе уменьшается сверху вниз, барий по твердости близок к свинцу. Температуры плавления щелочноземельных металлов выше, чем у щелочных и составляют: для кальция 851оС, стронция 770оС, бария 710оС. Плотности щелочноземельных металлов в подгруппе сверху вниз увеличиваются и равны для Са, Sr и Ва, соответственно 1,54, 2,63 и 3,76 г/см3.
Химические свойства щелочноземельных металлов
Щелочноземельные металлы химически весьма активны, в реакциях проявляют свойства восстановителей. Взаимодействуют с
1. Кислородом (горят на воздухе)
2Са + О2 = 2СаО
2Sr + O2 = 2SrO
2Ba + O2 = 2BaO
При этом образуются и нитриды состава Me3N2. При контакте щелочноземельных металлов с воздухом при комнатной температуре на поверхности металлов образуетсяжелтоватая пленка, состоящая из оксидов, гидроксидов и нитридов.
Оксид бария при нагреваии до 500оС образуeт пероксид:
2BaO + O2 = 2BaO2
который разлагается при температуре выше 800оС:
2BaO2 = 2BaO + O2
2. С водородом при нагревании образуют гидриды
Ca + H2 = CaH2
Ba + H2 = BaH2
3. С серой реагируют в обычных условиях, образуя сульфиды
Ca + S = CaS
и полисульфиды
CaS + nS = CaSn+1
4. С азотом – при нагревании образуют нитриды
3Ca + N2 = Ca3N2
5. C фосфором фосфиды
3Ca + 2Р = Ca3Р2
6. С углеродом – при нагревании образуются карбиды, которые являются производными ацетилена:
Са + 2С = СаС2
7. С водой – растворяются с выделением водорода, реакция протекает спокойнее, чем со щелочными металлами:
Са + 2Н2О = Са(ОН)2 + Н2
8. Восстанавливают другие металлы из их соединений, например:
UF4 + 2Ca = U + 2CaF2
Активность взаимодействия с водой возрастает от кальция к барию.
Получение щелочноземельных металлов
Кальций получают электролизом расплaва хлорида кальция СаCl2, к которому добавляют 5-7% CaF2 для снижения температуры плавления:
СаCl2 = Са(катод) + Cl2(анод)
Стронций и барий получают методом алюмотермии из оксидов:
3BaO + 2Al = 3Ba + Al2O3
Применение щелочноземельных металлов
Металлический кальций применяется как восстановитель и легирующая добавка к сплавам [9-12].
2.2 Химия и экология
В последнее время наиболее остро стал вопрос об экологических проблемах, и одна из них – тяжелые металлы.
Тяжелые металлы - это элементы периодической системы с относительной молекулярной массой больше 40. Не исключение, II группа таблицы Менделеева, в частности ртуть, цинк, кадмий.
Таким образом, к тяжелым металлам относят более 40 химических элементов с относительной плотностью более 6. Число же опасных загрязнителей, если учитывать токсичность, стойкость и способность накапливаться во внешней среде, а также масштабы распространения указанных металлов, значительно меньше.
Прежде всего представляют интерес те металлы, которые наиболее широко и в значительных объемах используются в производственной деятельности и в результате накопления во внешней среде представляют серьезную опасность с точки зрения их биологической активности и токсических свойств. К ним относят свинец, ртуть, кадмий, цинк, висмут, кобальт, никель, медь, олово, сурьму, ванадий, марганец, хром, молибден и мышьяк.
Формы нахождения в окружающей среде. В атмосферном воздухе тяжелые металлы присутствуют в форме органических и неорганических соединений в виде пыли и аэрозолей, а также в газообразной элементной форме (ртуть). При этом аэрозоли свинца, кадмия, меди и цинка состоят преимущественно их субмикронных частиц диаметром 0,5-1 мкм, а аэрозоли никеля и кобальта - из крупнодисперсных частиц (более 1 мкм), которые образуются в основном при сжигании дизельного топлива.
В водных средах металлы присутствуют в трех формах: взвешенные частицы, коллоидные частицы и растворенные соединения. Последние представлены свободными ионами и растворимыми комплексными соединениями с органическими (гуминовые и фульвокислоты) и неорганическими (галогениды, сульфаты, фосфаты, карбонаты) лигандами. Большое влияние на содержание этих элементов в воде оказывает гидролиз, во многом определяющий форму нахождения элемента в водных средах. Значительная часть тяжелых металлов переносится поверхностными водами во взвешенном состоянии.
Сорбция тяжелых металлов донными отложениями зависит от особенностей состава последних и содержания органических веществ. В конечном итоге тяжелые металлы в водных экосистемах концентрируются в донных отложениях и биоте.
В почвах тяжелые металлы содержатся в водорастворимой, ионообменной и непрочно адсорбированной формах. Водорастворимые формы, как правило, представлены хлоридами, нитратами, сульфатами и органическим комплексными соединениями. Кроме того, ионы тяжелых металлов могут быть связаны с минералами как часть кристаллической решетки.
Источники.
Добыча и переработка не являются самым мощным источником загрязнения среды металлами. Валовые выбросы от этих предприятий значительно меньше выбросов от предприятий теплоэнергетики. Не металлургическое производство, а именно процесс сжигания угля является главным источником поступления в биосферу многих металлов. В угле и нефти присутствуют все металлы. Значительно больше, чем в почве, токсичных химических элементов, включая тяжелые металлы, в золе электростанций, промышленных и бытовых топок. Выбросы в атмосферу при сжигании топлива имеют особое значение. Например, количество ртути, кадмия, кобальта, мышьяка в них в 3-8 раз превышает количество добываемых металлов. Известны данные о том, что только один котлоагрегат современной ТЭЦ, работающий на угле, за год выбрасывает в атмосферу в среднем 1-1,5 т паров ртути. Тяжелые металлы содержатся и в минеральных удобрениях.
Наряду со сжиганием минерального топлива важнейшим путем техногенного рассеяния металлов является их выброс в атмосферу при высокотемпературных технологических процессах (металлургия, обжиг цементного сырья и др.), а также транспортировка, обогащение и сортировка руды.
Техногенное поступление тяжелых металлов в окружающую среду происходит в виде газов и аэрозолей (возгона металлов и пылевидных частиц) и в составе сточных вод.
Металлы сравнительно быстро накапливаются в почве и крайне медленно из нее выводятся: период полуудаления цинка - до 500 лет, кадмия - до 1100 лет, меди - до 1500 лет, свинца - до нескольких тысяч лет.
Существенный источник загрязнения почвы металлами - применение удобрений из шламов, полученных из промышленных и канализационных очистных сооружений.
В выбросах металлургических производств тяжелые металлы находятся, в основном, в нерастворимой форме. По мере удаления от источника загрязнения наиболее крупные частицы оседают, доля растворимых соединений металлов увеличивается, и устанавливаются соотношения между растворимой и нерастворимыми формами. Аэрозольные загрязнения, поступающие в атмосферу, удаляются из нее путем естественных процессов самоочищения. Важную роль при этом играют атмосферные осадки. В итоге выбросы промышленных предприятий в атмосферу, сбросы сточных вод создают предпосылки для поступления тяжелых металлов в почву, подземные воды и открытые водоемы, в растения, донные отложения и животных.
Дальность распространения и уровни загрязнения атмосферы зависят от мощности источника, условий выбросов и метеорологической обстановки. Однако в условиях промышленно-городских агломераций и городской застройки параметры распространения металлов в воздухе еще плохо прогнозируются. С удалением от источников загрязнения уменьшение концентраций аэрозолей металлов в атмосферном воздухе чаще происходит по экспоненте, вследствие чего зона их интенсивного воздействия, в которой имеет место превышение ПДК, сравнительно невелика.
В условиях урбанизированных зон суммарный эффект от регистрируемого загрязнения воздуха является результирующей сложения множества полей рассеяния и обусловлен удалением от источников выбросов, градостроительной структурой и наличием необходимых санитарно-защитных зон вокруг предприятий. Естественное (фоновое) содержание тяжелых металлов в незагрязненной атмосфере составляет тысячные и десятитысячные доли микрограмма на кубический метр и ниже. Такие уровни в современных условиях на сколько-нибудь обжитых территориях практически не наблюдается. Фоновое содержание свинца принято равным 0,006 мкг/ м3, ртути - 0,001-0,8 мкг/ м3 (в городах - на несколько порядков выше). К основным отраслям, с которыми связано загрязнение окружающей среды ртутью, относят горнодобывающую, металлургическую, химическую, приборостроительную, электровакуумную и фармацевтическую. Наиболее интенсивные источники загрязнения окружающей среды кадмием - металлургия и гальванопокрытия, а также сжигание твердого и жидкого топлива. В незагрязненном воздухе над океаном средняя концентрация кадмия составляет 0,005 мкг/ м3, в сельских местностях - до 0,05 мкг/м3, а в районах размещения предприятий, в выбросах которых он содержится (цветная металлургия, ТЭЦ, работающие на угле и нефти, производство пластмасс и т.п.), и промышленных городах - до 0,3-0,6 мкг/ м3.
Атмосферный путь поступления химических элементов в окружающую среду городов является ведущим. Однако уже на небольшом удалении, в частности, в зонах пригородного сельского хозяйства, относительная роль источников загрязнения окружающей среды тяжелыми металлами может измениться и наибольшую опасность будут представлять сточные воды и отходы, накапливаемые на свалках и применяемые в качестве удобрений.
Максимальной способностью концентрировать тяжелые металлы обладают взвешенные вещества и донные отложения, затем планктон, бентос и рыбы.
Осадки. Зона максимальных концентраций металлов в воздухе распространяется до 2 км от источника. В ней содержание металлов в приземном слое атмосферы в 100-1000 раз выше местного геохимического фона, а в снеге - в 500-1000 раз. На удалении 2-4 км располагается вторая зона, где содержание металлов в воздухе приблизительно в 10 раз ниже, чем в первой. Намечается третья зона протяженностью 4-10 км, где лишь отдельные пробы показывают повышенное содержание металлов. По мере удаления от источника соотношения разных форм рассеивающихся металлов меняются. В первой зоне водорастворимые соединения составляют всего 5-10 %, а основную массу выпадений образуют мелкие пылевидные частицы сульфидов и оксидов. Относительное содержание водорастворимых соединений возрастает с расстоянием [13-15].
2.2.1 Общие сведения о ртути
Важнейшие свойства ртути. Ртуть (Hg) – химический элемент II группы периодической системы элементов Д.И. Менделеева; атомный номер 80, относительная атомная масса 200,59; в состав природной ртути входят 7 стабильных изотопов с массовыми числами: 196 (распространенность 0,146%), 198 (10,02%), 199 (16,84%), 200 (23,13%), 201 (13,22%), 202 (29,80%) и 204 (6,85%). Природная ртуть характеризуется относительно устойчивым изотопным соотношением. Тем не менее в ней в небольших количествах присутствуют радиоактивные изотопы. Искусственно получено более 20 короткоживущих изотопов, из которых практическое значение имеют (метки в медицине, в аналитике, в технологических процессах) 203Hg (период полураспада 46,6 дня) и 197Hg (64,1 ч). Ртуть в обычных условиях представляет собой блестящий, серебристо-белый тяжелый жидкий металл. Удельный вес ее при 20оС 13,54616 г/см3; температура плавления = –38,89оС, кипения 357,25оС. При замерзании (–38,89оС) она становится твердой и легко поддается ковке.
Даже в обычных условиях ртуть обладает повышенным давлением насыщенных паров и испаряется с довольно высокой скоростью, которая с ростом температуры увеличивается. Это приводит к созданию опасной для живых организмов ртутной атмосферы. Например, при 24оС атмосферный воздух, насыщенный парами ртути, может содержать их в количестве около 18 мг/м3; такой уровень в 1800 раз превышает ПДК (предельно допустимую концентрацию) ртути в воздухе рабочей зоны и в 60000 раз ПДК в атмосферном воздухе. Ртуть способна испаряться через слои воды и других жидкостей. Кроме благородных газов, ртуть является единственным элементом, образующим пары, которые при комнатной температуре одноатомные (Hgo). В нормальных условиях растворимость паров ртути в воде, свободной от воздуха, составляет около 20 мкг/л.
При действии на ртутные пары вольтовой дуги, электрической искры и рентгеновских лучей наблюдаются явления люминесценции, флюоресценции и фосфоресценции. В вакуумной трубке между ртутными электродами при электрических разрядах получается свечение, богатое ультрафиолетовыми лучами, что используется в технике при конструировании ртутных ламп. Это же явление легло в основу спектрального метода определения малых количеств ртути в различных объектах. Ртуть характеризуется очень низкой удельной теплоемкостью. Это ее свойство находило применение в ртутно-паросиловых установках. Еще одно замечательное свойство ртути связано с тем, что при растворении в ней металлов образуются амальгамы - металлические системы, одним из компонентов которых является ртуть. Они не отличаются от обычных сплавов, хотя при избытке ртути представляют собой полужидкие смеси. Соединения, получающиеся в результате амальгамирования, легко разлагаются ниже температуры их плавления с выделением избытка ртути, что нашло широкое применение при извлечении золота и серебра из руд. Амальгамированию подвержены металлы, смачиваемые ртутью. Стали, легированные углеродом, кремнием, хромом, никелем, молибденом и ниобием, не амальгамируются.
В соединениях ртуть проявляет степень окисления +2 и +1. В специальной литературе в таких случаях обычно указывается соответственно Hg(II) или Hg(I). Обладая высоким потенциалом ионизации, высоким положительным окислительным потенциалом, ртуть является относительно стойким в химическом отношении элементом. Это обусловливает ее способность восстанавливаться до металла из различных соединений и объясняет частые случаи нахождения ртути в природе в самородном состоянии. Обычно самородная ртуть содержит небольшие количества других металлов, в том числе золото и серебро, т. е., по сути, является амальгамой. Известны минералы ртути, в которых содержания благородных и других металлов очень высоки (ртутистое серебро, ртутистое золото, ртутистый палладий, ртутистый свинец, амальгамид золота и др.). Ртуть весьма агрессивна по отношению к различным конструкционным материалам, что приводит к коррозии и разрушению производственных объектов и транспортных средств. Так, в 1970-е гг. довольно актуальной была проблема загрязнения самолетов, в конструкции которых попадала ртуть, вызывающая жидкометаллическое охрупчивание алюминиевых сплавов. Самолеты направлялись на капитальный ремонт и даже снимались с эксплуатации.
На воздухе ртуть при комнатной температуре не окисляется. При нагреве до температур, близких к температуре кипения (300-350оС), она соединяется с кислородом воздуха, образуя красный оксид двухвалентной ртути HgO, который при дальнейшем нагревании (до 400оС и выше) снова распадается на ртуть и кислород. Желтый оксид ртути HgO получается при добавлении щелочей к водному раствору соли Hg(II). Существует и оксид ртути черного цвета (Hg2O), нестойкое соединение, в котором степень окисления ее равна +1. В соляной и разбавленной серной кислотах и в щелочах ртуть не растворяется. Но она легко растворяется в азотной кислоте и в царской водке, а при нагревании – в концентрированной серной кислоте. Металлическая ртуть способна растворяться в органических растворителях, а также в воде, особенно при отсутствии свободного кислорода. Растворимость ее в воде зависит также от рН раствора. Минимальная растворимость наблюдается при рН=8, с увеличением кислотности или щелочности воды она увеличивается. В присутствии кислорода ртуть в воде окисляется до ионной формы Hg2+ (создавая концентрации до 40 мкг/л) [16].
2.2.2 Распространенность ртути в природе
Ртуть - редкий элемент. Ее средние содержания в земной коре и основных типах горных пород оцениваются в 0,03-0,09 мг/кг, т. е. в 1 кг породы содержится 0,03-0,09 мг ртути, или 0,000003-0,000009 % от общей массы (для сравнения - одна ртутная лампа в зависимости от конструкции может содержать от 20 до 560 мг ртути, или от 0,01 до 0,50% от массы). Масса ртути, сосредоточенная в поверхностном слое земной коры мощностью в 1 км, составляет 100 000 000 000 т (сто миллиардов тонн), из которых в ее собственных месторождениях находится только 0,02%. Оставшаяся часть ртути существует в состоянии крайнего рассеяния, по преимуществу в горных породах (в водах Мирового океана рассеяно 41,1 млн. т ртути, что определяет невысокую среднюю концентрацию ртути в его водах - 0,03 мкг/л). Именно эта рассеянная ртуть создает природный геохимический фон, на который накладывается ртутное загрязнение, обусловленное деятельностью человека и приводящее к формированию в окружающей среде зон техногенного загрязнения.
Известно более 100 ртутных и ртутьсодержащих минералов. Основным минералом, определяющим промышленную значимость ртутных месторождений, является киноварь. Самородная ртуть, метациннабарит, ливингстонит и ртутьсодержащие блеклые руды имеют резко подчиненное значение и добываются попутно с киноварью.
Всего в мире обнаружено около 5000 ртутных месторождений, рудных участков и рудопроявлений, получивших самостоятельное название; из них в разное время разрабатывались около 500. Но за всю историю ртутной промышленности подавляющая часть ртути (более 80%) получена на 8 месторождениях: Альмаден (Испания), Идрия (Словения), Монте-Амиата (Италия), Уанкавелика (Перу), Нью-Альмаден и Нью-Идрия (США), Никитовка (Украина), Хайдаркан (Киргизия).
В промышленности для получения металлической ртути используют два варианта технологии ее извлечения из руд: окислительно-дистилляционный обжиг с выделением ртути из газовой фазы и комбинированный способ, включающий предварительное обогащение и последующую пирометаллургическую переработку концентрата. По оценкам специалистов, человеком было произведено порядка 700000 т ртути, существенная часть из которых рассеяна на земной поверхности. Количество ртути, которое поступило в среду обитания в ходе других видов человеческой деятельности (при добыче различных полезных ископаемых, выплавке металлов, производстве цемента, сжигании ископаемого топлива и т. д.), также велико.
Ртуть концентрируется не только в ртутных минералах, рудах и вмещающих их горных породах. Согласно закону Кларка-Вернадского о всеобщем рассеянии химических элементов, в тех или иных количествах ртуть обнаруживается во всех объектах и компонентах окружающей среды, в том числе в метеоритах и образцах лунного грунта. В повышенных концентрациях ртуть содержится в рудах многих других полезных ископаемых (полиметаллических, медных, железных и др.). Установлено накопление ртути в бокситах, некоторых глинах, горючих сланцах, известняках и доломитах, в углях, природном газе, нефти.
Современные данные свидетельствуют о высоком содержании ртути в мантии (второй от поверхности, после земной коры, оболочке Земли), в результате дегазации которой, а также естественного процесса испарения ртути из земной коры (горных пород, почв, вод), наблюдается явление, получившее название «ртутного дыхания Земли». Процессы эти идут постоянно, но активизируются при извержениях вулканов, землетрясениях, геотермальных явлениях и т. п. Поставка ртути в окружающую среду в результате ртутного дыхания Земли (природная эмиссия) составляет около 3000 т в год. Поставка ртути в атмосферу, обусловленная промышленной деятельностью человека (техногенная эмиссия), оценивается в 3600-4500 т в год.
В природных условиях ртуть обычно мигрирует в трех наиболее распространенных состояниях - Нg0 (элементарная ртуть), Нg2+ (ион двухвалентной ртути), СН3Нg+ (ион метилртути), а также в виде менее распространенного иона Нg22+ Химические соединения Hg(ll) встречаются в природе значительно чаще, нежели Hg(l). В водах между Нg0, Нg22+ и Нg2+ устанавливается равновесие, которое определяется окислительно-востановительным потенциалом раствора и концентрацией различных веществ, формирующих комплексы с Нg2+. Ионы Нg(II) образуют устойчивые комплексы с биологически важными молекулами. Именно высокое химическое сродство ртути (II) и ее метилированных соединений к биомолекулам в существенной мере определяет токсикологическую опасность ртути в условиях окружающей среды.
Распределение и миграция ртути в окружающей среде осуществляются в виде круговорота двух типов. Во-первых, глобального круговорота, включающего циркуляцию паров ртути в атмосфере (от наземных источников в Мировой океан и наоборот). Во-вторых, локального круговорота, основанного на процессах метилирования неорганической ртути, поступающей, главным образом, из техногенных источников. Многие этапы локального круговорота еще недостаточно ясны, но полагают, что он включает циркуляцию в среде обитания диметилртути. Именно с круговоротом второго типа чаще всего связано формирование опасных с экологических позиций ситуаций.
Поступающие в окружающую среду из природных и техногенных источников ртуть и ее соединения подвергаются в ней различным преобразованиям. Неорганические формы ртути (элементарная ртуть Нg0 и неорганический ион Hg2+) претерпевают преобразования в результате окислительно-восстановительных процессов. Пары ртути окисляются в воде в присутствии кислорода неорганическую двухвалентную ртуть (Hg2+), чему в значительной мере способствуют присутствующие в водной среде органические вещества, которых особенно много в зонах загрязнения. В свою очередь, ионная ртуть, поступая или образуясь в воде, способна формировать комплексные соединения с органическим веществом. Наряду с окислением паров ртути образование Hg2+ может происходить при разрушении ртутьорганическихсоединений.
Неорганическая ртуть Hg2+ претерпевает два важных вида превращений в окружающей среде. Первый - это восстановление с образованием паров ртути. Этот процесс, являющийся ключевым в глобальном круговороте ртути, изучен плохо. Известно, что некоторые бактерии способны осуществлять это преобразование. Второй важной реакцией, которой подвергается Hg2+ в природе, является ее превращение в метил- и диметилпроизводные и их последующие взаимопревращения друг в друга. Эта реакция играет ключевую роль в локальном круговороте ртути. Важно то, что метилирование ртути происходит в самых различных условиях: в присутствии и отсутствии кислорода, разными бактериями, в различных водоемах, в почвах и даже в атмосферном воздухе. Особенно интенсивно процессы метилирования протекают в верхнем слое богатых органическим веществом донных отложений водоемов, во взвешенном в воде веществе, а также в слизи, покрывающей рыбу. Метилирование приводит к образованию монометил- и диметилртутных соединений. Монометилртуть (СН3-Hg+) , обычно говорят и пишут просто «метилртуть»), обладая, как уже говорилось, высоким сродством к биологическим молекулам, чрезвычайно активно накапливается живыми организмами. Факторы биоконцентрирования, т. е. отношения содержания метилртути втканяхрыб кее концентрации в воде, могут достигать 10000-100000. Диметилртуть (СН3)2Hg, отличаясь высокой растворимостью и испаряемостью, улетучивается из воды в атмосферу, где может превращаться в монометил ртуть, удаляться с дождевыми осадками и возвращаться в водоемы и в почву, завершая таким образом локальный круговорот ртути.
Типичные природные (фоновые) концентрации паров ртути в приземном слое в атмосферном воздухе обычно составляют 10-15 нг/м3 при колебаниях от 0,5-1 до 20-25 нг/м3. Видимо, именно такие содержания практически безопасны для живых организмов. В зонах загрязнения концентрации возрастают в десятки и сотни раз, а в производственных или загрязненных ртутью помещениях могут достигать экстремально высоких значений (до 1-5 мг/м3). Главной формой ртути в атмосфере являются пары металла (Нg0), меньшее значение имеют ионная форма, органические и неорганические (хлориды, йодиды) соединения. Она также связывается с аэрозолями. В зонах загрязнения концентрации ртути в дождевой воде достигают 0,3-0,5 мкг/л и даже более (при фоне обычно не больше 0,1 мкг/л). В городах наблюдается увеличение количества ртути, переносимой с аэрозолями и атмосферной пылью.
Фоновые уровни ртути в природных почвах зависят от их типа, но в большинстве случаев находятся в пределах 0,01-0,1 мг/кг. Нижние пределы характерны для песчаных почв, верхние - для почв, богатых органическим веществом. Содержания, превышающие эти величины, связаны с влиянием загрязнения. В зонах загрязнения уровни ртути, особенно в верхних горизонтах почв, увеличиваются в десятки-сотни раз, иногда даже в тысячи раз. В почвах ртуть активно аккумулируется гумусом, глинистыми частицами, может мигрировать вниз по почвенному профилю и поступать в грунтовые воды, поглощаться растительностью, в том числе сельскохозяйственной, а также выделяться в виде паров и в составе пыли в атмосферу. При сильном загрязнении почв концентрации ртути в воздухе могут достигать опасных для человека величин.
В поверхностных водах ртуть мигрирует в двух основных фазовых состояниях - в растворе вод (растворенные формы) и в составе взвеси (взвешенные формы). В свою очередь, в растворе вод она может находиться в виде двухвалентного иона, гидроксида ртути, комплексных соединений (с хлором, органическим веществом и др.). Среди соединений Нg (II), мы уже знаем об этом, по своему экологическому и токсикологическому значению особая роль принадлежит ртутьорганическим соединениям. Важнейшими аккумуляторами ртути, особенно в условиях загрязнения, являются взвесь и донные отложения водных объектов. Наиболее высокими концентрациями ртути характеризуются техногенные илы, активно накапливающиеся в реках и водоемах, куда поступают сточные воды промышленности. Уровни содержания ртути в них достигают 100-300 мг/кг и больше (при фоне до 0,1 мг/кг). Известны случаи, когда количество ртути, поступившей со сточными водами и накопившееся в таких илах, составляло десятки и сотни тонн. Нормальное функционирование таких рек и водоемов, их практическое использование возможно только при удалении загрязненных отложений. Использование загрязненных ртутью вод для орошения сельскохозяйственных угодий приводило кее накоплению в сельхозпродукции до уровней, превышающих ПДК.
Типичные фоновые уровни валовой ртути (растворенные формы) в природных пресных водах составляют 0,03-0,07 мкг/л; в донных отложениях рек и пресноводных озер - 0,05-0,1 мг/кг; в пресноводных растениях -0,04-0,06 мг/кг сухой массы. Обычно там, где нет указаний на загрязнение ртутью, ее уровни в питьевых водах редко превышают 0,1 мкг/л. Ртуть, прежде всего метилртуть, относится к веществам, которые накапливаются в пищевой цепи, простым образцом которой может быть, например, следующий ряд: личинка - пескарь - окунь -щука - кошка. Это значит, что в каждом последующем организме содержание метилртути обычно многократно выше, нежели в предыдущем. Пищевые продукты, выращенные и полученные при соблюдении необходимых условий, обычно характеризуются допустимым содержанием ртути [17].
Глава III. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «ЭЛЕМЕНТЫ II ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.Менделеева»
Эксперимент начался со знакомства с ученическим коллективом. При этом для получения представления об успеваемости класса по химии была изучена статистика четвертных оценок по химии и проведен констатирующий контрольный срез знаний по этой дисциплине. (Результаты констатирующего контрольного среза знаний по химии в 9 «Б» классе гимназии №14 приведены ниже в конце главы в виде диаграммы). Затем был проведен ряд уроков по разработанным план-конспектам.
3.1 Урок по теме «Металлы Главной Подгруппы II Группы»
Комплексная дидактическая цель: ознакомить со свойствами металлов главной подгруппы II группы, их получением, нахождением в природе и применением.
В результате изучения модуля учащиеся должны уметь: давать характеристику строения атомов металлов на основе положения элементов в Периодической системе; записывать уравнения химических реакций, характерных для данных металлов: применить знания, полученные на уроках профессионального цикла; работать с дополнительной литературой, таблицами, опорными схемами; решать расчётные и экспериментальные задачи.
Данный модуль включает восемь учебных элементов (УЭ) (здесь приведены 6).
УЭ-0
Цель: проработав материал учебников, опорных схем, конспектов, а также дополнительный материал к модулю, используя знания, полученные на практике и при изучении специальных предметов, вы должны узнать о строении атомов металлов главной подгруппы II группы, свойствах и применении образованных ими простых веществ и важнейших соединений, научиться применять эти знания при изучении металлов других групп, а также темы «Стали. Марки сталей».
Освоение данного модуля расширит ваши знания о металлах и их соединениях, будет способствовать повышению вашего интеллектуального уровня и профессионального мастерства.
Руководство по организации учебного процесса. Задумайтесь о значении данной темы в вашей практической и профессиональной деятельности.
УЭ-1 (10 мин)
Целы определить исходный уровень знаний учащихся об общих свойствах металлов и их соединений.
Руководство по организации учебного процесса. Выполните тестовое задание по теме «Щелочные металлы». Выберите один или несколько правильных ответов. Работайте самостоятельно.
Входной контроль
1. Для щелочных металлов характерны физические свойства
а) высокая температура плавления
б) мягкость
в) твёрдость
г) теплопроводность
2. тонут в воде и плавятся в ней щелочные металлы
а) Na и К в) Li и Fr
б) Rb и Cs г) К и Li
3. К синтезированным элементам относится
a) Cs б) Rb в) Fr г) К
4. Наиболее слабым электролитом является
a) LiOH б) CsOH в) FrOH г) NaOH
Почему?
5. Молярная масса (г/моль) фосфата натрия равна
а) 158 6) 146 в) 164 г) 170
6. В фотоэлементах используют
a) Li б) Na в) Rb г) Cs Почему?
7. Силицидами называют соединения металлов с
а) углеродом в) серой
б) азотом г) кремнием
8. МАССА (Г) 0,3 МОЛЬ СУЛЬФАТА КАЛИЯ РАВНА
а) 40,5 б) 152,2 в) 52,2 г) 450
9. ОДНОВРЕМЕННО могут НАХОДИТЬСЯ В РАСТВОРЕ ИОНЫ
а) K+, Ва2+, SO42-, NO3- б) Li+, Са2+, Cl-, NO3-
в) Zn2+, Ва2+, ОН-, S2- r) Na+, Са2+,СO32-, OH-
10. ЦЕПОЧКЕ ПРЕВРАЩЕНИЙ
хлорид натрия ® натрий ® пероксид натрия
¯
гидроксид натрия ® нерастворимое основание
СООТВЕТСТВУЮТ СХЕМЫ РЕАКЦИЙ:
a) Na + Cl2 ®; Na + H2O ®
б) Na + Br2 ®; Na + H2 ®
в) Na + О2 ®; NaOH + FeCl3 ®
г) Na + S ®; NaOH + BaCl2 ®
Составьте соответствующие уравнения реакций.
Руководство по организации учебного процесса. Выполнив работу, обменяйтесь тетрадями и определите уровень знаний вашего товарища.
Ключ к тесту (выдает преподаватель).
| 1. б. г. | 2. б. | 3. в. | 4. а. У лития самый малый радиус атома | 5. в. |
| 6. г. У него большая способность к отдаче электронов. | 7. г. | 8. в. | 9. б. | 10. а, в. |
УЭ-2 (5-7 мин)
Цель: закрепить знания о строении и свойствах атомов металлов главной подгруппыII группы.
Руководство по организации учебного процесса. Запишите в тетрадях дату и тему урока.
1. Прочитайте внимательно материал...(здесь и далее указаны страницы в учебниках и дополнительной литературе) и составьте схемы строения атомов бериллия, магния, кальция.
2. Устно ответьте на вопросы.
? Как изменяется радиус атомов с возрастанием порядкового номера элемента?
? Как изменяется химическая активность металлов главной подгруппы II группы в зависимости от радиуса атома?
? Какой из этих трёх металлов наиболее активен?
3. Составьте график изменения радиусов атомов металлов главной подгруппы II группы.
Работать индивидуально. Самостоятельно оцените свои знания.
УЭ-3 (10-15 мин)
Цель - изучить физические и химические свойства бериллия, магния и щёлочноземельных металлов.
Руководство по организации учебного процесса. Прочитайте внимательно материал... Работайте в парах. Все выводы и уравнения реакций записывайте в тетрадях. Проконтролируйте друг друга. Один из пары будет отчитываться о проделанной работе.
1. Устно ответьте на вопросы.
? В чём черты сходства и различия простых веществ магния и кальция?
? Почему кальций — лёгкий и прочный металл — не применяют в самолётостроении?
? Сравните свойства кальция со свойствами щелочных металлов. Сделайте вывод.
2. Напишите уравнения реакций, при помощи которых можно осуществить превращения: Mg ® MgO ® MgCl2 ® MgSО4.
3. Соблюдая правила безопасности, проделайте экспериментально реакции, соответствующие следующим схемам: Mg + HCl ®; Са + НСl ®.
Составьте уравнения реакций, объясните разную химическую активность металлов.
УЭ-4 (10 мин)
Цель: познакомиться с соединениями магния, кальция, бериллия, их свойствами и областями применения.
Руководство по организации учебного процесса. Просмотрите презентацию «Щёлочноземельные металлы», рассмотрите коллекцию «Важнейшие природные соединения кальция и магния» (в парах). Прочитайте внимательно... Выпишите в тетрадь формулы основных соединений кальция, магния, бериллия и укажите области их применения (работайте индивидуально).
УЭ-5 (15-20 мин)
Учащиеся были разделены на три группы.
Для группы 1
Цель: изучить применение бериллия и его сшивов в промышленности.
Руководство по организации учебного процесса. Используйте дополнительный материал к модулю и...
Выпишите важнейшие области применения бериллия и сплавов на его основе.
Приготовьте сообщения и творческие отчёты об использовании бериллия как легирующей добавки. Покажите связь этого учебного материала с учебным материалом по технологии металлов, электротехнике, электроматериаловедению, физике. Творческие отчёты сдайте преподавателю.
Для группы 2
Цель: изучить значение магния для жизнедеятельности человека, применение магния и его сплавов, их использование в сварочном и формовочном производствах.
Руководство по организации учебного процесса. Используйте дополнительный материал к модулю и...
1.Ответьте на вопрос: «Какое значение имеет магний для человеческого организма?»
2.Проведите мини-исследование о применении магния в сварочном и формовочном деле. Обратите внимание на состав магниевого термита и его применение.
3.Допишите уравнение реакции сгорания магниевого термита, расставьте коэффициенты, укажите тип реакции: Mg + Fe3O4 ®.
По окончании работы проведите взаимопроверку.
Для группы 3
Цель: изучить применение кальция и его соединений, их значение для живых организмов, использование в будущей профессиональной деятельности.
Руководство по организации учебного процесса. Используйте дополнительный материал к модулю и...
1.Выпишите основные цифры, характеризующие содержание кальция в организме человека (выполняйте индивидуально).
2.Выполните упражнение... (работайте индивидуально).
3.Соблюдая правила безопасности, осуществите экспериментально превращения: Са ® Са(ОН)2 ® СаСО3.
Напишите уравнения реакций. Работайте в парах.
4. Используя дополнительную литературу и знания, полученные на уроках по другим предметам, заполните таблицу. Работайте в парах.
| Область применения | Формула вещества | Используемые свойства |
При заполнении таблицы найдите ответы на следующие вопросы.
? Благодаря каким свойствам кальций используется в сварочном деле?
? Зачем кальций добавляют в расплавы металлов?
? Почему кальций используют для получения редких металлов?
Дополнительный материал
В промышленности магний используется в виде сплавов с алюминием, марганцем, цинком и другими элементами. Все магниевые сплавы хорошо обрабатываются резанием, имеют сравнительно высокую прочность. Сплав магния с алюминием высокопластичен, в горячем состоянии хорошо сваривается и имеет более высокую коррозийную стойкость по сравнению с другими магниевыми сплавами. Для улучшения механических свойств магниевых сплавов их нагревают до 400 °С и охлаждают на воздухе. От коррозии их защищают оксидированием, пропиткой маслами, лаками.
Сплавы бериллия находят применение в самолётостроении, электротехнике. Из бериллия изготовляют окошечки рентгеновских трубок, используя его проницаемость для рентгеновских лучей. В смеси с препаратами радия бериллий служит источником нейтронов.
Магниевый термит для сварки составляют из порошка магния и железной окалины. Продукты сгорания магниевого термита образуются в виде пористой спёкшейся массы оксида магния, которая впитывает в себя расплавленное железо. Магниевый термит применяют в основном для сварки стальных телеграфных и телефонных проводов воздушных линий связи, но он может использоваться и для сварки стыков стальных труб небольших диаметров.
Мрамор - диэлектрик. Он гигроскопичен и поэтому используется в качестве электроизоляционного материала. Его шлифуют и пропитывают органическими веществами — парафином и лаками. Мрамор - негорючий материал. Из него изготовляют распределительные доски и основания для рубильников и щитков с предохранителями в установках, рассчитанных на напряжение до 500 В.
По окончании работы каждая группа отчитывается о выполнении заданий [18, 19].
3.2 Урок по теме «Бериллий, магний и щелочноземельные металлы»
Задачи урока:
Обучающие.
Рассмотреть химические свойства элементов главной подгруппы II группы. Вспомнить двойственный (амфотерный) характер оксида и гидроксида бериллия. Познакомить учащихся со способами получения и с историей открытия этих элементов. Повторить окислительно-восстановительные реакции (ОВР) и алгоритм расстановки коэффициентов в уравнениях таких реакций методом электронного баланса. Продолжить планомерную подготовку учащихся к единому государственному экзамену (выполнение заданий тестового типа, ОВР).
Развивающие:
Развивать мышление учащихся, в том числе умение анализировать, смекалку, эрудицию, познавательный интерес с помощью химического эксперимента.
Воспитательные.
Воспитывать в учащихся такие личностные качества, как целеустремленность, наблюдательность, умение работать в коллективе, ответственность.
Методические приемы объяснения нового материала. Рассказ, беседа, демонстрация опытов, самостоятельная работа учащихся.
Оборудование и реактивы. На столе учителя: магнитофон с кассетой, тигельные щипцы, спиртовка, спички, две чашки Петри, кристаллизатор; фенолфталеин, вода, образцы металлов главной подгруппы II группы: магний и кальций.
На столах учащихся: тестовые задания, справочный материал, опорный конспект «Получение металлов», спички, небольшие чашечки с тампонами из ваты, смоченной солями кальция, стронция и бария.
ХОД УРОКА
Оргмомент. Введение в урок. Актуализация опорных знаний
Здравствуйте, ребята! На сегодняшнем уроке мы продолжим наше увлекательное путешествие в страну «Металлию» и посетим хорошо известный город «Щелочноземельск». Жителями этого города являются элементы IIа группы периодической системы, начиная с кальция. А в пригороде живут остальные элементы этой подгруппы. Давайте перечислим все эти элементы.
Ученик. Это бериллий Ве, магний Mg, кальций Са, стронций Sr, барий Ва и радий Ra.
Учитель. Но готовы ли вы к сегодняшнему путешествию? Давайте проверим, крепки ли ваши знания. Для этого я предлагаю вам тест, состоящий из пяти заданий. К каждому заданию дается четыре варианта ответа. Внимательно прочитайте и задания, и предлагаемые варианты ответов и обведите верный ответ в кружок. Отвечайте только после того, как вы их поняли и проанализировали. На этот вид работы отводится всего 5 мин.
Тест
1. К щелочно-земельным металлам не относят:
а) кальций; б) бериллий;
в) стронций; г) барий.
2. Стабильных природных изотопов не имеет:
а) стронций; б) барий;
в) радий; г) бериллий.
3. Из элементов главной подгруппы II группы хранить на воздухе можно:
а) барий; б) кальций;
в) стронций; г) магний.
4. В простых веществах, образованных элементами главной подгруппы II группы, связь между атомами:
а) ионная; б) ковалентная;
в) металлическая; г) водородная.
5. Сплав под названием бериллиевая бронза внешне похож на золото. Из него изготавливают пружины и клапаны специального назначения. Судя по названию, помимо бериллия в состав сплава входит:
а) железо; б) цинк;
в) серебро; г) медь.
О т в е т ы. 1 – б; 2 в; 3 – г; 4 – в; 5 – г.
Учитель. Молодцы! Вы отлично справились с предложенными заданиями. Вижу, что вы готовы к приобретению новых знаний. Тогда немедля мы двинемся в путь! И первая наша станция ?
«Информационная».
Вывешивается плакат с названием станции
Станция «Информационная»
УЧИТЕЛЬ. На прошлом нашем занятии мы познакомились с магнием и кальцием, а сегодня поговорим о бериллии и радии.
УЧЕНИК (выступает с небольшим сообщением о бериллии). Бериллий был открыт в 1798 г. Л.Вокленом. Название элемента происходит от немецкого слова «Brille», обозначающего очки. В XVIII в. стекла очков готовили из монокристаллических образцов минерала берилла. Бериллий ядовит. Вдыхание паров его оксида вызывает бериллоз – общее отравление организма, заканчивающееся летальным исходом.
УЧИТЕЛЬ. А что вы знаете о радии?
УЧЕНИК. Радий – это редкий радиоактивный элемент, не имеющий стабильных изотопов.
УЧИТЕЛЬ. Действительно, радий – очень редкий радиоактивный металл (содержание в земной коре 1•1010 %). Например, 40 т африканского карналлита содержат 1 г радия. Самый устойчивый изотоп – 226Ra – с периодом полураспада около 1600 лет в результате ядерной реакции превращается в радон:
![]()
Вторым продуктом распада является a-частица, т.е. полностью ионизированный (потерявший все свои электроны) атом гелия.
У Владимира Владимировича Маяковского есть такие строчки о радии:
Поэзия та же добыча радия.
В грамм добыча, в год труды.
Изводишь единого слова ради
тысячи тонн словесной руды.
УЧИТЕЛЬ. Следующая остановка – станция «Химическая». (Звучит песня и вывешивается плакат с названием станции.) Вначале давайте вспомним химические свойства ранее изученных элементов II группы.
Далее учитель демонстрирует опыты.
1. Опыт «Взаимодействие кальция с водой».
Учащиеся пишут уравнение химической реакции:
Ca + 2H2O =
Ca(OH)2 + H2![]() .
.
УЧИТЕЛЬ. В чашке Петри находится кальций, а в кристаллизаторе – вода. Добавляем в воду фенолфталеин. Берем щипцами кусочек кальция, опускаем его в воду. Начинается выделение водорода. За счет образования гидроксида кальция и изменения окраски фенолфталеина вода в кристаллизаторе стала малиновой.
2. Опыт «Взаимодействие магния с кислородом».
Учащиеся вновь пишут уравнение химической реакции:
2Mg + O2 = 2MgO.
УЧИТЕЛЬ. В чашке Петри находится магний. Берем щипцами кусочек магния и поджигаем его. Он быстро и очень ярко сгорает. Образуется оксид магния.
Но бериллий, магний и щелочно-земельные металлы могут взаимодействовать и с другими неметаллами. Образуются соответствующие бинарные соединения – гидриды, галогениды, сульфиды, карбиды, нитриды и т.д. К какому типу принадлежат эти реакции (по числу и составу исходных и полученных веществ)?
Задание для класса.
Составить уравнения химических реакций и назвать получившиеся соединения:
1) барий + водород ®….;
2) бериллий + хлор ®….;
3) кальций + сера ®….;
4) кальций + углерод ®….;
5) магний + азот ®…..
Ученик, который раньше всех справляется с этим заданием, выходит к доске, записывает уравнения реакций и расставляет коэффициенты методом электронного баланса по изученному в 8-м классе алгоритму, одновременно комментируя свои действия.
УЧЕНИК. Подчеркиваем символы элементов, степени окисления которых изменяются; составляем электронные уравнения, определяя число отданных и принятых электронов; уравниваем число отданных и принятых электронов, подобрав наименьшее общее кратное и дополнительные множители, и, наконец, расставляем коэффициенты.
Таким образом, класс еще раз повторит и закрепит алгоритм расстановки коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса, поскольку ОВР являются одним из основных элементов содержания ЕГЭ.
3. Опыт «Взаимодействие с кислотами».
УЧИТЕЛЬ. Все металлы этой подгруппы взаимодействуют с растворами сильных кислот.
Учащиеся записывают уравнения химических реакций:
Mg + H2SO4 = MgSO4 + H2,
Ca + 2HCl = CaCl2 + H2.
УЧИТЕЛЬ. А теперь давайте вспомним, почему щелочно-земельные металлы так называются.
УЧЕНИК. Словом «земля» алхимики обозначали плохо растворимые соединения. Поскольку при смачивании водой оксидов кальция, стронция и бария образовывалась щелочная среда, то эти оксиды стали называть щелочными землями, а металлы – щелочно-земельными.
УЧИТЕЛЬ. В чем особенность бериллия?
УЧЕНИК. Бериллий является элементом, оксид и гидроксид которого проявляют амфотерный характер: они образуют соли при взаимодействии как с кислотами, так и со щелочами.
УЧИТЕЛЬ. Докажите это соответствующими уравнениями реакций.
УЧЕНИК (выходит к доске и записывает уравнения). Взаимодействие оксида бериллия с хлороводородной кислотой:
BeO + 2HCl = BeCl2 + H2O,
взаимодействие оксида бериллия с гидроксидом натрия:
BeO + 2NaOH = Na2BeO2 + H2O.
УЧИТЕЛЬ. А теперь мы проведем такой эксперимент. Перед вами находятся образцы cолей трех металлов. Все они на вид одинаковые. А как же определить, где соль кальция, где бария, а где стронция? Для этого обратимся к справочному материалу.
На данном этапе необходимо провести качественное обнаружение ионов щелочно-земельных металлов: облить тампоны, лежащие в чашечках, этиловым спиртом и поджечь. Обратить внимание на цвет пламени спирта.
Станция «Потребительская»
Далее учитель обращает внимание на опорный конспект, который лежит на столах учеников, активно обсуждает его с классом. Необходимый для запоминания материал учащиеся помечают у себя в тетрадях.
Опорный конспект
|
Получение металлов II группы, главной подгруппы 1. Кальций и стронций получают электролизом расплавов их хлоридов:
2. Для получения бария используют алюмотермию:
3. Бериллий получают восстановлением магнием из фторида:
4. Магний получают в промышленности из морской воды. Ионы магния, содержащиеся в морской воде, осаждают в виде гидроксида, который затем переводят в хлорид, электролизом расплава хлорида магния получают металл:
|
Закрепление изученного материала
УЧИТЕЛЬ. Ну вот и подошло к концу наше путешествие в город «Щелочноземельск». Но не расстраивайтесь, ведь впереди нас с вами ждет увлекательнейшая экскурсия по другим городам «Металлии», таким, как «Железногорск» и «Алюминевск». Но прежде чем уехать в наш городок Рассказово, необходимо ответить на вопросы от жителей «Щелочноземельска».
Для закрепления изученного материала используются карточки, в которых два вопроса: первый направлен на воспроизведение теоретического материала, а второй – это задача или упражнение по химии (применение знаний в знакомой ситуации). На этот вид работы отводится 15 мин.
Проверочная работа по теме «Бериллий, магний и щелочно-земельные металлы»
| К а р т о ч к а 1 |
1. Что общего и в чем различие в строении атомов элементов главной подгруппы II группы периодической системы? Можно ли их назвать элементами с постоянной степенью окисления?
2. Какие вещества из перечисленных ниже могут реагировать с металлическим магнием при обычных условиях:
а) разбавленная серная кислота;
б) концентрированная азотная кислота;
в) гидроксид натрия;
г) хлорид алюминия (раствор);
д) хлорид меди(II) (раствор)?
Напишите уравнения соответствующих реакций.
| К а р т о ч к а 2 |
1. Исходя из положения бария и кальция в периодической системе Д.И.Менделеева, предположите:
а) какой из этих двух металлов имеет более высокую температуру плавления?
б) какой из этих двух металлов более твердый?
в) Какой из этих двух металлов является более сильным восстановителем?
Объясните свои предположения.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
ВаСО3 ® ВаО ® Ва(ОН) 2 ® ВаSО3 ® ВаSО4.
Уравнение последней реакции запишите также в ионной форме.
| К а р т о ч к а 3 |
1. Какие элементы называют щелочноземельными металлами? Можно ли их отождествлять со всеми элементами главной подгруппы II группы периодической системы?
2. Перечислите известные вам химические свойства элементов рассматриваемой подгруппы. Напишите уравнения реакций магния с кислородом, кальция с углеродом, бария с водой, стронция с водородом.
| К а р т о ч к а 4 |
1. Расскажите о биологической роли элементов магния и кальция в живой природе. За счет каких продуктов питания восполняется запас кальция в организме человека?
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca ® Ca(OH) 2 Ca ® CaCO3 Ca ® CaO Ca ® Ca(OH) 2 Ca ® CaCl2 Ca ® Ca.
Уравнение последней реакции запишите также в ионной форме.
| К а р т о ч к а 5 |
1. Какие процессы называют кальциетермией и магниетермией? Какие металлы получают такими способами? К какому типу металлургических процессов относят кальциетермию и магниетермию?
2. Щелочно-земельный металл массой 5 г окислили кислородом воздуха. Полученный оксид прореагировал с водой, в результате образовался гидроксид металла массой 9,25 г. Какой щелочноземельный металл был взят?
| К а р т о ч к а 6 |
1. Кратко охарактеризуйте важнейшие соли щелочных и щелочноземельных металлов и магния, их нахождение и роль в природе, применение, свойства.
2. Оксид и гидроксид бериллия имеют амфотерный характер. Докажите это уравнениями соответствующих реакций.
Итоги урока
УЧИТЕЛЬ. Ребята! Понравился ли вам наш сегодняшний урок? Что нового (интересного, увлекательного, познавательного) вы сегодня для себя узнали? Какие знания, полученные сегодня на уроке, пригодятся вам в вашей дальнейшей жизни?
Учитель благодарит учеников за сотрудничество и за активную работу на уроке.
Домашнее задание
УЧИТЕЛЬ. Осталось только записать домашнее задание.
1) § 12 по учебнику О.С.Габриеляна «Химия. 9 класс» (М.: Дрофа, 2006), упражнение 5 после параграфа.
2) Творческое задание. Написать сочинение (о химическом веществе или процессе), посвященное химии щелочноземельных металлов, или сделать плакаты на эту тему.
Это для всех учеников.
Для учащихся, желающих попробовать свои силы в решении задач высокой сложности: «582,4 г фосфида кальция растворили в хлороводородной кислоте. Получили фосфид водорода и хлорид кальция. Фосфид водорода сожгли и получили оксид фосфора(V), который растворили в 800 мл 25%-го раствора гидроксида натрия, имеющего плотность 1,28 г/см3. Составьте уравнения протекающих реакций и определите, какая соль образовалась в результате этих превращений. Какова массовая доля образовавшейся соли в полученном растворе?»[18, 20-23, 25].
3.3 Задачи и тесты по теме: «Щелочноземельные металлы»
3.3.1 Тест по теме: «Щелочноземельные металлы и их соединения»
1. Какова электронная конфигурация атома кальция?
А) 1s2 2s22р63s2 Б) 1s22s22p6 3s23p64s2
В) 1s22s22p2 Г) 1s22s22p63s22p63d24s2
2. С какими из следующих веществ реагирует кальций?
А) Cl2 Б) Na2O
В) Н2О Г) NaCl
3. С какими веществами реагирует гидроксид кальция?
А) NaOH Б) SO2
В) Na2O Г) HCl
4. Какого состава осадок образуется при взаимодействии растворов солей Na3PO4 и Ca(NO3)2?
А) NaNO3 Б) Ca(OH)2
В) Са3(РО4)2 Г) Na2HPO4
5. Формуле вещества CaO соответствуют названия:
а) гашёная известь; б) известняк;
в) негашёная известь; г) жжёная известь.
6. Самое сильное основание из приведённых ниже оснований – это:
а) Be(OH)2; б) Mg(OH)2; в) Ca(OH)2; г) Ba(OH)2.
7. Из приведённых ниже металлов наиболее энергично реагирует с водой:
а) Be; б) Mg; в) Ca; г) Ba;
8.В ряду химических элементов Be – Mg – Ca – Sr – Ba увеличиваются:
а) радиус атома; б) число электронов на внешнем слое;
в) восстановительные свойства; г) число электронных уровней.
9. Химически чистый оксид кальция образуется:
а) при сжигании кальция на воздухе; б) окислением кальция водой;
в) разложением гашёной извести; г) окислением кальция водородом.
10. Для получения металлического кальция пригодны методы:
а) электролиз раствора его хлорида; б) электролиз расплава его хлорида;
в) восстановление из его оксида; г) электролиз раствора его гидроксида?
11. Расставьте коэффициенты, пользуясь методом электронного баланса, в
![]() следующей схеме реакции: Mg + H2SO4 конц. MgSO4 + H2S + H2O
следующей схеме реакции: Mg + H2SO4 конц. MgSO4 + H2S + H2O
Посчитайте их сумму в правой части уравнения. Укажите верный ответ.
а) 6; б) 7;
в) 9; г) 10.
12.Щелочноземельные металлы получают:
а) металлотермией; б) пирометаллургией;
в) электрометаллургией; г) гидрометаллургией.
13. Минерал, содержащий природный оксид алюминия – это:
а) корунд; б) нефелин;
в) карналлит; г) глинозём.
14. Восстановительные свойства ярче всего выражены у элемента:
а) Be; б) Mg; в) Ca; г) Ba;
15.Общее в строении атомов щелочноземельных металлов – это:
а) одинаковый заряд ядра атома; б) одинаковый радиус атома;
в) два электрона на внешнем г) одинаковая степень окисления?
электронном уровне;
16.Формуле вещества CaSO4 соответствуют названия:
а) природный гипс; б) мёртвый гипс;
в) безводный гипс; г) жжёный гипс.
17.Какова электронная конфигурация атома цинка?
а) …3d104s1; б) …3d94s1;
в) …3d104s2; г) …3d104s0.
18. Укажите степень окисления атома цинка в соединениях:
а) +1; б) +2;
в) +3; г) +6.
19. Цинк металл:
а) желтого цвета;
б) голубовато-серебристого цвета;
в) черного цвета;
г) серовато-белого цвета.
20. Отметьте схемы осуществимых реакций:
а) Zn + HCl ![]() … ;
… ;
б) Zn + NaOH ![]() … ;
… ;
в) Zn + MgSO4 (р-р) ![]() … ;
… ;
г) Zn + Cl2 ![]() … .
… .
21. Cумма коэффициентов в уравнении реакции
ZnS + О2 ![]() …
…
равна:
а) 8; б) 10;
в) 9; г) 11.
22. Пользуясь электрохимическим рядом напряжений металлов, укажите металлы, вытесняемые цинком из растворов их солей.
а) Fe; б) Mg;
в) Sn; г) Ag.
23. При взаимодействии цинка с концентрированной серной кислотой выделяется:
а) SO2; б) S;
в) H2S; г) H2.
24. Оксид цинка обладает:
а) основными свойствами;
б) кислотными свойствами;
в) амфотерными свойствами [24-28].
3.3.2 Задачи
Задачи с решениями [29]
Задача 1. При прокаливании 50 кг чистого карбоната кальция масса твердого вещества уменьшилась на 4,4 кг. Сколько процентов карбоната кальция разложилось
Решение. CaCO3 = CaO + CO2↑
m (CO2) = 4400 г, ν (CO2) = m/М = 4400/4 = 100 моль
ν (CaCO3) = ν (CO2) = 100 моль
m (CaCO3) = ν · М = 100 · 100 = 10000г = 10 кг.
Доля разложившегося CaCO3 равна:
m (CaCO3) / mобщ (CaCO3) = 10/50 = 0,2 = 20%.
Ответ. 20%
Задача 2. 8г металла со степенью окисления +2 прореагировало с водой, и выделилось 4,48 л водорода (н.у.). Определите относительную атомную массу металла и назовите его.
X + 2 H2O = X(OH)2 + H2↑
ν (H2) = V/ Vm = 4,48 / 22,4 = 0,2 моль,
ν (X) = ν (H2) = 0,2 моль,
А (X) = m / ν = 8 / 0,2 = 40 г/моль.
Неизвестный металл кальций Ca
Ответ. Аr(Х) = 40. Кальций.
Задача 3. Из 20 т известняка, содержащего 0,04 массовых долей, или 4%, примеси, получили 12 т гидроксида кальция. Сколько массовых долей, или процентов, это составляет по сравнению с теоретическим выходом?
Решение. m (CaCO3) = 20 · 0,96 = 19,2 т = 19 200 кг,
ν (CaCO3) = m/М = 19200 / 100 = 192 кмоль,
ν(Ca(OH)2) = ν (CaCO3) = 192 кмоль,
mтеор (Ca(OH)2) = ν · М = 192 · 74 = 14208 кг = 14,208 т
Выход (Ca(OH)2) равен:
η (Ca(OH)2) = mпракт / mтеор = 12 / 14, 208 = 0,845 = 84,5 %
Ответ. 84,5 %
Задача 4. Образец жесткой воды содержит 100 мг/л гидрокарбоната кальция и 30 мг/л сульфата кальция. Сколько карбоната натрия потребуется для умягчения 1 м3 такой воды.
Решение.Ca (HCO3)2 + Na2CO3 = CaCO3 ↓ + 2 NaHCO3
CaSO4 + Na2CO3 = CaCO3 ↓ + Na2SO4.
m (Ca (HCO3)2) = 100 мг/л · 1000л = 1000 000 мг = 100 г,
ν (Ca (HCO3)2) = m/М = 100 / 162 = 0, 617 моль,
ν1 (Na2CO3) = ν (Ca (HCO3)2) = 0, 617 моль,
m (CaSO4) = 30 мг/л · 1000 л = 30000 мг = 30 г,
ν (CaSO4) = m/М 30/136 = 0, 221 моль,
ν2 (Na2CO3) = ν (CaSO4) = 0, 221 моль.
ν (Na2CO3) = ν1 (Na2CO3) + ν2 (Na2CO3) = 0, 617 + 0, 221 = 0, 838 моль, m (Na2CO3) = ν · М = 0,838 ·106 = 88, 8г
Ответ. m (Na2CO3) = 88,8 г.
Задания для самостоятельной работы
1. С какими из предложенных веществ будет реагировать оксид бария: ортофосфорная кислота, оксид серы(IV), оксид бериллия, оксид магния, соляная кислота, оксид фосфора(V), хлорид железа(II)? Составьте уравнения возможных реакций.
Запишите уравнения реакций, соответствующие следующим превращениям
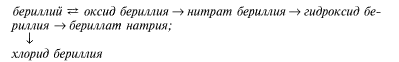
2.Смесь карбонатов кальция и магния массой 26,8 г обработали кислотой. При этом выделилось 6,72 л газа (н. у.). Определите массовые доли компонентов в смеси.
Ответ. ![]() (СаСО3)
= 37,3%;
(СаСО3)
= 37,3%; ![]() (MgСО3)
= 62,7%.
(MgСО3)
= 62,7%.
3.При прокаливании 10 г смеси негашеной извести, кальцинированной соды и питьевой соды выделилось 336 мл газа (н. у.), а при действии на такую же массу смеси хлороводородной кислотой выделилось 1,792 л газа (н. у.). Определите состав смеси в процентах.
Ответ. ![]() (СаО) = 21,8%;
(СаО) = 21,8%; ![]() (Na2CО3)
= 53%;
(Na2CО3)
= 53%; ![]() (NaHCО3)
= 25,2% [30, 31].
(NaHCО3)
= 25,2% [30, 31].
Цепочки превращений
I. 1. Карбонат кальция ![]() оксид кальция ®гидроксид кальция ® карбонат кальция ® нитрат кальция.
оксид кальция ®гидроксид кальция ® карбонат кальция ® нитрат кальция.
2. Магний ® сульфат магния ® нитрат магния ® оксид магния ® ацетат магния.
3. Хлорид кальция ® сульфат кальция ® сульфид кальция ® сульфат кальция ® гидроксид кальция ® оксид кальция ® гидрокарбонат кальция.
4. Магний ® оксид магния ® гидроксид магния ®хлорид магния ® гидроксокарбонат магния ® сульфат магния ® гидроксид магния.
5. Сульфид магния ® оксид магния ® … ® гидроксид магния ® … ® нитрат магния.
6. Кальций ® гидроксид кальция ® карбонат кальция ® оксид кальция ® карбид кальция ® гидроксид кальция ® гидрокарбонат кальция.
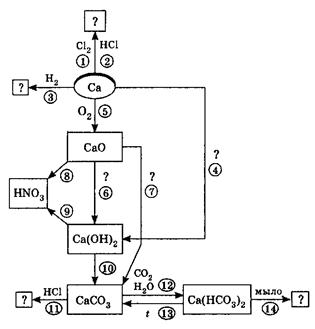
II. Используя схему «Кальций и его соединения», напишите уравнения реакций 1 – 14
Контрольные работы по теме: «Щелочноземельные металлы»
Вариант I
1. Почему химические элементы: кальций, стронций, барий, радий, находящиеся во II группе главной подгруппы ПСХЭ Д. И. Менделеева, называют щелочноземельными металлами? Ответ поясните записью уравнений химических реакций.
2. Почему горящий магний нельзя гасить водой?
3. Напишите уравнения химических реакций, характеризующих химические свойства оксида кальция. Почему строители называют его «кипелкой»?
4. Как в быту частично смягчают жесткую воду: а) не применяя химических реактивов, б) используя домашние средства?
Вариант II
1. С какими из перечисленных веществ, формулы которых: О2, S, Cl2, Н2, Н2О, NaOH, H2SО4, CuSO4, КС1, реагирует кальций? Запишите уравнения химических реакций.
2.Что общего и чем отличаются щелочноземельные и щелочные металлы? Как изменяется химическая активность металлов главной подгруппы второй группы с возрастанием порядковых номеров их образующих химических элементов (укажите стрелкой)?
3.Известковую воду разделили на две порции. Через одну пропускали оксид углерода (IV) до тех пор, пока сначала появившийся осадок не растворился, затем обе порции слили. Предположите, что можно наблюдать при этом. Запишите уравнения всех происходящих реакций и отметьте их признаки. Назовите полученные вещества.
4.Назовите две-три соли щелочноземельных металлов, хорошо и плохо растворимых в воде. Какие из них могут обусловливать жесткость воды?
Вариант III
1.Можно ли получать щелочноземельные металлы электролизом водных растворов их солей? Ответ подтвердите записью уравнений происходящих химических реакций.
2.Назовите два-три способа устранения карбонатной жесткости воды. Ответ поясните уравнениями химических реакций.
3.Какие опыты надо провести, чтобы подтвердить восстановительные свойства магния?
4.Как будет изменяться свечение лампочки в приборе для испытания электропроводности растворов, если его электроды опустить в известковую воду, через которую пропускать оксид углерода (IV)? Почему?
ДОПОЛНИТЕЛЬНЫЕ ЗАДАНИЯ
1. Три химических элемента «А», «Б», «В» образуют различные соединения. Вещество «АВ» — растворяется в воде, окрашивая лакмус в синий цвет. Соединение, в состав которого входят все три химических элемента, не растворяется в воде, но образует растворимое вещество если на него действовать водой и соединение «Б» с «В». Какие химические элементы условно обозначены буквами? О каких соединениях и реакциях идет речь? Составьте уравнения химических реакций.
2. Гидрид бария горит на воздухе, а при реакции с водой образует водород. Запишите уравнения этих реакций и укажите, что окисляется и что восстанавливается в каждой из них.
3. Если оксид кальция на долгое время оставить на воздухе, его масса изменится. Как? Почему?
4. В каком направлении сместится равновесие химической реакции СаСО3 + Н2О + СО2= Са(НСО3) + Q, если: а) понизить температуру, б) повысить давление, в) увеличить концентрацию оксида углерода (IV)?
5. Горы Крымского полуострова в основном состоят из известняка. Объясните причину большого числа пещер в этих горах.
6. Объясните, почему из металлического магния не делают бытовые изделия, а сравнительно легкий и прочный металл кальций не используется в авиационной промышленности [29-32].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ. ВЫВОДЫ
В эксперименте принимали участие ученики 9 классов МОУ СОШ-лицей № 14 г. Нальчик (выборочная совокупность составляла 45 школьников).
После проведения разработанных занятий были проведены контрольные работы и тесты, которые приведены в последнем разделе. Результаты эксперимента в школе приведены в диаграммах, отражающих изменения качества знаний и успеваемости в контрольном (9а) и экспериментальном (9 (б)) классах.
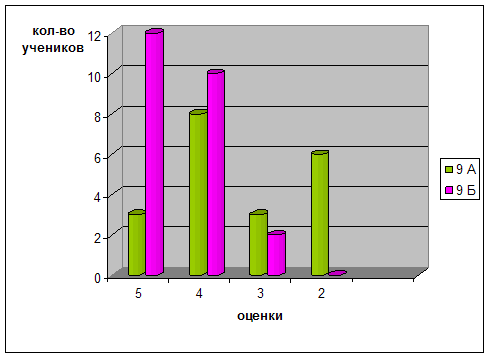
Диаграмма 1. Уровень успеваемости и качество знаний учеников в контрольном и экспериментальном классах
Таким образом, избранная тематика способствовала повышению качества знаний, научного и экологического мировоззрения, а главное вызвала интерес учащихся к более глубокому изучению химии.
ВЫВОДЫ
На основе проведенной работы можно сделать следующие выводы:
1. В программах и учебных пособиях по химии недостаточно отражена экологически важная информация, что мешает плодотворному изучению этих разделов химии
2. Выполненный обзор подтверждает наличие широкого спектра проблем экологического характера, связанных с элементами II группы. Эти сведения могут быть использованы при планировании и реализации учебно-воспитательной работы
3. результаты эксперимента подтверждают эффективность экологизации как средство усовершенствования учебно-воспитательной работы и повышения качества знаний учащихся.
ЛИТЕРАТУРА
1. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992.
2. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 9 класса средней школы. М.: Просвещение, 1992.
3. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 11 класса средней школы. М.: Просвещение, 1992.
4. Ахметов Н.С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
5. Иванова Р.Г. Химия, 8-9 - М.: Просвещение, 2003.
6. Кузнецова Н.Е., Титова И.М., Гара Н.Н. Химия. - М.: Вентана Граф, 1997.
7. Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия. – М.: Дрофа, 1995.
8. Минченков Е. Е., Зазнобина Л.С., Смирнова Т.В. Химия – 8. . – М.: Школа – Пресс, 1998.
9. Журин А.А. Рабочая тетрадь для 8 класса. Ч.2. – М.: Открытый мир, 1996.
10. О. С. Габриелян, Н.П. Воскобойникова, А.В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г.
11. Материалы сайта www.1september.ru
12. Химия: Большой справочник для школьников и поступающих в вузы / Е. А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999. с. 430-438.
13. Алпатьев А.М. Развитие и преобразование окружающей среды. Л.: Наука, 1983
14. Богдановский Г.А. Химическая экология. М.: МГУ, 1994.
15. Миллер Т. Жизнь в окружающей среде. В 3 кн. М: Пангея, 1996, т. 3.
16. Фелленберг Г. Загрязнение природной среды. М.: Мир, 1997.
17. Небел Б. Наука об окружающей среде. В 2 т. М.: Мир, 1993.
18. Сайт «Я иду на урок химии» www.1september.ru
19. Ахметов М.А. Система обучающих заданий: творческий уровень. / Химия в школе, 2004, № 1, с. 21 – 28.
20. Бусев А.И., Ефимов И. П.. Определения, понятия, термины в химии. М.: Просвещение, 1981, 192 с.
21. H.В. Егорова. Наш подход к экологическому образованию учащихся // Химия в школе. – 2002. - № 5. - С. 40 – 43.
22. Табуева Э.М. Экологическое образование как фактор формирования культурного потенциала личности // Химия в школе. – 2004. - №5. – С.18-19.
23. Боброва О.В. Организация самостоятельной работы учащихся при изучении нового материала // Химия в школе. 1996. - №5. – С. 23.
24. Сорокин В.В., Злотников Э. Г. Проверь свои знания: Тесты по химии: Кн. для учащихся. – М.: Просвещение: Учеб. лит., 1997.
25. Н.Н. Черняев, М.А. Ахметов. Тестовые задания и индивидуализация обучения / Химия в школе, 2001, 9.
26. Суровцева Р.П., Гузей Л.С., Останний Н.И., Татур А.О. Тесты по химии. 8-9 классы. Учебно-методическое пособие. М.: Дрофа, 1997.
27. Афонина И.Г. Тестовые задания в курсе химии. // Химия в школе. – 2002. - № 7. - С. 43 45.
28. Химия: Сборник тестовых заданий для подготовки к итоговой аттестации (варианты и ответы, решение расчетных задач). 9 класс (базовый уровень) / Н.В. Ширшина. – Волгоград.: Учитель, 2004. С.81.
29. Р. П. Суровцева, С. В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
30. Гольбрайх З.Е. Сборник задач и упражнений по химии. Учеб. пособие для хим.-техн. вузов. М.: Высш. шк., 1984, стр. 224.
31. Глориозов П.А., Рысс В.Л. Проверочные работы по химии. 7, 8, 9, 10 классы. М.: Просвещение, 1980, 1981, 1985.
32. Гаврусейко Н.П. Проверочные работы по неорганической химии. 8-9 классы. М.: Просвещение, 1990.
© 2009 База Рефератов