
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Дипломная работа: Сравнение некоторых показателей качества питьевой воды в г. Южно-Схалинске
Дипломная работа: Сравнение некоторых показателей качества питьевой воды в г. Южно-Схалинске
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
САХАЛИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИНСТИТУТ ЕСТЕСТВЕННЫХ НАУК
ЕСТЕСТВЕННО-ГЕОГРАФИЧЕСКОЕ ОТДЕЛЕНИЕ
КАФЕДРА БИОЛОГИИ
КАФЕДРА ХИМИИ
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
«СРАВНЕНИЕ НЕКОТОРЫХ ПОКАЗАТЕЛЕЙ КАЧЕСТВА ПИТЬЕВОЙ ВОДЫ В РАЗЛИЧНЫХ РАЙОНАХ
ГОРОДА ЮЖНО-САХАЛИНСКА»
Студент V курса, 511 группы,
Специальность «биология
с доп. спец. химия» Талонина Максима Викторовича
Научный руководитель,
к.х.н., доцент кафедры
химия Г.Н. Зарецкая
Рецензент
Допущена к защите: Защита состоялась:
«___»______________2007 г. «___»______________2007г.
Зав. кафедрой химии, Оценка_____________
к.х.н. С.И. Рогожников Председатель ГАК
Южно-Сахалинск 2007
Содержание
Введение
Глава 1. Сравнительный анализ степени токсичности и патогенеза металлов (Обзор литературы)
1.1 Корреляция ряда физических, химических, физико-химических свойств с токсичностью металлов
1.2 Токсичность комплексных соединений металлов
1.3 Сравнительная токсичность металлов в виде катионов-анионов
1.4 Всасывание, транспорт и распределение металлов
1.5 Краткая характеристика патогенеза некоторых металлов
1.5.1 Кадмий
1.5.2 Ртуть
1.5.3 Свинец
Глава 2. Материалы и методы исследования
2.1 Состояние качества питьевой воды в г.Южно-Сахалинске на начало 2004 года
2.2 Характеристика районов г. Южно-Сахалинска в которых происходило исследование качества питьевой воды
2.3 Отбор проб воды для санитарно-химического исследования. ГОСТ 4979 69 от 1 февраля 2001 года
2.4 Метод инверсионной вольтамперометрии
2.4.1 Приготовление вспомогательных растворов для измерения концентрации ионов металлов в пробах питьевой воды
2.4.2 Подготовка проб питьевой воды
2.4.3 Проверка электрохимической ячейки
2.4.4 Наименование основных операций выполнения измерений массовой концентрации ионов
2.4.5 Обработка результатов измерений
2.4.6 Очистка электродов.
2.5 Определение общей жесткости воды методом комплексонометрического титрования
2.6 Санитарно-гигиеническое нормирование веществ в водной среде
2.7 Расчет индекса загрязнения вод
Глава 3 Определение некоторых показателей качества питьевой воды в различных районах г.Южно-Сахалинска и их сравнительный анализ
3.1 Показатели качества питьевой воды в различных районах г.Южно-Сахалинска представленные в таблицах 7-11
3.2. Сравнительный анализ индекса загрязнения вод в различных районах г.Южно-Сахалинска за период с 2004-2006 г
Заключение
Литература
Введение
«Вода! У тебя нет ни вкуса,
ни цвета, ни запаха, тебя невозможно
описать…
Нельзя сказать, что ты необходима
для жизни, ты сама жизнь…
Ты самое большое богатство в мире».
Антуан де Сент-Экзюпери
Воды, находящиеся на поверхности планеты (материковые и океанические), образуют геологическую оболочку, называемую гидросферой. Гидросфера находится в тесной связи с другими сферами Земли: литосферой, атмосферой и биосферой. Водные пространства – акватории – занимают значительно большую часть поверхности земного шара по сравнению с сушей. По современным данным, акватория мирового океана составляет 70,8%, однако 95% её сосредоточено в морях и океанах, 4% - во льдах Арктики и Антарктики, 1% составляет пресная вода рек и озёр. Кроме того, большие запасы воды имеются в толще Земли – это так называемые подземные воды.
Вода постоянно находится в движении, перемещаясь с течениями рек и морей, а также испаряясь с поверхности водоёмов и выпадая затем в виде атмосферных осадков. Она аккумулирует тепло, влияет на распределение солнечной энергии на Земле и образование различных по климатическим особенностям районов. Вода водоёмов способна самоочищаться и обеззараживаться. Это сложный физико-химический процесс.
Вода жизненно необходима. Она нужна везде – в быту, сельском хозяйстве и промышленности. Вода необходима организму в большей степени, чем всё остальное за исключением кислорода. Здоровый человек может прожить без пищи 3-4 недели, а без воды – лишь несколько дней.
Живой
клетке вода требуется как для сохранения своей структуры, так и для нормального
функционирования; она составляет примерно ![]() массы тела. Вода помогает
регулировать температуру тела, служит в качестве смазки, облегчающей движение
суставов. Она играет важную роль в построении и восстановлении тканей тела.
массы тела. Вода помогает
регулировать температуру тела, служит в качестве смазки, облегчающей движение
суставов. Она играет важную роль в построении и восстановлении тканей тела.
При резком сокращении потребления воды человек заболевает, или его организм начинает хуже функционировать. Но вода нужна, конечно, не только для питья: она помогает также содержать человеку в хорошем гигиеническом состоянии своё тело, жилище и среду обитания.
Без воды невозможна личная гигиена, то есть комплекс практических действий и навыков, обеспечивающих защиту организма от болезней и поддерживающих здоровье человека на высоком уровне.
Общеизвестно, что экологические проблемы защиты окружающей среды и охраны здоровья человека в современной России стоят особенно остро. Известно также, что экологический фактор занимает второе место среди прочих, определяющий физиологическое благополучие человека (на первом месте образ жизни, на третьем наследственность). Из выше названного экологического фактора, санитарно-гигиеническое состояние питьевой воды является одним из ключевых.
Нами предпринята попытка оценить качество питьевой воды с помощью высокочувствительного метода инверсионной вольтамперометрии, позволяющего определять содержание ксенобиотиков в сверхмалых концентрациях. В силу специфических особенностей данного метода возможно обнаружение лишь ряда тяжёлых металлов и некоторых неметаллов (As, Se). Не вошёл в эту работу и бактериологический анализ. Всё перечисленное не позволяет сделать оценку вполне объективной.
Кроме измерения массовой концентрации тяжелых металлов в пробах питьевой воды нами, также определена ее общая жесткость.
В ходе статистической обработки использовались данные лаборатории городской СЭС, но мы не имели возможности проверить все предоставленные нам сведения, тем не менее, мы постарались обобщить весь материал и на основании собственной исследовательской работы сделать вывод.
Целью данной работы явилось:
Выяснить, cсоответствует ли питьевая вода г.Южно-Сахалинска общесанитарным нормам, а также изучить динамику изменения индекса загрязнения вод(ИЗВ).
В задачи исследования входило:
1) выяснить степень очистки питьевой воды производимой на водоочистительных сооружениях горводоканала по сравнению с водой на неподведомственной ему территории.
2) на основе полученных данных обозначить меры по повышению качества питьевой воды.
Выражаем глубокую благодарность и признательность коллективам горводоканала и городской СЭС, а также заместителю начальника Сахалинской судебной лаборатории Котлярову Анатолию Емельяновичу, за предоставление данных и оказание помощи для написания этой работы.
Глава 1. Сравнительный анализ степени токсичности и патогенеза металлов (Обзор литературы) 1.1 Корреляция ряда физических, химических, физико-химических свойств с токсичностью металлов
Уже давно, еще в XIX веке, делались попытки связать токсическое действие металлов с отдельными их свойствами. Так, в 1882г. (Лужников, 1999) сопоставляли токсичность солей металлов в опытах на изолированном сердце лягушки и на рыбах. В этих опытах степень токсичности металлов, судя по действующим концентрациям растворов, и их атомные массы расположились в прямой зависимости.
Выяснилось, однако, что строгого соответствия между атомным весом и действующей концентрацией нет. Кроме того, токсичность одних и тех же металлов была неодинаковой в зависимости от объекта действия.Ученые пришли к заключению, что токсичность металлов не строго соответствует их атомному весу даже для металлов одного семейства. Например, палладий токсичнее платины (при сопоставлении действия их солей), цезий менее токсичен, чем рубидий, и т.д. На связь токсичности металлов с их атомным весом и на нарастание силы действия с увеличением атомного веса указывал также французские исследователи 1892г. (Ольгин, 1993).Тем не менее, имеется тенденция к увеличению токсичности с увеличением атомного веса, хотя есть и явные исключения, например бериллий, медь. Последняя для многих клеток много токсичнее, чем такие металлы, как барий, стронций и др., несмотря на меньший атомный вес. Различна и сила действия железа в двух- и трехатомном состоянии, несмотря на одинаковый в обоих случаях атомный вес элемента, что также говорит против преимущественного значения атомного веса для токсичности металлов.
В 1948г. Николаев Е.М. анализируя и суммируя литературные данные о связи ядовитого действия металлов с их атомным весом, не нашел достаточно убедительных доказательств существования общей закономерности увеличения токсичности с ростом атомной массы. Другие авторы видели связь действия металлов с их атомным весом в том, что по мере увеличения последнего в данной группе элементов уменьшается их содержание в животном организме и увеличивается токсичность.Это отмечали В.И.Вернадский и А.И. Войнар. Действительно, токсичность металлов с большой атомной массой, таких, как свинец, ртуть, золото, серебро и др., велика, а наличие их в животном организме либо оспаривается, либо очень невысоко.
В основу классификации элементов и периодической системы легли характеристики, вытекающие из самой природы элемента и его основного, «фундаментального», свойства. Таким свойством является положительный заряд атома.
В научном мире крепло убеждение, что такие показатели, как электроотрицательность, ионный радиус, являются наиболее надежными параметрами в характеристике элементов. Эти же свойства, по мнению многих авторов, могут иметь влияние на биологическую активность металлов или связаны с последней, в частности при образовании ими комплексов в биосредах, так как стабильность комплексов, в свою очередь, является функцией электронных свойств металлов(Мишин, 1985).
Одними из первых группа английских биологов под руководством А. Maзевса в 1904г. сделали попытку связать токсичность металлов с физическими свойствами, иными, чем их атомный вес. Он предположил, что физиологическая активность металла определяется легкостью, с которой он отдает свой электрон, степенью сродства последнего к заряду элемента. Более прочная связь обуславливает малую активность элемента. В качестве физического показателя этой связи А.Maзевс избрал нормальный потенциал. Последний характеризует способность металла переходить в раствор в виде ионов. Нормальный потенциал определяется как разность потенциалов между металлом в напряженном состоянии и раствором, содержащим его ионы при активности, равной единице. Чем отрицательнее нормальный потенциал металла, тем легче этот металл растворяется (Пряшин, 1994).
Связь нормального потенциала металлов с силой их действия А. Maзевс проверял в опытах по изучению влияния растворов хлоридов разных металлов на изолированный нерв и яйца морского ежа. В результате изучения действия 27 металлов автор пришел к заключению, что их токсичность меняется обратно значению нормального потенциала.
В результате своих расследований А. Mазевс предложил эмпирическую формулу для расчета силы действия раствора любой соли, если известна ядовитость раствора какой-нибудь иной соли:
Va = 0.14 Vo (Ea / E o) (1.1)
где Vа – искомая концентрация неизвестной соли, вызывающая нужный эффект; Vо эффективная концентрация известной соли; Еа – нормальный потенциал металла неизвестной соли; Ео – нормальный потенциал металла известной соли; 0,14 разница нормальных потенциалов двух последовательных солей.
А. Maзевс также обнаружил обратную зависимость между токсичностью металлов и величиной их атомных объемов. Так как значение нормальных потенциалов и атомных объемов изменяются периодически, то и в токсичности металлов должна отмечаться такая же периодичность.
Соли металлов в растворах могут образовывать ионы, гидраты, комплексы. В свою очередь последние могут вновь диссоциировать, образуя ионы. Поэтому токсичность, прежде всего, может быть связана с действием ионов и со свойствами атомов и ионов металлов, характеризующими их активность, способность вступать в связь с протоплазмой, с отдельными ее компонентами.
В 1949г. М. Сейфритз показал, что действие солей связано с рядом свойств именно ионов (катионов), с некоторыми характеристиками металлов как атомов или ионов. Этими характеристиками, по его данным, были атомный вес, радиус ионов, электроотрицательность, а также степень гидратации ионов. Последняя играет как бы защитную роль, создавая вокруг ионов оболочку, препятствующую реакции с компонентами окружающей среды, но не влияет на токсичность самого металла. Порядок токсичности обратен степени гидратации. Так, литий гидратирован сильно, а цезий мало; последний и более токсичен(Хворин, 1985).
Так как и степень гидратации, и подвижность ионов снижаются с повышением атомного веса, то для более тяжелых элементов эти характеристики имеют меньшее значение.
По мнению М. Сейфритза, наиболее вероятным физическим фактором, с которым связана большая токсичность тяжелых металлов, является электроотрицательность: она может влиять на легкость взаимодействия металла с протоплазмой. В периодической системе элементов электроотрицательность, в общем, увеличивается слева направо в каждом периоде; токсичность связана с электроотрицательностью, и таким образом подтверждается общая тенденция к увеличению ядовитости с увеличением атомного веса. Однако М. Сейфритз считал, что нельзя выделить одно доминирующее свойство, не учитывая влияния других и их взаимную связь. Он также полагал, что отдельные характеристики свойств металлов связаны с их токсическим действием разными путями, например, с селективностью или большим сродством к отдельным химическим группам, таким, как способность многих металлов образовывать ковалентные связи с атомом серы, что определяет механизм действия.
Используя накопленные экспериментальные данные о токсичности металлов, некоторые исследователи сделали попытку установить сравнительную токсичность металлов для теплокровных животных, а также связь между ядовитостью и теми или иными физическими и физико-химическими свойствами металлов и их соединений. Так, У.Левис в 1958г. по степени токсичности для белых мышей разделил металлы на три группы, взяв в качестве критерия дозы, которые вызывают гибель половины животных, взятых в опыт (DL50) при внутрибрюшинном или подкожном введении хлористых солей:
1) Hg, In, Tl, Au, As, Cd, V, Ba.
2) Mn, Co, Cu, Fe, Mo, W, Cs, Sr, U.
3) Ca, Li, K, Sm, Ce, Na, Mg.
Наиболее ядовитыми оказались катионы ртути, индия, кадмия, меди, таллия т.е. те же металлы, что и для организмов, обитающих в водной среде, или для плесеней (Юрьева, 1998).
Сопоставляя порядок токсичности металлов с их положением в периодической системе элементов, (Ярцев, 1988) Ж.Биенвьену и соавторы в 1963г. сделали заключение о периодических изменениях токсичности металлов, связанных с положением последних в этой системе.
1.2 Токсичность комплексных соединений металловНе обнаружено сколько-нибудь значительной корреляции между токсичностью солей металлов и их растворимостью. Однако установлено, что способность к комплексообразованию в известной степени характеризует поведение катионов в биологических средах.
Зависимость токсичности хлористых солей от стабильности комплексов металлов отмечал также Г. Рольф-Диетер в 1962г. Токсичность солей в его опытах нарастала в порядке:Mo>Fe>Co>Zn>Ni>Cu а стабильность комплексов этих металлов: Mo < Fe < Co < Zn < Ni < Cu.
Константы стабильности металлов с разными лигандами в биологических субстратах коррелируют в известной мере с константой стабильности металлов с этилендиаминтетрауксусной кислотой (ЭДТА). Это было показано для хелатов и комплексов двухвалентных металлов с аспаргиновой кислотой, глицилглицином, триптофаном, аланином и др. Так, например, порядок стабильности комплексов металлов с ЭДТА таков: Fe > Ga > Cu > Ni > Pb > Y > Cd > Co > Mn > Ca, а порядок стабильности их комплексов с аминокислотами следующий: Hg > Cu > Ni > Pb > Zn > Co > Cd > Mn > Ca. Прочность комплексов металлов с ЭДТА всегда больше, чем стабильность комплексов тех же металлов с такими комплексонами организма, как белки, аминокислоты, карбоновые кислоты, липиды. Поэтому, допустимо переносить закономерности, касающиеся корреляции между токсичностью катионов металлов и константой стабильности их хелатов с ЭДТА, также и на стабильность комплексов металлов с рядом других лигандов, возникающих в биологических средах, в живых объектах. (Левина , 1982).
Для осуществления токсического действия имеют большое значение растворимость, определенная избирательность накопления и действия, степень «сродства» металла к той или иной функциональной группе клеток, к имеющимся в последних химических группировках и т.д.
Однако при достаточной дозе введенного металла большое количество катионов поступает в циркуляцию и распределяется по всему организму, вступает в контакт со всеми тканями, нарушая их нормальную функцию, чем обусловливается токсический и летальный эффект. При этом важное значение может иметь как быстрота, так и прочность образующихся в биологических средах комплексов металлов. Поэтому, видимо, острая токсичность и оказывается коррелирующей со стабильностью комплексов металлов с ЭДТА или липидами и др., со степенью нерастворимости сульфидов металлов. Степень прочности комплексов металлов с ЭДТА в свою очередь коррелирует со способностью металлов образовывать комплексы с такими биологически важными образованиями, как белки, ферменты, субстраты клеточных оболочек. Токсичность таких сильных ядов, как ртуть, кадмий, индий, линейно возрастает с увеличением их константы стабильности в комплексах с ЭДТА, а также с прочностью их сульфидов. Эти металлы образуют с атомами серы более прочные соединения, чем ионы биометаллов. Они блокируют активные центры ферментов и выключают их из управления метаболизмом. Тяжелые металлы часто называют тиоловыми ядами.
Стабильность комплексов коррелирует линейно с потенциалом ионизации и поэтому может влиять на степень взаимодействия катионов с биологическим субстратом. Связана со стабильностью комплексов и электроотрицательность, которая является мерой реакции ионов металлов с элементами клеточной мембраны. Этим может быть объяснена корреляция токсичности с электроотрицательностью. Но электроотрицательность и потенциал ионизации в свою очередь связаны с положением элемента в периодической системе, со строением электронной оболочки. Так, первичный потенциал ионизации уменьшается по мере увеличения атомного номера элемента в своей группе. В свою очередь, потенциал ионизации и атомные радиусы связаны между собой: как правило, потенциал уменьшается при увеличении атомного радиуса (легче происходит отрыв внешнего электрона).
Прочность комплексов тем выше, чем меньше радиус, как центрального иона, так и аддентов. Устойчивость комплексов связана также и с электронной конфигурацией, прежде всего, металла, но, в известной мере, и лигандов. Константа стабильности (или нестабильности) комплексного соединения коррелирует с его электронной структурой: она тем выше, чем больше электросродство катиона, чем ниже его потенциал ионизации, меньше атомный радиус. Однако наиболее устойчивы соединения с циклическими лигандами, содержащими пяти и шестичленные кольца. На устойчивость комплексов в значительной степени влияет рН среды (Злыкин , 1995).
Только в самое последнее время сравнительная токсичность металлов в виде комплексных соединений была изучена в прямых опытах. Так, C. Нофре в 1963г. определил ядовитость ряда металлов в виде хелатов с ЭДТА при внутрибрюшинном введении белым мышам и сравнил ее с токсичностью солей тех же металлов, как оказалось, в большинстве случаев хелаты металлов менее токсичны, чем соли.
По мнению некоторых авторов группа металлов, в том числе «тяжелых», может быть охарактеризована как группа токсических агентов не только с универсальной активностью, но и с индивидуальной специфичностью их действия.
Как уже указывалось выше, токсичность металлов связана как со строением самого металла, так и с функциональной и структурной организацией биологического объекта. С другой стороны, каждая функциональная единица, реагирующая с металлом, может иметь большее или меньшее значение для нормальной жизнедеятельности, что сказывается на силе токсического эффекта. Это обстоятельство может определить и особенности действия и объяснить специфичность поражения отдельными металлами.
Общетоксическое действие металлов может быть связано с неспецифическим торможением ряда ферментов в силу денатурации белков вообще. Но ряду металлов свойственно специфическое угнетение определенных ферментов уже в очень малых концентрациях. Поэтому особенности отравления отдельными металлами выявляются преимущественно при длительном контакте с ними.
Установленная корреляционная связь между острой ядовитостью металлов и рядом физических, физико-химических, химических свойств металлов – их атомов и ионов подтверждает наличие таких связей для химических соединений разных классов. Такие связи позволят по отдельным характеристикам металла представить силу его токсического действия. Они создают предпосылки для предвидения сравнительной токсичности неорганических соединений металлов, для ориентировочного суждения о силе действия одного металла по известной токсичности другого. Разумеется, такие суждения имеют лишь приближенный характер, но они могут быть использованы как в экспериментальной токсикологии, так и в гигиенической практике.
Математическая обработка данных о корреляционных связях между токсичностью и той или иной характеристикой атомов или ионов металлов привела к разработке эмпирических уравнений, позволяющих предвидеть токсические дозы металлов, например, для объектов, находящихся в водной среде. Подобная обработка данных о токсичности для теплокровных животных (мышей) позволила Е.И.Люблиной в 1965г., предложить эмпирические формулы, связывающие токсичность солей металлов с такими показателями, как молекулярный вес (М), нормальный потенциал элемента (Н.П.); растворимость сульфидов в воде (lg S) (Крылов, 1988).
Предложенные ею формулы (при значимости коэффициентов корреляции > 0,999) приводятся ниже:
1) lg DL50 = 0,9 – 0,006 M, где М – молекулярный вес;
2) lg DL50 = - 0,67 Н.П. – 1,0, где Н.П. – нормальный потенциал;
3) lg DL50 = - 0,2 lg S + 0,75, где lg S – константа стабильности сульфидов и металлов.
Такие же эмпирические формулы получены для соотношений между токсичностью и значениями электроотрицательности, работы выхода электрона, первого потенциала ионизации, размерами атомных радиусов:
1) lg DL50 в мА/кг = 2,8 – 0,4 П.И., где П.И. – значение потенциала ионизации;
2) lg DL50 мА/кг = 2,8 – 2,2 Э, где Э – значение электроотрицательности;
3) lg DL50 мА/кг = 3,6 – А, где А – работа выхода электрона (эв);
4) lg DL50 мА/кг = - 9,28 + 5,3 AR, где AR – значение атомных радиусов (А).
1.3 Сравнительная токсичность металлов в виде катионов-анионовОдни и те же элементы – металлы и неметаллы, последние особенно часто, встречаются в соединениях и в виде катионов, и в виде анионов. В свое время Н.В.Лазарев в 1938г. указывал на возможность неодинаковой токсичности катионов и анионов одних и тех же элементов, приводя пример разной токсичности бихроматов и хроматов и солей хрома ( Мишин, 1985).
Делались попытки сопоставить токсичность одних и тех же элементов в зависимости от того, играют ли они роль катионов или анионов, в равных условиях, и учитывая дозы элемента. Полученные данные оказались неравнозначными. Только для хрома и мышьяка их токсичность в виде аниона убедительно выше, чем при введении в организм в виде катиона.
В вопросе по сравнительной токсичности самих элементов в виде анионов можно сослаться на данные C.Нофре полученные им в 1963г., говорящие о том, что сила действия ряда неметаллов – анионов зависит от степени окисления элемента в соединении. Как показано в экспериментах, токсичность снижается с повышением степени окисления, исключение составляет бор (Левина, 1982).
Известно, что неорганические соединения, как-то: кислоты, основания, большая часть солей типичные электролиты и в разбавленных растворах полностью распадаются на ионы при любых значениях рН. В зависимости от валентности металла, а также от аниона, от комбинации их в соединении, степень диссоциации может быть различной. Более полно диссоциируют соли одновалентных катионов и анионов, слабее – соли, образованные двухвалентными металлами и анионами.
Помимо электролитической диссоциации, происходит и гидролиз солей, а именно в том случае, когда происходит обменная реакция вещества с водой и ионы растворенного вещества способны образовывать мало диссоциированные соединения с Н+ и ОН- или с обоими (образуются кислоты и основания).
Таким образом, сила действия металла может быть связана как со степенью диссоциации, так и со способностью его соединений к гидролизу, так как от результата этих процессов будет зависеть число свободных ионов или стойких соединений металла.
Существует несколько точек зрения на значение аниона в неорганической соли. Как уже упоминалось, A.Mазевс считал, что для действия солей важны оба иона, а эффект является суммой действия катиона и аниона. По его мнению, действие, например, хлорида, сульфата, нитрата, ацетата натрия примерно одинаково не в силу эффекта, зависящего только от катиона, а потому, что все указанные анионы имеют одинаковое или близкое значение нормального потенциала, а последний связан с токсичностью обратной зависимостью.
Ж. Лоеб в 1901г., а также P. Франкел в 1928 г. склонялись скорее к тому, что токсичность солей металлов в основном зависит от катиона, мало изменяясь от наличия того или иного кислотного радикала соли. Однако, по мнению P. Франкел, бактерицидное действие солей зависит и от анионов, так как здесь вступают в силу различия в степени диссоциации или гидролиза солей.
Позднее в 1949г. M. Сейфритз , анализируя экспериментальные данные, пришел к выводу, что токсичность соединений металлов (солей) определяется только свободным ионом металла и мало изменяется при замене кислотного радикала.
Таким образом, современные данные говорят, что в токсическом действии солей металлов основное значение принадлежит самому металлу – катиону. Кислотный радикал может изменять этот эффект в незначительной степени (в силу изменения растворимости или степени диссоциации соли). Например, это существенно, когда речь идет о карбонатах. Эти соли менее токсичны в силу слабой растворимости и такой же слабой диссоциации. Исключение составляют карбонаты металлов первой группы.
Не только общая токсичность, определяемая по DL50, но и другие, часто специфические, эффекты солей металлов связаны с действием и дозой именно металла. Это показано на примере специфического эпилирующего действия таллия, которое одинаково при равных дозах металла, введенного в виде разнообразных солей. При этом установлено, что специфическое действие редкоземельных элементов на свертываемость крови определяется только ионом металла и не зависит от аниона. (Мишин, 1985).
Имеются данные, указывающие на то, что степень окисления основного элемента в анионе может влиять на токсичность солей. Так, токсичность анионов, содержащих галогены, увеличивается с возрастанием степени окисления галогена, а ядовитость анионов, включающих элементы V-VI групп периодической системы элементов (азот, серу), наоборот, снижается при повышении валентности.
Для галогенных соединений металлов большое значение имеет степень диссоциации и главным образом гидролиза с образованием кислот. Такой гидролиз известен для галогенов многих металлов: олова, титана, тантала, ниобия, германия и др. Их токсическое, а именно раздражающее, действие связано с гидролизом этих соединений как в водных растворах, во влажном воздухе, так и при соприкосновении с влажными средами организма, в первую очередь – на слизистых оболочках дыхательных путей.
Биологический и токсический эффект солей, как указано выше, может изменяться в силу специфичности действия анионов, например, галогенов, а также из-за гидролиза, сопровождающегося образованием свободных кислот или оснований. Ведущая же роль принадлежит катиону металла.
Не совсем одинаково действие простых и комплексных солей редкоземельных элементов (Пряшин, 1994). Первые действуют фазно: после депрессии происходит нормализация состояния животных, но затем наблюдается резкое его ухудшение; комплексные же соли сразу вызывают резкую депрессию и быструю гибель животных. Однако хелатные комплексы так же, как и цитратные комплексы редкоземельных металлов, менее токсичны, чем их соли.
1.4 Всасывание, транспорт и распределение металловДля токсического действия необходим контакт яда с биологическим субстратом – объектом этого действия. Контакт может осуществляться при циркуляции яда во всех жидких средах организма (крови, лимфе, межтканевой жидкости и т.п.), а также при непосредственном соприкосновении с оболочками клеток, цитоплазмой и е составными элементами.
В силу этого в токсическом действии металлов, как и других ядов, большое значение имеют их транспорт, распределение, концентрация в месте действия, метаболизм, скорость и пути выделения. Вопросы метаболизма ядов, имеющие большое значение для понимания действия органических веществ, мало изучены в отношении металлов. Однако некоторые данные о превращении металлов в живом организме все же имеются. Известны происходящие в организме восстановительные процессы, при которых металлы и неметаллы из состояния высшей валентности переходят в состояние низшей валентности. Это установлено для железа, марганца, молибдена, ванадия, хрома, мышьяка.
Концентрация металлов в месте действия, как и вообще любых ядов или фармакологических средств, является результатом динамических процессов всасывания из места поступления, проникания в жидкие среды, транспорта, распределения в органах и тканях, химических превращений в последних и процессов выведения из организма. Последнее осуществляется с различной скоростью и различными путями.
Резорбция и распределение, а также выделение металлов, как и вообще экзогенных ядов, в конечном итоге схематически представляют как ряд процессов распределения между внешней средой (вода, воздух) и биосредами. В свою очередь в последних происходит перераспределение между фазами: кровью и тканевыми и межклеточными жидкостями, между последними и клетками, между внутриклеточными структурами.
Для осуществления непосредственного контакта любого яда с тканями, клетками, рецепторами и т.д. ему приходится проникать через множество пограничных поверхностей – биологических мембран, их роль играет кожа, слизистая желудочно-кишечного тракта, эндотелии сосудов, альвеолярный эпителий, вообще гистогематические барьеры, оболочка клеток, внутриклеточных структур и т.д. По современным представлениям биологические мембраны имеют белково-липидную структуру. Клеточные мембраны представляют самостоятельный структурный элемент, активно участвующий в процессах обмена веществ. Мембраны рассматриваются как биологические, динамические структуры, содержащие ряд важных энзимных систем. Повреждения, вызываемые ядами, нарушение функций энзимов приводят к изменению проницаемости транспорта через эти оболочки.
Поверхность клеточных оболочек несет отрицательный заряд, что показано на примере эритроцитов, сперматозоидов, многих бактерий; но, в тоже время, на отдельных участках заряд может меняться. Ионы (катионы), достигнув поверхности клетки, либо фиксируются на ней, либо отталкиваются в силу одноименности заряда. Например, полагают, что анионы проходят эритроциты через положительно заряженные поры; положительно заряженные ионы не могут проникнуть через них, с чем связана плохая проницаемость эритроцитов и других клеток для катионов. Одни анионы (хлор, бром) проникают в эритроциты почти мгновенно, но ряд других более сложных (например, JO-3, селеновая кислота) накапливаются в эритроцитах очень медленно.
Схематически транспорт веществ через пограничные поверхности можно разделить на: а) поступление веществ в клетки путем диффузии через водные и липидные барьеры; б) вода и растворенные в ней вещества как бы фильтруются в клетки (вступают в силу гидродинамические и осмотические законы); в) перенос липоидонерастворимых веществ объясняется образованием их соединений с компонентами мембраны. Считают, что двухвалентные металлы проникают через пограничные мембраны в виде фосфатных комплексов.
Клеточные оболочки могут играть и защитную роль в отношении вредного действия ядов, в частности металлов, которые в первую очередь фиксируются на поверхности и лишь медленно проникают вглубь клетки.
Соли металлов как хорошо растворимые и диссоциирующие соединения, попадая в организм, распадаются на ионы.
Скорость и полнота ресорбции зависят от соотношения между ионизированной и неионизированной частью молекулы.
Металлы высшей валентности и так называемые тяжелые металлы, склонные к образованию очень трудно растворимых гидроксидов, фосфатов, альбуминатов или весьма стойких комплексов, плохо всасываются из желудочно-кишечного тракта или при любых других путях введения.
Таким образом, указанные свойства металлов и их соединений, а именно, способность к диссоциации, образование свободных ионов, гидроксидов, образование прочных альбуминатов, гидратов, фосфатов определяют количество и состояние металла в организме, в первую очередь в крови.
Свободные ионы металлов быстро удаляются из крови; по данным Д.И.Семенова и И.П.Трегубенко - в течение 5 минут. Они также быстро выделяются из организма или накапливаются в скелете. Последнее, так же как и быстрое выделение с мочой, обычно указывает на то, что металл в организме циркулирует в ионизированном или молекулярно-дисперсном состоянии.
Так, благодаря способности к комплексообразованию металлы в тканях откладываются в виде комплексных соединений с белками, аминокислотами. Однако распределение их по большей части неравномерно, (Левина, 1982) а в ряде случаев избирательно. Например, высокое содержание в почках ртути, таллия, урана, кадмия или бария, рубидия, лития в мышцах, преимущественное накопление в эритроцитах калия, рубидия, свинца, шестивалентного хрома, мышьяка, селена и некоторых других.
1.5 Краткая характеристика патогенеза некоторых металлов
1.5.1 Кадмий
В промышленности и технике применяется как металлический кадмий, так и его соли сульфаты, сульфиды и др. Соединения кадмия ядовиты. Ионы этого металла вступают в соединение с карбоксильными, аминными и сульфгидридными (- COOH, - NH2, -SH) группами, имеющимися в молекулах белков, и таким образом задерживаются в организме. Почки, печень и поджелудочная и щитовидная железы служат местами, в которых кадмий может оставаться годами. Известны случаи тяжелых отравлений кадмием, когда человек погибает спустя 9 лет после того, как была прекращена работа с металлом (Николаев, 1986). Действуя на кожу, кадмий вызывает дерматит и экзему.
Тяжелый металл кадмий вообще представляет собой один из самых опасных токсикантов среды (например, он значительно токсичнее свинца).В природной среде кадмий встречается лишь в очень малых количествах – именно поэтому его отравляющее действие было выявлено лишь недавно. Это объясняется тем, что только за 3-4 последних десятилетия он стал находить все большее техническое применение.
Кадмий опасен в любой форме – принятая внутрь доза в 30-40 мг уже может оказаться смертельной. Поэтому даже питье лимонада из сосудов, материал которых содержит кадмий, чревато опасностью. Из-за того, что однажды поглощенное количество кадмия выводится из человеческого организма очень медленно (0,1% в сутки), легко может происходить хроническое отравление. Самые ранние симптомы его поражение почек и нервной системы, белок в моче, нарушение функций половых органов; позднее возникают острые костные боли в спине и ногах. Типично также нарушение функций легких. Кроме того, предполагается канцерогенное действие кадмия.
В организме кадмий в первую очередь накапливается в почках, и после достижения пороговой концентрации – около 0,2 мг Cd на 1 г веса почек – появляются признаки тяжелого отравления и почти неизлечимого заболевания. К таковым признакам относятся: одышка, наличие белка в моче, малокровие и почечная недостаточность. Как уже говорилось выше, кадмий тяжело поражает половые железы (прежде всего семенники).
Кадмий почти невозможно изъять из природной среды, поэтому он все больше накапливается в ней и попадает различными путями в пищевые цепи человека и животных. Чаще всего причиной повышенного содержания кадмия в воде бывают промышленные газообразные выбросы.
В
Японии цинковый рудник загрязнил кадмием реку Дзинцу, и тамошняя питьевая вода
стала содержать кадмий; кроме того, речной водой орошали рисовые поля и
плантации сои. Спустя 15-30 лет более 150 человек умерло от хронического
отравления кадмием, сопровождавшегося атрофией костей всего скелета; этот случай
вошел в историю эпидемических отравлений тяжелыми металлами под названием
«болезнь итай-итай». В США случаи заболевания итай-итай имели место в связи с
потреблением сахарного тростника, который содержит большие количества кадмия. С
тех пор в Японии всех, кто, так или иначе, подвергается подобной опасности,
систематически обследуют на содержание кадмия в организме. Фармацевтическое
предприятие «Pharmacia» в городе Фрейбурге недавно
разработало метод, позволяющий сравнительно просто определять содержание кадмия
в моче при помощи так называемого ![]() - 2 – микроглобулина (Эйхлер,
1993).
- 2 – микроглобулина (Эйхлер,
1993).
Количество кадмия, попадающее в организм человека, зависит не только от потребления им кадмий-содержащих пищевых продуктов, но и в большей степени от качества его диеты.
В частности, даже весьма незначительная недостаточность железа может заметно усилить аккумуляцию кадмия. Вообще, достаточное количество железа в крови, по-видимому, тормозит аккумуляцию кадмия. Кроме того, известно, что большие дозы витамина D действуют как противоядие при отравлении кадмием.
В настоящее время очень важным источником загрязнения обширных территорий кадмием служат также фосфатные удобрения, с которыми в почву, а следовательно и в воду всегда попадает некоторое количество кадмия. Речь идет об удобрениях, которые содержат лишь следы кадмия. Это означает, что загрязнение растений, связанное с данным источником кадмия, настолько мало, что определяемые остаточные количества должны лежать намного ниже предела, установленного ВОЗ.
1.5.2 Ртуть
Данный металл относится к веществам общетоксического действия, вызывающем у людей летальный исход в количестве 75-300 мг в сутки. Наиболее токсична двухлористая ртуть (сулема), однократная летальная доза, которой составляет для человека 0,2-0,5 г. Ртуть характеризуется высокой нефротоксичностью, приводящей к быстро развивающейся почечной недостаточности. Выведение ртути осуществляется почками через пищеварительный тракт, потовыми и молочными железами.
При отравлениях ртутью, (Эйхлер, 1993) особенно её органическими соединениями, отчетливо выражены симптомы поражений нервной системы (паралич, нарушение зрения и слуха).
Как и другие тяжелые металлы (свинец), ионы ртути энергично соединяются с группами SH белков и прочно удерживаются в получившихся комплексах; частично ртуть в тканях организма переходит и в сульфид. Белки, богатые этими группами, содержатся в почках, поэтому ртуть, попадая в организм, сосредотачивается преимущественно в этих органах. Ртуть задерживается также и в клетках мозга и слизистой оболочки рта.
Ртуть может попадать в водоемы в самых различных формах и из самых различных источников. В количественном отношении на первое место, вероятно, следует поставить сточные воды химических предприятий; однако нельзя исключить и то, что дождевая вода обмывает посевное зерно, обработанное соединениями ртути. Так как в водной среде значительная часть ртути, в конечном счете, преобразуется в метилртуть, в пищевые цепи попадает именно это высокотоксичное и стойкое соединение.
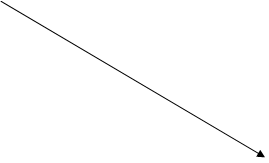
Каким бы путем ртуть ни попадала в воду, микроорганизмы метилируют её, и при этом всегда образуется метилртуть. Это соединение является жирорастворимым, чрезвычайно ядовитым и очень устойчивым, поэтому оно представляет собой одну из самых опасных форм ртути. На рисунке 1 представлена упрощенная схема превращения ртути в воде.
фенилртуть метилртуть
![]() С6H5Hg+ CH3Hg+
С6H5Hg+ CH3Hg+
![]()
(CH3)2Hg
![]()
![]() Hg º Hg2+
Hg º Hg2+
Рис.1. Упрощенная схема превращений ртути в воде
1.5.3 Свинец
Все соединения свинца и сам металл ядовиты.
Свинец удерживается белками эритроцитов, затем поступает в плазму крови (в виде комплексов с гамма-глобулином) и, наконец, достигает почек, печени и других органов. В костях свинец накапливается и долго остается там. Время от времени происходит выделение свинца из костей, что может стать причиной неожиданного развития симптомов острого отравления. Долгое время свинец остается и в головном мозге. Поражение десен, расстройство кишечника, заболевание почек и нервной системы – результаты отравления свинцом.
Случаи хронического отравления свинцом отмечаются при длительном употреблении питьевой воды с содержанием металла 0,04-1 мг/л.
Главной мишенью воздействия свинца при хронических отравлениях является центральная и периферическая нервная система (свинцовая энцефалопатия, проявляющаяся в виде головных болей, нарушением сна, памяти, возникновением тремора, галлюцинаций и т.д.). Для различных вариантов отравления свинцом характерно поражение почек, пищеварительного тракта.
Подводя итоги данной главы, мы можем отметить, что для выявления связи токсического действия металлов необходимо знать их физические, химические и физико-химические свойства. Наиболее важным можно считать то, что такие взаимоотношения с удовлетворительной корреляцией установлены между токсичностью металлов и рядом показателей, характеризующих фундаментальные свойства атомов и ионов металлов (и неметаллов), их заряды, электронную структуру, особенности строения последней и т.д. Такие связи установлены также между токсичностью и степенью прочности соединения металла с неметаллической частью молекулы в разнообразных соединениях металлов.
Анализ материалов о транспорте, распределении, путях выведения металлов из организма показал, что они, в свою очередь, связаны с рядом тех же физических, химических свойств, как самих металлов, так и поступающих в организм соединений. Основное значение имеет циркуляция металлов в виде свободных ионов, прочность образуемых ими связей с биокомплексами, растворимость последних и химические превращения поступивших соединений – быстрота диссоциаций, растворимость образующихся после диссоциации или гидролиза соединений и т.д.
Прочность связей, степень сродства катионов металлов к функциональным химическим группировкам в организме, также может определять не только общую токсичность, но избирательность или специфичность действия, что подтверждается на примере такой распространенной во всех тканях и вместе с тем такой биологически важной функциональной группе – сульфгидридной. Так, специфическое повреждение почек такими металлами как, как ртуть или кадмий, объясняют высоким сродством их к SH-группам ткани почек (также и особо высоким содержанием последних в почках).
Глава 2 Материалы и методы исследования
2.1 Состояние качества питьевой воды в г.Южно-Сахалинске и Сахалинской области на начало 2004 года
В области только в 7 муниципальных образованиях (в Тымовском, Поронайском, Холмском, Смирныховском, Анивском, Ногликском, Невельском районах) разработаны и действуют целевые программы по обеспечению населения доброкачественной питьевой водой. Однако финансирование мероприятий по вопросам водоснабжения из бюджетов муниципальных образований осуществляется недостаточно.
Не решены вопросы организации зон санитарной охраны в Александровск-Сахалинском, Анивском, Макаровском, Невельском, Холмском районах.
Коммунальные водопроводы не имеют необходимого комплекса водоподготовительных сооружений в 100% Охинском, в 50% Курильском и Углегорском, в 80% Невельском, в 66% Александровск-Сахалинском районах, в 87% в г. Южно-Сахалинске.Отсутствуют обеззараживающие установки в 75% на водопроводах в Курильском, в 20% в Невельском, в 43% Томаринском районах, в 83% г. Южно-Сахалинске.
Не соответствуют санитарным требованиям по комплексу водоподготовительных сооружений на 85% ведомственных водопроводах в г. Южно-Сахалинске, на 40% в Холмском, на 100% в Углегорском, на 50% в Томаринском, на 100% в Курильском районах.Не обеспечены обеззараживающими установками 33% водопроводов в Долинском, 100% в Курильском, 50% в Томаринском районах, 84% в г. Южно-Сахалинске.
В источниках централизованного водоснабжения за 2003 год удельный вес неудовлетворительных проб по санитарно-химическим показателям увеличился на 4,3% .Наиболее неудовлетворительное качество воды водоемов 2 категории по санитарно-химическим исследованиям зарегистрировано в Поронайском, Холмском районах, в г. Южно-Сахалинске.
Увеличиваются обьемы сброса загрязненных вод без очистки и обеззараживания в поверхностные водные обьекты. Из общего обьема сточных вод проходят через очистные сооружения только 58%. Из-за длительной эксплуатации без провидения капитальных ремонтов ежегодно снижается эффективность работы очистных сооружений (Дарижапов, 2004).
2.2 Характеристика районов г.Южно-Сахалинска в которых происходило исследование качества питьевой воды
Мониторинг качества питьевой воды проводился в период с 12 января 2004 г. по 29 декабря 2006 г. За этот период анализу было подвергнуто 302 пробы воды. Из них 248 пробы исследованы работниками городской СЭС с помощью атомно-адсорбционного метода и, соответственно, нами исследовано 54 пробы методом инверсионной вольтамперометрии.
Исследования качества питьевой воды проводили в пяти районах г.Южно-Сахалинска в течение 2004-2006 гг. Среди исследуемых районов нами были выбраны следующие:
1) Школа № 34 в п. Новоалександровск.
2) Водовод I в п. Луговом.
3) Квартал образованный пересечением ул. Комсомольской, ул. Пуркаева, ул. Ленина и пр. Победы.
4) Район ул. Авиационнаой.
5) Район военного городка (пр. Мира 380-391).
Последний объект (военный городок) выбран не случайно, так как он не подведомственен Сахалинскому водоканалу и сравнение результатов проб полученных в данном районе с 4 выше перечисленными, может служит критерием степени очистки воды проводимой на водоочистных сооружениях города.
Число проб подвергнутых анализу в период с 2004-2006 годы приведено в таблице 1.
Таблица1. Число проб отобранных в период с 2004-2006 годы.
| Объект. | Число проб. | ||
| 2004 год | 2005 год | 2006 год | |
| Школа №34 в п.Новоалександровск. | 16 (4/12) | 16 (4/12) | 16 (4/12) |
| Водовод I в п.Луговом | 16 (4/12) | 16 (4/12) | 16 (4/12) |
| Центр города | 32 (8/24) | 39 (8/31) | 48 (12/36) |
| ул.Авиационная | 16 (4/12) | 16 (4/12) | 16 (4/12) |
| Военный городок | 6 (3/3) | 24 (12/12) | 24 (12/12) |
Число за скобками показывает общее количество проб. В скобках, левая цифра указывает количество проб, подвергнутое полному санитарно-химическому анализу, а правая - сокращенному санитарно-химическому анализу. Кроме этого, мы исследовали ежегодно по 1 пробе в четырех районах выше указанных районах города. Полученные данные соответствует тем, которые предоставили нам работники СЭС.
2.3 Отбор проб воды для санитарно-химического исследования. ГОСТ 4979-69 от 1 февраля 2001 года
Для отбора проб воды для санитарно-химического анализа брали бутыль емкостью два литра с притертой пробкой. Перед отбором проб бутыль не менее двух раз ополаскивали водой подлежащей исследованию.
Бутыль наполняли водой до верха. При закрытии бутыли верхний слой воды сливали так, чтобы под пробкой оставался не большой слой воздуха
На каждую бутыль составляли сопроводительный документ, в котором указывали дату отбора, наименование и местонахождение источника.
Анализ проводили не менее чем через три часа после взятия пробы.
2.4 Метод инверсионной вольтамперометрии (Соловьев, 1998)
Измерение концентрации ионов металлов в пробах питьевой воды мы проводили с помощью анализатора инверсионного вольтамперометрического «АКВ-07МК».
Измерение массовой концентрации элементов в растворах проб определяли «методом стандартных добавок», не требующим построения градуированной кривой. Метод стандартных добавок включает регистрацию вольтамперограмм при одних и тех же параметрах измерений серии следующих растворов:
1) фонового электролита;
2) пробы, подготовленной к измерениям;
3) той же пробы, в которую вводят добавки растворов измеряемого иона, с известной концентрацией (рабочих растворов).
Результата измерений рассчитывали сравнением величин аналитических сигналов полученных вольтамперограмм.
В таблице 2. представлены диапазоны и границы погрешностей результатов измерений по ГОСТу Р 8563-96.
Методика обеспечивает получение результатов анализа массовой концентрации ионов кадмия, свинца, меди, цинка, мышьяка, ртути, серебра и селена в пробах питьевой, природной, морской и очищенной сточной воды с погрешностью, не превышающей значения в таблице 2. при доверительной вероятности Р=0,95 нормы погрешности измерений.
Таблица 2. Диапазоны и границы погрешности результатов измерений.
| Наименование иона |
Диапазон массовой концентрации, мг/дм3 |
Границы относительной
погрешности, ± |
| Вода питьевая, природная и морская | ||
| Кадмий |
0,001 |
0,11Х + 0,28 |
| Свинец |
0,001 |
0,12Х + 0,28 |
| Медь |
0,001 |
0,10Х + 0,25 |
| Цинк |
0,01 |
0,07Х + 1,30 |
|
Мышьяк Железо |
0,002 |
25 |
|
св. 0,01 |
20 | |
| св. 0,1 | 10 | |
| Ртуть | 0,0001 – 0,001 | 25 |
| св. 0,001 | 15 | |
| Серебро |
0,0005 |
35 |
| св. 0,001 | 30 | |
| Селен |
0,0005 |
25 |
| св. 0,001 | 21 | |
Нами было исследовано три группы следующих элементов
1) Кадмий, медь, свинец, цинк, железо.
2) Мышьяк, ртуть.
3) Серебро, селен.
2.4.1 Приготовление вспомогательных растворов для измерения концентрации ионов металлов в пробах питьевой воды
2.4.1.1 Приготовление основных стандартных растворов ионов кадмия, свинца, меди, железа, цинка, ртути, мышьяка, селена и серебра.
Вскрывали стеклянную ампулу стандартного образца соответствующих растворов ионов кадмия, свинца, меди, цинка, железа, ртути, мышьяка, селена и серебра с концентрацией 1,0 мг/см3 , каждый раствор выливали в сухой стакан, 5,0 см3 раствора с помощью пипетки вместимостью 5,0 см3 переносили в мерную колбу объемом 50 см3 и доводили до метки бидистиллированной водой.
2.4.1.2 Приготовление аттестованных растворов ионов кадмия, свинца, меди, цинка, железа, ртути, мышьяка, селена и серебра.
Аттестованные растворы с концентрацией 1,0 и 10,0 мг/дм3 готовили отдельно для каждого иона из ранее приготовленных основных растворов, разбавляя их дистиллированной водой.
Объем основных растворов и мерных колб, массовая концентрация исходных и приготовленных растворов ионов кадмия, свинца, меди, цинка и железа и другие необходимые сведения приведены в таблице 3.
Таблица 3. Приготовление аттестованных смесей (АС) растворов ионов кадмия, свинца, меди, цинка, железа, ртути, мышьяка, селена и серебра
|
Концентрация исходного раствора для приготовления АС, мг/дм3 |
Объем исходного раствора для приготовления АС, см3 |
Объем мерной колбы, см3 |
Концентрация приготовленного раствора АС, мг/дм3 |
| 100 | 5 | 50 | 10,0 |
| 100 | 1 | 100 | 1,0 |
2.4.1.3 Приготовление раствора азотной кислоты концентрацией 1 М.
В мерную колбу объемом 1000 см3 помещали 200-300 см3 бидистиллированной воды и вносили цилиндром 70 см 3 концентрированной азотной кислоты, (р = 1,42 г/см3) перемешивали, охлаждали и доводят до метки бидистиллированной водой.
2.4.1.4 Приготовление раствора азотной кислоты концентрацией 0,1 М.
В мерную колбу вместимостью 1000 см3 вносили пипеткой, 7,0 см3 концентрированной азотной кислоты и доводили до метки бидистиллированной водой.
2.4.1.5.Приготовление хлороводородной кислоты концентрации 1 М.
В мерную колбу объемом 1000 см3 помещали 200-300 см3 бидистиллированной воды и вносили цилиндром 80 см3 концентрированной хлороводородной кислоты, (р=1,19 г/см3) перемешивали, охлаждают и доводили до метки бидистиллированной водой.
2.4.1.6 Приготовление раствора ртути (II) азотнокислой концентрации 0,01М
Навеску ртути (II) азотнокислой массой 0,343г. взвешивали на аналитических весах, помещали в мерную колбу объемом 100 см3 и растворяют в 50 см3 раствора азотной кислоты концентрации 0,1 М и доводят до метки бидистиллированной водой.
2.4.1.7 Приготовление раствора фонового электролита для измерения массовой концентрации ионов кадмия, свинца, меди, цинка и железа.
В мерную колбу объемом 1000 см3 вносили 50 см3 раствора хлороводородной кислоты концентрации 1М, 10 см3 раствора азотнокислой ртути концентрации 0,01М и доводили до метки бидистиллированной водой.
2.4.1.8 Приготовление насыщенного раствора сернокислого гидразина.
В стакан, объемом 200 см3 цилиндром наливали 100 см 3 бидистилированной воды, 1 см3 концентрированной серной кислоты (р= 1,83 г/см3) и перемешивали. В полученный раствор добавляли небольшими порциями сернокислый гидразин, растворяя его до получения насыщенного раствора.
2.4.1.9. Приготовление 0,1М раствора трилона Б.
9,3 г соли динатриевой этилендиамин-N,N,N,N- тетрауксусной кислоты 2- водной трилона Б взвешивали с погрешностью не более 0,1 г, помешали в мерную колбу объемом 250 см3 и растворяли в бидистиллированной воде, после чего содержимое колбы доводят до метки и перемешивали.
2.4.1.10. Приготовление фонового электролита для измерения массовой концентрации ионов мышьяка.
В мерную колбу объемом 1000 см3 цилиндром наливали 100 см3 насыщенного раствора сернокислого гидразина, добавляли 50 см3 0,1М раствора трилона Б и доводили до метки бидистиллированной водой.
2.4.1.11.Приготовление фонового электролита для измерения массовой концентрации ионов ртути.
В мерную колбу объемом 1000 см3 вносили 10 см3 хлорной кислоты (р= 1,50-1,51 г/см3) и 30 см3 0,1М соляной кислоты и доводили объем до метки бидистиллированной водой.
2.4.1.12 Приготовление фонового электролита для измерения массовой концентрации ионов селена и серебра.
10,1 нитрата калия взвешивали с погрешностью не более 0,1г. помещали в мерную колбу вместимостью 1000 см3, растворяли в бидистиллированной воде, доводя раствор до метки бидистиллированной водой и перемешивали.
2.4.2 Подготовка проб питьевой воды
Отбор, консервация и хранение проб питьевой воды проводили в соответствие с ГОСТ 24481.
Для каждого анализа отбирали по три параллельные пробы воды (одна резервная). Измерения массовой концентраций ионов металлов выполняли в одной пробе. При проведении анализов одновременно готовили две параллельные пробы.
Пробу подготовленного к испытанию образца воды объемом 100 см3 переносили в выпаривательную чашку, добавляли 1-2 см3 концентрированной азотной кислоты (р=1,42 г/см3). Содержимое чашки упаривали до “влажных солей”. Если остаток был темным, кислотную обработку повторяли до его осветления. Если остаток не осветлялся, пробу упаривали досуха и прокаливают в муфельной печи при 450 оС в течение 30 мин.
Раствор пробы, полученный в результате полной минерализации, охлаждали и переносили в мерную пробирку объемом 20 см3 через бумажный фильтр, увлажненный раствором фонового электролита. Раствор контрольной пробы готовили к выполнению измерений аналогично пробам воды, используя вместо пробы бидистилированную воду.
2.4.3 Проверка электрохимической ячейки
Готовили пробу для регистрации фона: в фарфоровую чашку пипеткой помещали 1-5 см3 бидистиллированной воды, добавляют 2 см3 раствора фонового элекролита для измерения массовой концентрации соответствующих ионов, перемешивали стеклянной палочкой и нагревают на электроплите в течение 10 минут. После охлаждения содержимое чашки растворяли в 1 см3 раствора соляной кислоты концентрации 1М и добавляли 1 см3 раствора трилона Б, и после перемешивания переносили в мерную пробирку на 20 см3, доводя содержимое до метки бидистиллированной водой. Полученный раствор переносили в стеклоуглеродный тигель и регистрируют вольтамперограммы (1) при параметрах, указанных в таблице 4.
Затем в стеклоулеродный тигель одноканальной пипеткой переменного объема добавляли по 20 мкл рабочих растворов соответствующих определяемых ионов, регистрировали вольтамперограммы (2) при тех же параметрах. Идентифицируют аналитический пик определяемого элемента. Отсутствие на вольтамперограммах (1) аналитических пиков, определяемых элементов, свидетельствует о чистоте ячейки.
2.4.4 Наименование основных операций выполнения измерений массовой концентрации ионов
а) Регистрация вольтамперограмм «холостой» пробы.
В стеклоуглеродный тигель электрохимической ячейки помещали 20 см 3 «холостой» пробы. Закрепляли тигель в подставке-держателе прибора. Устанавливали потенциал электрохимической очистки рабочего электрода в соответствии с таблицей 4. и не менее 60 секунд не регистрируя вольтамперограммы производили очистку электрода. Выключали ячейку. Устанавливали параметры измерений (потенциал накопления, амплитуду развертки, диапазон тока, и время накопления) в соответствии с рекомендациями таблицы 4. Включали ячейку, регистрировали вольтамперограммы и выключали ячейку.
Устанавливали потенциал очистки электрода 0,0 В. Включали ячейку, выполняли электрохимическую очистку электрода в течение времени, равном времени накопления и выключали ячейку.
Цикл указанных выше операций повторяли не менее трех раз. Электрохимическая очистка электрода обязательна после записи каждой вольтамперограммы.
Результаты измерений (регистрация вольтамперограммы раствора «холостой» пробы и условия выполнения всех измерений) записывали в программном интерфейсе системы сбора и обработки данных в соответствии с руковством по эксплуатации прибора.
б) Регистрация вольтамперограмм раствора пробы.
В стеклоуглеродный тигель помещали 20 см3 раствора пробы, подготовленной к измерениям. Закрепляли тигель на подставке-держателе прибора. Значения потенциалов пика окисления определяемых металлов является качественной характеристикой элемента: их ориентировочные значения приведены в таблице № 4.
Результаты измерений записывал в программном интерфейсе прибора.
в) Регистрация вольтамперограмм пробы с добавками.
Добавку растворов аттестованных смесей (АС) определяемых ионов пипеточным дозатором вносили в тигель с пробой после регистрации вольтамперогамм и очистки электрода.
Объем и концентрация добавляемых в ячейку растворов АС (таб. 4) устанавливаются экспериментально для каждой пробы таким образом, чтобы высота аналитического пика измеряемого иона при регистрации вольтамперограмм пробы с добавкой увеличилась в 1,5-3 раза прим значениях параметров прибора, установленных при регистрации вольтамперограммы измеряемой пробы.
Суммарный объем всех растворов АС, добавленных в ячейку, не должен превышать 10% от объема пробы.
2.4.5. Обработка результатов измерений
Обработку результатов измерений пробы воды (Х1 и Х2) и расчет массовой концентрации элемента в пробе воды Хср выполняет система сбора и обработки данных анализатора. За результат анализа принимают среднее арифметическое значение из результатов двух параллельных измерений Хср.
Массовая концентрация элемента в пробах воды Х, мг/кг, вычисляют по формуле:
Х= Хср- Х0 (2.1)
где:
Х0- массовая концентрация элемента в “холостой” пробе.
2.4.6 Очистка электродов
После проведения серии анализов или в конце работы ячейку и электроды тщательно промывают бидистилированной водой, рабочие электроды механически очищают фильтровальной бумагой, затем бумагой, смоченной этанолом, вспомогательный (хлорсеребряный) электрод ополаскивают раствором хлороводородной кислоты, промывают бидистиллированной водой и помещают в насыщенный раствор хлорида калия.
Таблица 4. Параметры измерений при регистрации вольтамперограмм
| 1 | 2 | 3 | 4 | 5 | 6 |
| Определяемые ионы | Zn, Cd, Pb, Cu, Fe | Cd, Pb, Cu, Fe | Se (+4) | As, Hg | Ag |
| Tип рабочего электрода | углеситаловый | углеситаловый | углеситаловый | золотой | углеситаловый |
| Напрвление развертки | Положительное | Положительное | Отрицательное | Положительное | Положительное |
| Потенциал очистки электрода, В | 0,0 | 0,0 | 0,0 | + 1,7 | + 0,6 |
| Потенциал накопления, В | - 1,3 | - 0,9 | - 0,3 | - 0,5 | - 0,3 |
| Время накопления, сек | 60 | 60 | 60-300 | 60-300 | 60-300 |
| Амплитуда развертки, В | 3-30 | 0,5-1 | 0,5-1 | 0,5-1,25 | 0,5-1 |
| Потенциал аналитического пика, В | -1,0-0,1 | -0,7-0,1 | -0,6 | 0,15-0,7 | 0,3 |
| Время очистки | 60 | 60 | 60 | 60 | 60 |
| Скорость линейного потенциала мВ/сек | 20-50 | 20-50 | 50 | 50 | 50 |
| Ячейка | трех электродная | трех электродная | трех электродная | трех электродная | трех электродная |
| Вид полярографии | инверсионная | инверсионная | инверсионная | инверсионная | инверсионная |
2.5 Определение общей жесткости воды методом комплексонометрического титрования
Приборы и реактивы: колбы мерные на 250 мл (1:3), бюретка на 25 мл (1:1),мерный цилиндр на 100 мл (1:1), лабораторный штатив (1:1), шпатель, раствор трилона Б концентрацией 0,1Н, 100 мл, хроматоген черный.
Метод комлексонометрии основан на реакции образования прочных комплексных соединений ионов металлов с рядом комплексообразующих органических соединений, получивших название комплексонов.
Комплексоны - органические соединения, производные аминополикарбоновых кислот. Наиболее распространен комплексон III (трилон Б). Трилон Б со многими катионами образует прочные и растворимые в воде внутрикомплексные соли.
Точку эквивалентности в комплексонометрии можно определить с помощью металл индикаторов – органических красителей, образующих с катионами металлов окрашенные комплексные соединения. Эти комплексы менее устойчивы, чем комплексы тех же катионов с комплексонами. Поэтому при титровании раствора комплексонов происходит связывание им металла и выделяется свободный индикатор, имеющий иную окраску, чем комплекс катиона металла с индикатором. В качестве индикаторов в комплексонометрии используется хромоген чёрный, мурексид и ряд других. Анионы этих индикаторов вступают в реакцию с катионами металлов с образованием комплексов, окрашенных в красный цвет.
При титровании комплексоном комплекс разрушается, а анионы - накапливаются в растворе, сообщая ему синюю окраску.
Появление синий окраски указывает на окончание титрования (достижения точки эквивалентности).
Ход работы:
Отмеряли пробу анализируемой воды объемом 100 мл спомощью мерного цилиндра и помещали ее в мерную колбу объемом 250 мл. Добавляли в колбу хроматоген черный на кончики шпателя, раствор окрашивался в розовый цвет. Сразу же начинали титровать пробу раствором трилона Б, концентрацией 0,1Н, до появление синей окраски.
Общую жесткость вычисляли по формуле:
Жобщ.=![]() (1.1)
(1.1)
где:
Жобщ.- общая жесткость воды.
N Na2[H2Tr] - нормальность раствора трилона Б.
V Na2[H2Tr] – объем раствора трилона Б.
V H2O – объем анализируемой воды.
Цикл данной операции проводили три раза и находили среднюю величину общей жесткости.
2.6 Санитарно-гигиеническое нормирование веществ в водной среде
Одним из главных гигиенических нормативов является - предельно допустимая концентрация (ПДК). ПДК - это количество вредного вещества в окружающей среде, отнесенное к массе или объёму её конкретного компонента, которое при постоянном контакте или при воздействии в отдельный промежуток времени практически не оказывает влияние на здоровье человека и не вызывает не благоприятных последствий у его потомства.
В качестве ПДК принимается наименьшая концентрация из пороговых уровней, установленных по разным критериям вредного действия.
Более чем половина всех нормированных веществ ПДК в воде обоснована по органолептическому и общесанитарному показателю. Опасность водных загрязнителей оценивается по комплексу показателей. В соответствии с действующей классификацией, предложенной Г.Н.Красовским, вещества подразделяются на четыре класса, причём для соединений I-го и II-го классов риск развития неблагоприятных эффектов у человека в случае превышения установленных ПДК наиболее значителен.
Наиболее значимые в гигиеническом отношении вещества загрязняющие воду приведены в таблице 5.
Таблица 5. ПДК некоторых веществ
| Вещество | ПДК в воде по санитарно-токсикологическому признаку (мг/л) | Класс опасности |
| Барий | 0,7 | II |
| Бериллий | 0,0002 | I |
| Висмут (V) | 0,1 | II |
| Вольфрам | 0,05 | II |
| Никель | 0,02 | II |
| Кобальт | 0,1 | II |
| Железо | 0,3 | II |
| Кадмий | 0,001 | II |
| Таллий | 0,0001 | I |
| Марганец | 0,1 | III |
| Медь | 1,0 | III |
| Мышьяк | 0,01 | II |
| Сурьма (III) | 0,005 | II |
| Свинец | 0,01 | II |
| Ртуть (II) | 0,0005 | I |
| Серебро | 0,015 | IV |
| Цинк | 1,0 | III |
| Селен | 0,01 | II |
| Теллур | 0,01 | II |
2.7 Расчет индекса загрязнения вод
Моделирование и оценка качества водных акваторий необходимы для районирования этих акваторий по степени экологической напряженности, а также с целью принятия оптимальных природоохранных мероприятий.
При выполнении таких оценок требуется охарактеризовать качество водной среды. В настоящее время оценка качества вод затруднена, так как она основывается на сравнении средних концентраций, наблюдаемых в пунктах контроля, с нормативами ПДК для каждого компонента. Особое затруднение возникает при необходимости отразить тенденцию изменения качества водного объекта за продолжительный период. В связи с этим предпринимаются попытки комплексной оценки качества вод по абиотическим критериям. Одним из наиболее удачных подходов в этом направлении является метод, использующий в качестве критериев индексы загрязнения вод – (ИЗВ). ИЗВ характеризуют среднее содержания основных загрязняющих веществ в долях ПДК содержащихся в водных объектах.
Расчет ИЗВ выполняется по формуле:
![]() (2.1)
(2.1)
где:
ИЗВ индекс загрязнения вод.
С1,С2,Сn – среднегодовые концентрации загрязняющих веществ.
ПДК1, ПДК2, ПДКn предельно допустимые концентрации веществ, соответствующих компонентов.
На основе значения ИЗВ, возможно оценить качества питьевой воды в том или ином объекте.
Таблица 6. Критерии загрязнения или улучшения качества на основании ИЗВ
| Класс качества | Текстовое описание | Величина ИЗВ |
| 1 | 2 | 3 |
| 1 | Очень чистая | < 0,2 |
| 2 | Чистая | 0,2-1,0 |
| 3 | Умеренно загрязненная | 1,0-2,0 |
| 4 | Загрязненная | 2,0-4,0 |
| 5 | Грязная | 4,0-6,0 |
| 6 | Очень грязная | 6,0-10,0 |
| 7 | Чрезвычайно грязная | > 10 |
Глава 3 Определение некоторых показателей качества питьевой воды в различных районах г.Южно-Сахалинска и их сравнительный анализ
3.1 Показатели качества питьевой воды в различных районах г.Южно Сахалинска представленные в таблицах 7-12
В таблице 7. приведены среднеквартальные значения веществ за период с 2004 по 2006 годы в школе №34 п. Новоалександровск.
Как видно из данной таблице, концентрация ионов меди в этом объекте за весь период исследований оставалась стабильной и составляла 0,01 мг/л. Лишь в III квартале 2004г. она незначительно увеличелась до 0,02 мг/л. Концентрация ионов цинка за данный период исследования варьировала от 0,004 до 0,005 мг/л. Концентрация ионов кадмия в I и II квартале 2004г. была ниже порога чувствительности метода измерения, в последующий период она увеличилась до 0,00002 мг/л и в дальнейшем оставалась стабильной. Концентрация ионов свинца варьировала от 0,002 до 0,004 мг/л. Все выше указанные концентрации были ниже предельно допустимых, что следует из таблицы 5. Концентрации же ионов ртути, мышьяка, селена и серебра были ниже порога чувствительности метода измерения.
Следует обратить внимание на концентрацию ионов железа, в III кварталах 2004-2006 гг., отмечалось превышение ПДК.
Общая жесткость питьевой воды была ниже 3 г*экв/л, то есть вода являлась мягкой. Максимальная жесткость наблюдалась во II кварталах 2004- 2006 гг. Просуммировав концентрацию каждого вещества за квартал и разделив полученное число на 4, мы получили следующие, среднегодовые значения для каждого компонента за 2004 год:
Сср (Cu) = 0,01250 (мг/л)
Ccр (Zn) = 0,00425 (мг/л)
Ccр (Сd) = 0,00002 (мг/л)
Сср (Рb) = 0,00300 (мг/л)
Сср (Fe) = 0,30750 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,54175
Найдем среднегодовые значение концентраций веществ, за 2005 год:
Сср (Cu) = 0,01000 (мг/л)
Ccр (Zn) = 0,00425 (мг/л)
Сср (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00325 (мг/л)
Ccр (Fe) = 0,26000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,40525
Найдем, среднегодовые значения веществ за 2006 год:
Сср(Сu) = 0,01000 (мг/л)
Сср (Zn) = 0,00475 (мг/л)
Сср (Pb) = 0,00325 (мг/л)
Ccр (Сd) = 0,00002 (мг/л)
Ccр (Fe) = 0,26750 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,43075
Таблица 7. Концентрация веществ в пробах питьевой воды школы №34 в период с 20004 по 2006 годы
|
Конц. веществ в пробе.(мг/л) |
2004 год | 2005 год | 2006 год | |||||||||
| I | II | III | IV | I | II | III | IV | I | II | III | IV | |
| Медь | 0,01 | 0,01 | 0,02 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 |
| Цинк | 0,004 | 0,005 | 0,004 | 0,004 | 0,004 | 0,004 | 0,005 | 0,004 | 0,004 | 0,005 | 0,005 | 0,005 |
| Кадмий | <0,00001 | <0,00001 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 |
| Свинец | 0,003 | 0,003 | 0,002 | 0,004 | 0,003 | 0,003 | 0,003 | 0,004 | 0,003 | 0,003 | 0,003 | 0,004 |
| Ртуть | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 |
| Мышьяк | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Селен | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | 0,0001 | 0,0001 |
| Серебро | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Железо | 0,26 | 0,21 | 0,48 | 0,28 | 0,22 | 0,20 | 0,36 | 0,26 | 0,26 | 0,22 | 0,31 | 0,28 |
| О.жест.(г*экв./л) | 2,48 | 2,56 | 2,32 | 2,42 | 2,36 | 2,48 | 2,32 | 2,26 | 2,30 | 2,52 | 2,34 | 2,32 |
В таблице 8. приведены среднеквартальные значения веществ за период с 2004 по 2006 годы в водоводе I п. Луговое. Как видно из данной таблице, концентрация ионов меди в этом объекте за весь период исследований варьировала от 0,02-0,05 мг/л. Концентрация ионов цинка за данный период исследования менялась от 0,01 до 0,02 мг/л. Концентрация ионов кадмия оставалась стабильной и состовляла 0,00002 мг/л. Концентрация ионов свинца варьировала от 0,001 до 0,005 мг/л. Концентрация ионов железа колебалась между 0,23 и 0,28 мг/л. Все выше указанные концентрации были ниже предельно допустимых, что следует из таблицы 5. Концентрации же ионов ртути, мышьяка, селена и серебра были ниже порога чувствительности метода измерения.
Общая жесткость питьевой воды была ниже 3 г*экв/л, то есть вода являлась мягкой. Максимальная жесткость наблюдалась во II кварталах 2004- 2006 гг.
Просуммировав концентрацию каждого вещества за квартал и разделив полученное число на 4, мы получили следующие, среднегодовые значения для каждого компонента за 2004 год:
Сср (Cu) = 0,03000 (мг/л)
Ccр (Zn) = 0,01000 (мг/л)
Ccр (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00200 (мг/л)
Cср (Fe) = 0,24000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,24000
Найдем среднегодовые значение концентраций веществ, за 2005 год:
Сср (Cu) = 0,02500 (мг/л)
Ccр (Zn) = 0,01000 (мг/л)
Сср (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00225 (мг/л)
Ccр (Fe) = 0,26000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,09725
Найдем, среднегодовые значения веществ за 2006 год:
Сср(Сu) = 0,02250 (мг/л)
Сср (Zn) = 0,02000 (мг/л)
Сср (Pb) = 0,00225 (мг/л)
Ccр (Сd) = 0,0002 (мг/л)
Ccр (Fe) = 0,6000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ= 1,33350
Таблица 8. Концентрация веществ в пробах питьевой воды вододовода I (п. Луговое) в период с 2004 по 2006 годы
|
Конц. веществ в пробе.(мг/л). |
2004 год | 2005 год | 2006 год | |||||||||
| I | II | III | IV | I | II | III | IV | I | II | III | IV | |
| Медь | 0,02 | 0,02 | 0,05 | 0,03 | 0,02 | 0,02 | 0,04 | 0,02 | 0,02 | 0,02 | 0,03 | 0,02 |
| Цинк | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,02 | 0,02 | 0,02 | 0,02 |
| Кадмий | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 |
| Свинец | 0,001 | 0,005 | 0,001 | 0,001 | 0,002 | 0,002 | 0,003 | 0,002 | 0,002 | 0,002 | 0,003 | 0,002 |
| Ртуть | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 |
| Мышьяк | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Селен | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | 0,0001 | 0,0001 |
| Серебро | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Железо | 0,23 | 0,27 | 0,22 | 0,24 | 0,24 | 0,26 | 0,28 | 0,26 | 0,26 | 0,24 | 0,26 | 0,28 |
| О.жест.(г*экв/л.) | 2,26 | 2,44 | 2,32 | 2,22 | 2,31 | 2,68 | 2,42 | 2,25 | 2,28 | 2,48 | 2,32 | 2,30 |
В таблице 9. приведены среднеквартальные значения веществ за период с 2004 по 2006 годы в районе центра города.
Как видно из данной таблице, концентрация ионов меди в этом объекте за весь период исследований изменялась в пределах от 0,01 до 0,03 мг/л. Концентрация ионов цинка за данный период исследования варьировала от 0,01 до 0,03 мг/л. Концентрация ионов кадмия оставалась стабильной за весь период исследования и составляла 0,00002 мг/л. Концентрация ионов свинца варьировала от 0,001 до 0,005 мг/л. Все выше указанные концентрации были ниже предельно допустимых, что следует из таблицы 5. Концентрации же ионов ртути, мышьяка, селена и серебра были ниже порога чувствительности метода измерения.
Следует обратить внимание на концентрацию ионов железа, практически во всех кварталах 2004-2006 гг., отмечалось превышение ПДК.
Общая жесткость питьевой воды была ниже 3 г*экв/л, то есть вода являлась мягкой. Максимальная жесткость наблюдалась во II кварталах 2004- 2006 гг.
Просуммировав концентрацию каждого вещества за квартал и разделив полученное число на 4, мы получили следующие, среднегодовые значения для каждого компонента за 2004 год:
Сср (Cu) = 0,01250 (мг/л)
Ccр (Zn) = 0,01500 (мг/л)
Ccр (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00250 (мг/л)
Cср (Fe) = 0,3050 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,49350
Найдем среднегодовые значение концентраций веществ, за 2005 год:
Сср (Cu) = 0,02000 (мг/л)
Ccр (Zn) = 0,01250 (мг/л)
Сср (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00275 (мг/л)
Ccр (Fe) = 0,32500 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ= 1,59050
Найдем, среднегодовые значения веществ за 2006 год:
Сср(Сu) = 0,02250 (мг/л)
Сср (Zn) = 0,02000 (мг/л)
Сср (Pb) = 0,00350 (мг/л)
Ccр (Сd) = 0.00002 (мг/л)
Ccр (Fe) = 0,33000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,69250
Таблица 9. Концентрация веществ в пробах питьевой воды центра города с 2004 по 2006 годы.
| Конц. веществ пробе. | 2004 год | 2005 год | 2006 год | |||||||||
| I | II | III | IV | I | II | III | IV | I | II | III | IV | |
| Медь | 0,01 | 0,02 | 0,01 | 0,01 | 0,02 | 0,02 | 0,02 | 0,02 | 0,02 | 0,02 | 0,03 | 0,02 |
| Цинк | 0,02 | 0,01 | 0,01 | 0,02 | 0,02 | 0,01 | 0,01 | 0,01 | 0,01 | 0,02 | 0,03 | 0,02 |
| Кадмий | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 |
| Свинец | 0,001 | 0,005 | 0,001 | 0,001 | 0,002 | 0,002 | 0,004 | 0,003 | 0,003 | 0,003 | 0,005 | 0,003 |
| Ртуть | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 |
| Мышьяк | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Селен | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | 0,0001 | 0,0001 |
| Серебро | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Железо | 0,28 | 0,32 | 0,31 | 0,31 | 0,38 | 0,32 | 0,32 | 0,28 | 0,30 | 0,32 | 0,36 | 0,32 |
| О.жест. | 2,38 | 2,62 | 2,47 | 2,48 | 2,35 | 2,58 | 2,38 | 2,30 | 2,26 | 2,68 | 2,47 | 2,36 |
В таблице 10. приведены среднеквартальные значения веществ за период с 2004 по 2006 годы в ул. Авиационной.
Как следует из данной таблице, концентрация ионов меди в этом объекте за весь период исследований изменялась в пределах от 0,001 до 0,002мг/л. Концентрация ионов цинка за данный период исследования варьировала от 0,001 до 0,002 мг/л. Концентрация ионов кадмия оставалась стабильной за весь период исследования и составляла 0,00002 мг/л. Концентрация ионов свинца варьировала от 0,001 до 0,002 мг/л. Концентрация ионов железа изменялась в пределах от 0,21 до 0,26. Все выше указанные концентрации были ниже предельно допустимых, что следует из таблицы 5. Концентрации же ионов ртути, мышьяка, селена и серебра были ниже порога чувствительности метода измерения.
Общая жесткость питьевой воды была ниже 3 г*экв/л, то есть вода являлась мягкой. Максимальная жесткость наблюдалась во II кварталах 2004- 2006 гг.
Просуммировав концентрацию каждого вещества за квартал и разделив полученное число на 4, мы получили следующие, среднегодовые значения для каждого компонента за 2004 год:
Сср (Cu) = 0,22750 (мг/л)
Ccр (Zn) = 0,00100 (мг/л)
Ccр (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00150 (мг/л)
Cср (Fe) = 0,22750 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,11050
Найдем среднегодовые значение концентраций веществ, за 2005 год:
Сср (Cu) = 0,00100 (мг/л)
Ccр (Zn) = 0,00125 (мг/л)
Сср (Сd) = 0,00002 (мг/л)
Ccр (Pb) = 0,00150 (мг/л)
Ccр (Fe) = 0,24000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ = 1,15250
Найдем, среднегодовые значения веществ за 2006 год:
Сср(Сu) = 0,00100 (мг/л)
Сср (Zn) = 0,00125 (мг/л)
Сср (Pb) = 0,00100 (мг/л)
Ccр (Сd) = 0,00002 (мг/л)
Ccр (Fe) = 0,22500 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ.
ИЗВ= 1,05225
Таблица 10. Концентрация веществ в пробах питьевой воды района ул. Авиационной с 2004 по 2006 годы.
|
Конц. веществ в пробе.(мг/л) |
2004 год | 2005 год | 2006 год | |||||||||
| I | II | III | IV | I | II | III | IV | I | II | III | IV | |
| Медь | 0,002 | 0,002 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 |
| Цинк | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,002 | 0,001 | 0,001 | 0,001 | 0,002 | 0,001 |
| Кадмий | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 | 0,00002 |
| Свинец | 0,002 | 0,001 | 0,001 | 0,002 | 0,001 | 0,001 | 0,002 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 |
| Ртуть | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 | <0,00005 |
| Мышьяк | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Селен | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | 0,0001 | 0,0001 |
| Серебро | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Железо | 0,22 | 0,21 | 0,22 | 0,26 | 0,22 | 0,24 | 0,26 | 0,24 | 0,22 | 0,24 | 0,22 | 0,22 |
| О.жест.(г*экв/л) | 2,28 | 2,48 | 2,36 | 2,26 | 2,22 | 2,42 | 2,30 | 2,36 | 2,32 | 2,41 | 2,36 | 2,23 |
В таблице 10. приведены среднеквартальные значения веществ за период с 2004 по 2006 годы в ул. Авиационной.
Как следует из данной таблице, концентрация ионов меди в этом объекте за весь период исследований изменялась в пределах от 0,001 до 0,002мг/л. Концентрация ионов цинка за данный период исследования варьировала от 0,001 до 0,002 мг/л. Концентрация ионов кадмия оставалась стабильной за весь период исследования и составляла 0,00002 мг/л. Концентрация ионов свинца варьировала от 0,001 до 0,002 мг/л. Концентрация ионов железа изменялась в пределах от 0,21 до 0,26. Все выше указанные концентрации были ниже предельно допустимых, что следует из таблицы 5. Концентрации же ионов ртути, мышьяка, селена и серебра были ниже порога чувствительности метода измерения.
Общая жесткость питьевой воды была ниже 3 г*экв/л, то есть вода являлась мягкой. Максимальная жесткость наблюдалась во II кварталах 2004- 2006 гг.
Просуммировав концентрацию каждого вещества за квартал и разделив полученное число на 4, мы получили следующие, среднегодовые значения для каждого компонента за 2004 год:
Сср (Cu) = 0,00100 (мг/л)
Ccр (Zn) = 0,00100 (мг/л)
Ccр (Pb) = 0,00100 (мг/л)
Сср (Ag) = 0,00200 (мг/л)
Cср (Fe) = 0,18000 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ для меди, цинка, кадмия , свинца и железа.
ИЗВ = 0,83530
Найдем среднегодовые значение концентраций веществ, за 2005 год:
Сср (Cu) = 0,00100 (мг/л)
Ccр (Zn) = 0,00100 (мг/л)
Сср (Ag) = 0,00200 (мг/л)
Ccр (Pb) = 0,00100 (мг/л)
Ccр (Fe) = 0,18750 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ для меди, цинка, кадмия и свинца.
ИЗВ = 0,86060
Найдем, среднегодовые значения веществ за 2006 год:
Сср(Сu) = 0,00100 (мг/л)
Сср (Zn) = 0,00100 (мг/л)
Сср (Pb) = 0,00100 (мг/л)
Ccр (Аg) = 0,00200 (мг/л)
Ccр (Fe) = 0,1825 (мг/л)
В соответствии с формулой (2.1) найдем значение ИЗВ для меди, цинка, кадмия и свинца.
ИЗВ= 0,84360
|
Конц. веществ в пробе.(мг/л) |
2004 год | 2005 год | 2006 год | |||||||||
| I | II | III | IV | I | II | III | IV | I | II | III | IV | |
| Медь | - | - | - | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 |
| Цинк | - | - | - | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,002 | 0,001 |
| Кадмий | - | - | - | <0,00001 | <0.00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 |
| Свинец | - | - | - | 0,0001 | 0,0001 | 0,0001 | 0,0001 | 0,0001 | 0,0001 | 0,0001 | 0,0001 | 0,0001 |
| Ртуть | - | - | - | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 | <0,00001 |
| Мышьяк | - | - | - | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 |
| Селен | - | - | - | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | <0,0001 | 0,0001 | 0,0001 |
| Серебро | - | - | - | 0,002 | 0,002 | 0,002 | 0,002 | 0,002 | 0,002 | 0,002 | 0,002 | 0,002 |
| Железо | - | - | - | 0,18 | 0,18 | 0,20 | 0,18 | 0,19 | 0,18 | 0,18 | 0,19 | 0,18 |
| О.жест.(г*экв/л.) | - | - | - | 1,42 | 1,65 | 1,82 | 1,60 | 1,60 | 1,60 | 1,78 | 1,65 | 1,60 |
Таблица 11. Концентрация веществ в пробах питьевой воды в районе военного городка за период 2004-2006 годы
3.2 Сравнительный анализ индекса загрязнения вод в различных районах г.Южно-Сахалинска за период с 2004-2006 гг
Результаты расчета индекса загрязнения вод представлены в таблице 12.
Таблица 12. Индексы загрязнения вод в различных районах города за период с 2004-2006 гг
| Годы. | Обекты. | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Школа №34. | Водовод I | Центр город. | Ул. Авиац. | Воен.городок | |
| 2004 | 1,54175 | 1,24000 | 1,49350 | 1,11050 | 0,83530 |
| 2005 | 1,40525 | 1,09725 | 1,59050 | 1,15250 | 0,86060 |
| 2006 | 1,43075 | 1,33350 | 1,69250 | 1,30225 | 0,84360 |
На основе таблице построим диаграмму, приведенную на рисунке 2.
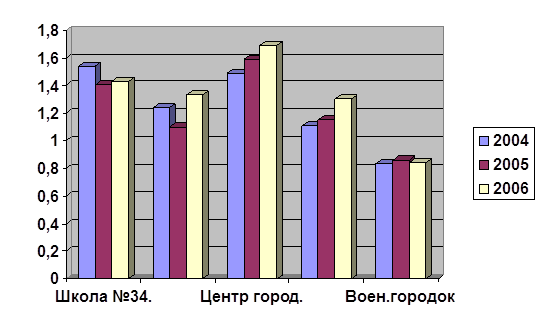
Рисунок 2. Динамика ИЗВ в период с 2004 по 2006 годы
Как видно из диаграммы практически во всех районах наблюдается рост ИЗВ. Исключение составляет школа № 34 и район военного городка.
Поскольку основным загрязнителем воды являются ионы железа мы рассмотрим подробно его динамику.
В таблице 13. приведены среднегодовые значения концентраций железа в различных районах города в период с 2004 по 2006 гг.
Таблица 13. Динамика изменения среднегодовых концентраций ионов железа в различных объектах в период с 2004 по 2006 гг
| Годы. | Объект. | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Школа №34. | Водовод I | Центр город. | Ул. Авиац. | Воен.городок | |
| 2004 | 0,30750 | 0,24000 | 0,30500 | 0,22750 | 0,18000 |
| 2005 | 0,26000 | 0,260000 | 0,32500 | 0,24000 | 0,18750 |
| 2006 | 0,26750 | 0,26000 | 0,33000 | 0,22500 | 0,18250 |
На основе таблице составим диаграмму представленную на рисунке 3.
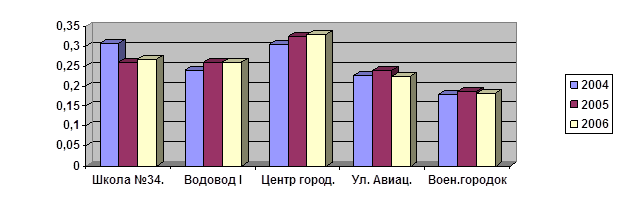
Рисунок 3. Динамика среднегодовых концентраций ионов железа
Как следует из диаграммы концентрация ионов железа имеет тенденцию роста, лишь в центре города.
ЗАКЛЮЧЕНИЕ
На основе проделанной работы мы можем сделать следующие выводы:
- вода г.Южно-Сахалинска в целом соответствует санитарно-гтгиеническим требованиям, однако имеются превышения ПДК железа в отдельных районах, таких как центр города, школа №34 в п.Новоалександровске.
- очистка воды на водоочистных сооружениях города не достаточна по сравнению с той которая производится территории не подведомственной водоканалу.
- в качестве мер повышение качества питьевой воды можно порекомендовать меры по обезжелезиванию.
- следует обратить внимание на низкую жесткость питьевой воды во всех исследуемых районах, так это оказывает неблагоприятный эффект на здоровье население и способствует росту сердечно-сосудистых заболеваний.
Литература
1. Барковский В.Ф., Городенцева Т.Б. Основы физико-химических методов анализа.- М.: Высшая школа, 1983.- 426 с.
2. Барсукова З.А. Аналитическая химия.- М.: Высшая школа, 1990.- 320 с.
3. Вальвакова Н.B. Требования к оформлению выпускных квалификационных работ: Учебно-методическое пособие.- Южно-Сахалинск: Изд-во Сах-ГУ, 2003.- 16 с.
4. Глазковская М.А. Геохимия природных и техногенных ландшавтов СССР.- М.: Высшая школа, 1988.- 328 с.
5. Громов О.А. Анализ в химии. - М.: Химия, 1987.- 447 с.
6. Данильчук Б.С. Токcикология и токсины. – М.: Медицина, 1989.- 271 c.
7. Дарижапов Б.Б. О мерах повышения качества питьевой воды Зибарь Р.Н., Васильева А. А. Тяжелые металлы в биосфере.- М.: Мысль, 1984.- 396 c.
8. Злыкин О.B. Влияние некоторых ксенобитиков на организм человека.- М.: Медицина, 1995.- 342 c.
9. Крылов Б.M. Анализ степени токсичности ряда элементов.- М.: Просвещение, 1988.- 381 с.
10. Левина Э.Н. Общая токсикология металлов.- М.: Мысль, 1982.- 275 с.
11. Лужников Е.A. Клиническая токсикология.- М.: Медицина, 1999.- 441 с.
12. Лурье Ю.Ю. Аналитическая химия промышленных сточных вод.- М.: Химия, 1984.- 448 c.
13. Люборский В.M. Повышение качества питьевой воды / В.M. Люборский, И.Н. Рыбников.- М.: Стройиздат, 1987.- 108 с.
14. Мишин О.А. Влияние тяжелых металлов на живые организмы.- М.: Просвещение, 1985.- 273 с.
15. Мраков В.A. Загрязняющие вещества в питьевой воде.- М.: Наука, 1990.- 415 c.
16. Николаев Л.А. Металлы в живых организмах.- М.: Просвещение, 1986.- 127 с.
17. Новиков С.С. Оценка качества питьевой воды.- М.: Мысль, 1995.- 183 с.
18. Ольгин М.В. Выявление степени токсичности ряда веществ.- М.: Медицина, 1993.- 281 c.
19. Орлов Д.А. Химия и охрана почв.- М.: Химия, 1996.- 175 с.
20. Пивоваров Ю.П. Гигиена с основами экологии человека / Ю.П. Пивоваров, В.B. Королик, Л.C. Зиневич.- Ростов-на-Дону: Феникс, 2002.- 652
21. Протасов В.Ф. Экология,здоровье и охрана окружающей среды в России.- M.: Финансы и статистика, 2000.- 655 c.
22. Пряшин Э.В. Клиническая токсикология.- M: Медицина, 1994.- 583 с.
23. Пузаков С.A. Химия.- M.: Медицина, 1995.- 268 с.
24. Романов Д.М. Количественный метод анализа в химии.- M.: Наука, 1998.- 340 c.
25. Cафронов С.Н. Оформление курсовых и дипломных работ: Учебно- метод.пособ.- Южно-Сахалинск: Изд-во Южно-Сахалинского гос. пед. института, 1998.- 45 с.
26. Степановских А. C. Экология.- Курган.: Зауралье, 1997.-617 с.
27. Топилин К.Л. Экологические проблемы современной России.- М.: Финансы и статистика, 2001.- 568 c.
28. Трусов B.И. Учебно-методическое пособие по общей химии для студентов лечебных и медико-профилактических факультетов.- М.:Медицина, 1993.- 237 с.
29. Трухина О.Е. Физико-химические методы анализа при экологическом мониторинге.- М.: Просвещение, 1989.- 352 с.
30. Урманов И.A. Методы очистки промышленных сточных вод.- M.: Стройиздат, 1988.- 286 с.
31. Уткин Г.Я. Загрязняющие вещества в воде.- М.: Мысль, 1987.- 428 c.
32. Фефилов А.K. Охрана окружающей среды.- М: Проспект,- 1992.- 372 с.
33. Фомин В.В. Мониторинг и методы контроля окружающей среды.-М.: Наука, 2001.-334 с.
34. Хворин И.М. Токсичность тяжелых металлов в виде различных соединений.- М.: Просвещение,- 1985.-368 с.
35. Хоружая Т.А. Методы оценки экологической опасности.- М.: Контур, 1998.- 233 с.
36. Чащина У.А Гигиена и охрана здоровья человека.- M.: Высшая школа,- 1991.- 186 с.
37. Шустов С.Б. Химические основы экологии.- М.: Просвещение, 1994.-239
38. Энциклопедический словарь-справочник. Окружающая среда / Под ред. А.И. Шпигеля.- M: Прогресс, 1999.- 376 c.
39. Эйхлер В. Яды в нашей пищи. Перевод с немецкого Г.И. Лойдиной, В.А. Турганимовой / Под ред. Б.Р. Cтригановой / - М.: Мир, 1993.- 188 c.
40. Юрин В.М. Основы ксенобиологии.- Минск: Новое знание, 2002.- 263 c.
41. Юрченко Г.П. Атамно-адсорбционный метод анализа.- М.: Химия, 1990.- 251 c.
42. Юрьева А.В. Патогенез вредных и ядовитых веществ.- М.: Медицина, 1998.- 446 c.
43. Ярмоленко Т.O. Особенности патогенеза тяжелых металлов.- М.: Наука, 1996.- 248 c.
44. Ярцев А.Е. Токсикология .- М.: Просвещение, 1988.- 368 c.
45. Вода питьевая. Общие требования к организации и методам контроля качества. // М.: Роскомстандарт России, 1999.- 42 c.
46. Питьевая вода. Гигиенические требования к качеству воды централизованных систем водоснабжения. Контроль качества. Cан.ПиН 2.14.1074.-01. // М.: Минздрав России, 2002.- 69 c.
© 2009 База Рефератов