
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Доклад: Расчет коэффициентов активности. Личный опыт
Доклад: Расчет коэффициентов активности. Личный опыт
Не так давно я вплотную столкнулся с расчетами коэффициента активности растворов электролитов. Нельзя сказать, что раньше я никогда не производил таких расчетов, однако сейчас у меня возникли некоторые вопросы, связанные с расчетами в области высоких концентраций.
Известно, что до ионной силы 0,01М коэффициент активности (f) хорошо описывается расширенной формулой Дебая-Хюккеля:
|
|
(1) |
где z - заряд иона;
I - ионная сила раствора;
P - параметр Килланда, зависящий от размера иона;
A = 0,509 при 250С ;
B = 0,328 при 250С .
Ионная сила раствора равна
|
|
(2) |
где Ci - концентрация ионов одного вида в исследуемом растворе.
Для области большей ионной силы, самой распространенной является следующая формула:
|
|
(3) |
Эта формула предполагает увеличение коэффициента активности после некоего значения ионной силы.
Большинство исследователей предпочитают в своих работах не упоминать об условиях, при которых следует от формулы (1) переходить к формуле (3). В связи с этим я предпринял собственные исследования, благо в моем распоряжении была программа IonCalc ( Программу можно получить здесь.).
Поскольку я располагал справочными данными ("Краткий химический справочник" В.А.Рабиновича и З.Я.Хавина, изд. "Химия",1977г.) об экспериментально полученных значениях коэффициента активности, то работа состояла в сопоставлении этих данных с расчет ными. Расчеты я производил по формуле (1), так как применение формулы (3) только усугубляло расхождение между экспериментальными и расчетными данными.
В справочнике приведены экспериментально полученные данные о среднем коэффициенте активности растворов солей. Средний коэффициент активности составляют коэффициенты активности аниона и катиона следующим образом:
f срm+n = fMm + fAn , где
fM и fA - коэффициенты активности катиона и аниона:
m и n - стехиометрические коэффициенты исследуемой соли MmAn.
Если распоряжаться этой формулой, то можно легко рассчитать средний коэффициент активности и сравнить его с экспериментальным.
Проведенные мной расчеты представлены в таблице, которая содержит сведения об относительной разнице в процентах между экспериментальными и расчетными данными. Относительная погрешность представлена в двух видах: среднеарифметическая величина погрешности (первое число) и максимальная погрешность в серии расчетов (второе число).
Таблица 1.*)
|
I, M |
0,1 | 0,2 | 0,3 | 0,4 | 0,6 | 0,8 |
|
MA 1) |
1,8/2,8 | 3,6/5,9 | - | 7,2/10 | - | - |
|
MA2 2) |
- | - | 2,8/5 | - | 5,8/7,5 | - |
|
M2A 3) |
- | - | 3,8/5,5 | - | 5,9/11 | - |
|
MSO4 4) |
- | - | - | - | - | 76/91 |
|
LaCl3 |
- | - | - | - | 16 | - |
|
H3PO4 |
- | - | - | - | 16 | - |
1) AgNO3 , HCl, HNO3 , KBr, KCl, KOH, NaCl, NaOH, NH4Cl, NaCH3COO, NaNO3 , KNO3 .
2) BaCl2 , CaCl2 , FeCl2 , MgBr2 , MgCl2 , Ca(NO3)2 , Co(NO3)2 , Cu(NO3)2.
3) K2CrO4, K2SO4, Na2CrO4, (NH4)2SO4, Na2SO4, Na2CO3, K2CO3 .
4) ZnSO4, MgSO4, MnSO4, Cu SO4 .
Расчеты показывают, что для ионной силы в 0,3М максимальная погрешность составляет 5-6%.
Необъясненным остается тот факт, что коэффициент активности сульфатов двухзарядных металлов очень высок в сравнении с экспериментальными данными. Также высок средний коэффициент активности серной кислоты. Он составляет 0,266 для раствора с ионной силой 0,3 М, в то время как расчеты предоставляют величину 0,517.
© 2009 База Рефератов
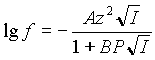
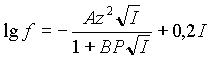 .
.