
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Энтальпия образования индивидуальных веществ. Прогнозирование энтальпии образования методом Бенсона
Курсовая работа: Энтальпия образования индивидуальных веществ. Прогнозирование энтальпии образования методом Бенсона
Оглавление
ВВЕДЕНИЕ
o Энтальпия образования
o Прогнозирование энтальпии образования
o Прогнозирование органических соединений методом Бенсона по атомам с их первым окружением
o Некоторые многовалентные группы метода Бенсона для идеально-газового состояния
o Алканы
o Групповые составляющие для расчета идеально-газовых свойств по Бенсону
o Циклоалканы
o Алкены
o Ацетиленовые углеводороды
o Ароматические углеводороды
o Кислородсодержащие соединения
Наилучшее решение вопросов разработки процессов химической технологии и аппаратуры для их проведения возможно лишь при наличии надежной информации по физико-химическим и термодинамическим свойствам химических соединений. Подобная информация часто составляет от 50 до 90% исходных данных при проектировании.
Для практики предпочтительными являются экспериментальные данные. На протяжении многих лет собрано и обработано огромное количество таких данных. Эти сведения имеются в многочисленных компиляциях и справочниках. В некоторых из них приводятся все известные в настоящее время значения термодинамических и физико-химических характеристик и дается их критический анализ. В других содержатся только рекомендованные авторами величины, часто являющиеся либо средними значениями, либо результатом статистической обработки всего массива накопленных сведений. Однако быстрый прогресс технологии и вовлечение в сферу деятельности все большего количества новых веществ и материалов обусловливают значительный разрыв между потребностью в данных и их наличием. Определение же экспериментальных величин в широких параметрах состояния и составов часто бывает затруднительным, а иногда и просто невозможным.
По этой причине инженер зачастую вынужден полагаться на разнообразные методы расчета и прогнозирования свойств веществ. Следует иметь в виду, что термины “расчет” и прогноз” час то используются как синонимы, хотя второй из них несет в себе честное признание того факта, что результат может быть правильным только отчасти. Расчеты же могут основываться на теории, на корреляции экспериментальных значений или на комбинации того и другого.
Энтальпия образования (enthalpy of formation) является основным свойством, используемым при решении многих теоретических и практических задач. Знание энтальпий образования реагентов позволяет вычислить тепловые эффекты интересующих реакций, что необходимо при оценке адиабатического перепада температур в зоне реакции, формировании требований к конструкции реактора и технологическим особенностям химического процесса. Энтальпии образования веществ необходимы при выполнении количественного термодинамического анализа процессов, определении теоретической степени конверсии реагентов, выборе условий проведения химического превращения и т.п. Качество выполненного термодинамического анализа во многом зависит от надежности сведений по энтальпиям образования веществ.
Единицами измерения энтальпии являются кДж/моль и Дж/моль. В справочной литературе прежних лет энтальпии образования часто представлены в ккал/моль (1 кал = 4,184 Дж, 1 ккал = 4,184 кДж).
Энтальпия образования (![]() ) соединения в узком смысле
есть стандартное изменение энтальпии в реакции образования данного
вещества из элементов или простых веществ. Простыми веществами являются химические
элементы, находящиеся при рассматриваемой температуре в их естественном фазовом
и химическом состояниях.
) соединения в узком смысле
есть стандартное изменение энтальпии в реакции образования данного
вещества из элементов или простых веществ. Простыми веществами являются химические
элементы, находящиеся при рассматриваемой температуре в их естественном фазовом
и химическом состояниях.
В качестве стандартного состояния вещества выбирается такое его состояние, при котором это вещество устойчиво при стандартном давлении, равном 1 атм (101325 Па). Конденсированное состояние вещества является стандартным вплоть до тех температур, при которых давление его насыщенного пара достигает 1 атм. Выше этих температур в качестве стандартного выбирается состояние идеального газа.
Для простых веществ, участвующих в формировании молекул большинства органических соединений, стандартным состоянием при 298,15 К является:
· для углерода - графит;
· для водорода, кислорода, азота, фтора и хлора - идеальный двухатомный газ;
· для брома - двухатомная жидкость;
· для иода и серы - кристаллическое состояние, двухатомное и одноатомное соответственно.
Абсолютные значения энтальпий не могут быть
определены, поскольку они включают абсолютные значения внутренней энергии.
Необходимость определения энтальпий образования соединений потребовала достижения
международного соглашения, по которому были приняты равными нулю значения ![]() элементов и простых
веществ, находящихся в стандартном состоянии.
элементов и простых
веществ, находящихся в стандартном состоянии.
Величина и знак ![]() веществ со сложным
строением молекул могут быть различными. Объясняется это следующим. Образование
вещества из свободных атомов всегда сопровождается выделением энергии,
веществ со сложным
строением молекул могут быть различными. Объясняется это следующим. Образование
вещества из свободных атомов всегда сопровождается выделением энергии, ![]() полученных при этом
веществ отрицательна. Однако при образовании вещества из простых веществ,
состоящих из двухатомных молекул (H2, О2, N2,
Cl2 и пр.) или находящихся в конденсированном состоянии (углерод,
бром и т.п.), некоторое количество энергии требуется для разрыва связей в
молекулах этих простых веществ или для перевода их в газообразное состояние. В
результате этого энтальпия образования может быть и положительной, и отрицательной,
и равной нулю величиной.
полученных при этом
веществ отрицательна. Однако при образовании вещества из простых веществ,
состоящих из двухатомных молекул (H2, О2, N2,
Cl2 и пр.) или находящихся в конденсированном состоянии (углерод,
бром и т.п.), некоторое количество энергии требуется для разрыва связей в
молекулах этих простых веществ или для перевода их в газообразное состояние. В
результате этого энтальпия образования может быть и положительной, и отрицательной,
и равной нулю величиной.
В общем случае значение и знак ![]() не дают оснований для
каких-либо утверждений относительно термодинамической стабильности вещества,
так как она зависит не только от энтальпийной, но и от энтропийной составляющей
изменения свободной энергии при образовании этого вещества. Тем не менее, для
сопоставления термодинамической стабильности представителей одной
гомологической группы или соединений с близким строением молекул может быть
достаточно информативным, в первом приближении, анализ их энтальпий образования.
В этом случае вещество, имеющее меньшее значение энтальпии образования,
обладает большей термодинамической стабильностью.
не дают оснований для
каких-либо утверждений относительно термодинамической стабильности вещества,
так как она зависит не только от энтальпийной, но и от энтропийной составляющей
изменения свободной энергии при образовании этого вещества. Тем не менее, для
сопоставления термодинамической стабильности представителей одной
гомологической группы или соединений с близким строением молекул может быть
достаточно информативным, в первом приближении, анализ их энтальпий образования.
В этом случае вещество, имеющее меньшее значение энтальпии образования,
обладает большей термодинамической стабильностью.
Для большинства
соединений реакции их образования из простых веществ не могут быть осуществлены
на практике. Основным источником фактической информации об энтальпиях
образования органических соединений являются экспериментальные данные по
энтальпиям их сгорания (![]() ), полученные
калориметрическим методом. Накопленные к настоящему времени и рекомендуемые
значения
), полученные
калориметрическим методом. Накопленные к настоящему времени и рекомендуемые
значения ![]() и
и ![]() содержатся в компиляциях
[1-4]. До настоящего времени справочные сведения об
содержатся в компиляциях
[1-4]. До настоящего времени справочные сведения об ![]() были
представлены исключительно калориметрическими данными. Современные эмпирические
методы прогнозирования
были
представлены исключительно калориметрическими данными. Современные эмпирические
методы прогнозирования ![]() также базируются
только на калориметрических данных. При этом следует отметить, что информация,
уникальная по спектру задействованных веществ, объему выполненных исследований
и точности полученных термодинамических характеристик, содержится в результатах
изучения химического равновесия. На наш взгляд, эффективное использование этих
сведений позволит существенно расширить прогностические возможности методов
массовых расчетов
также базируются
только на калориметрических данных. При этом следует отметить, что информация,
уникальная по спектру задействованных веществ, объему выполненных исследований
и точности полученных термодинамических характеристик, содержится в результатах
изучения химического равновесия. На наш взгляд, эффективное использование этих
сведений позволит существенно расширить прогностические возможности методов
массовых расчетов ![]() органических веществ.
органических веществ.
ПРОГНОЗИРОВАНИЕ ЭнтальпиЙ образования [1-8]
Основные методы
прогнозирования энтальпий образования органических соединений относятся к ![]() , то есть характеризуют
свойство вещества, находящегося в состоянии идеального газа при давлении 1 атм.
и температуре 298,15 К, которую часто называют стандартной. Среди методов
массовых расчетов
, то есть характеризуют
свойство вещества, находящегося в состоянии идеального газа при давлении 1 атм.
и температуре 298,15 К, которую часто называют стандартной. Среди методов
массовых расчетов ![]() особого внимания
заслуживают методы молекулярной механики и аддитивные методы (лат. additio
- прибавление). Большинство полуэмпирических методов не обеспечивает требуемого
качества прогноза. Неэмпирические методы не дают прямого выхода на энтальпии образования
веществ и к тому же до сих пор являются малодоступными для расчета свойств
органических веществ со сложным строением молекул.
особого внимания
заслуживают методы молекулярной механики и аддитивные методы (лат. additio
- прибавление). Большинство полуэмпирических методов не обеспечивает требуемого
качества прогноза. Неэмпирические методы не дают прямого выхода на энтальпии образования
веществ и к тому же до сих пор являются малодоступными для расчета свойств
органических веществ со сложным строением молекул.
В группе методов
молекулярной механики нами накоплен значительный опыт по использованию метода
ММХ (на базе силового поля Эллинджера). Метод хорошо зарекомендовал себя в
приложении к ![]() алканов. Однако уже для
ароматических соединений его целесообразно использовать не для расчета энтальпий
образования, а для оценки эффектов взаимодействия заместителей в молекуле, т.е.
для разностей энтальпий образования изомеров. Для большинства
галогенорганических, кислород-, азот- и серосодержащих соединений метод дает
смещенные оценки
алканов. Однако уже для
ароматических соединений его целесообразно использовать не для расчета энтальпий
образования, а для оценки эффектов взаимодействия заместителей в молекуле, т.е.
для разностей энтальпий образования изомеров. Для большинства
галогенорганических, кислород-, азот- и серосодержащих соединений метод дает
смещенные оценки ![]() . Тем не менее,
этот метод следует применять во всех случаях для экспрессной оценки свойства.
Как и любой другой метод, он требует подкрепления результатов сведениями,
полученными другим методом прогнозирования. Метод молекулярной механики имеет
прекрасный интерфейс и исключительно результативен как источник информации о
строении молекул и их геометрических параметрах.
. Тем не менее,
этот метод следует применять во всех случаях для экспрессной оценки свойства.
Как и любой другой метод, он требует подкрепления результатов сведениями,
полученными другим методом прогнозирования. Метод молекулярной механики имеет
прекрасный интерфейс и исключительно результативен как источник информации о
строении молекул и их геометрических параметрах.
При отсутствии справочных
данных для прогнозирования ![]() в
настоящее время широко используются различные аддитивные методы. С момента создания
основных аддитивных методов прогнозирования свойств органических веществ, находящихся
в состоянии идеального газа, прошел значительный период времени, однако они
сохраняют свою значимость, несмотря на становящиеся все более доступными методы
молекулярного моделирования. Эти методы эффективны в тех случаях, когда
свойство изменяется линейно при изменении количества однотипных фрагментов в
молекуле. Строго аддитивной является, например, молекулярная масса вещества.
Для энтальпий образования органических соединений аддитивный подход является во
многих случаях лишь некоторым приближением в расчете. Дело в том, что даже в
гомологической группе
в
настоящее время широко используются различные аддитивные методы. С момента создания
основных аддитивных методов прогнозирования свойств органических веществ, находящихся
в состоянии идеального газа, прошел значительный период времени, однако они
сохраняют свою значимость, несмотря на становящиеся все более доступными методы
молекулярного моделирования. Эти методы эффективны в тех случаях, когда
свойство изменяется линейно при изменении количества однотипных фрагментов в
молекуле. Строго аддитивной является, например, молекулярная масса вещества.
Для энтальпий образования органических соединений аддитивный подход является во
многих случаях лишь некоторым приближением в расчете. Дело в том, что даже в
гомологической группе ![]() изменяется нелинейно
с изменением числа углеродных атомов в молекуле (рис. 1.1).
изменяется нелинейно
с изменением числа углеродных атомов в молекуле (рис. 1.1).
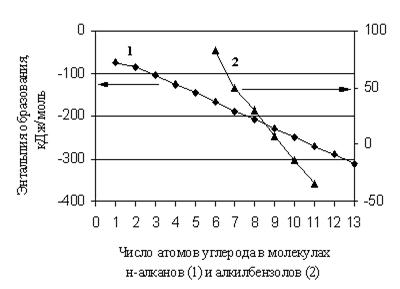
Рис. 1.1. Зависимость энтальпии образования н-алканов и алкил бензолов от числа атомов углерода в их молекулах
Таким образом,
гомологическая разность не является величиной постоянной, особенно для первых
членов гомологических групп. Точно так же при увеличении количества
заместителей одного вида в молекулах органических веществ очень часто приходится
говорить об отклонении от аддитивности в ![]() .
Однако при введении поправок на неаддитивность методы данной группы работают
вполне удовлетворительно, если степень и глубина их детализации достаточны и
отвечают точности современного эксперимента.
.
Однако при введении поправок на неаддитивность методы данной группы работают
вполне удовлетворительно, если степень и глубина их детализации достаточны и
отвечают точности современного эксперимента.
В зависимости от принятой идеологии в качестве носителя структурной и количественной информации в аддитивных методах могут выступать составляющие молекулу атомы, группы атомов или связи. Большинство методов прогнозирования построено таким образом, что по мере расширения базы данных по энтальпиям образования относительно легко могут быть уточнены значения парциальных вкладов или введены новые поправки.
Общий подход к прогнозированию энтальпий образования
веществ предполагает вычисление ![]() с
последующим, при необходимости, переходом к идеально-газовым энтальпиям
образования при других температурах или к
с
последующим, при необходимости, переходом к идеально-газовым энтальпиям
образования при других температурах или к ![]() ,
т.е. к свойству вещества в реальном состоянии.
,
т.е. к свойству вещества в реальном состоянии.
Из всего разнообразия
аддитивных методов расчета ![]() нами рассматриваются
два; групповой метод Бенсона по атомам с их первым окружением и метод Татевского
по связям.
нами рассматриваются
два; групповой метод Бенсона по атомам с их первым окружением и метод Татевского
по связям.
Прогнозирование ![]() органических
соединений методом Бенсона по атомам с их первым окружением
органических
соединений методом Бенсона по атомам с их первым окружением
Следует признать, что из всего многообразия аддитивных
схем для прогнозирования энтальпий образования органических веществ метод Бенсона
в течение продолжительного периода применяется наиболее широко. Объясняется
это, вероятно, тем, что этим методом охвачен наиболее широкий круг соединений.
Для оперативной оценки ![]() абсолютного
большинства соединений без привлечения каких-либо технических средств метод,
пожалуй, не имеет себе равных. Совершенно очевидно, что ценой его универсальности
является точность прогноза. Поэтому при использовании метода необходимо знать о
неизбежных его ограничениях. На основные из них, являющиеся результатом нашей
широкой апробации метода, мы постараемся обратить внимание потенциальных
пользователей.
абсолютного
большинства соединений без привлечения каких-либо технических средств метод,
пожалуй, не имеет себе равных. Совершенно очевидно, что ценой его универсальности
является точность прогноза. Поэтому при использовании метода необходимо знать о
неизбежных его ограничениях. На основные из них, являющиеся результатом нашей
широкой апробации метода, мы постараемся обратить внимание потенциальных
пользователей.
Метод Бенсона принято называть групповым, хотя в качестве
структурной единицы в нем избран атом с его первым окружением.
Метод разработан автором для расчета следующих идеально-газовых свойств
веществ: теплоемкости ![]() при
температурах, кратных 100 градусам, энтальпии образования
при
температурах, кратных 100 градусам, энтальпии образования![]() и энтропии
и энтропии ![]() .
.
По мере развития метода автор несколько изменял символику групп. Однако при некотором навыке работы с методом это не создает каких-либо ощутимых трудностей. Нами используется последняя редакция метода [5].
В табл. 1.1. приведены некоторые из наиболее распространенных групп для элементов C, N, O и S. В колонке “валентность” показано число одновалентных групп, таких как атом водорода или галогена, которые могут быть связаны с рассматриваемой группой.
Значения парциальных вкладов в свойства и специфические поправки приведены в табл. 1.2. Мы сочли себя вправе сделать некоторые дополнения к авторской редакции таблицы. Эти дополнения касаются только поправок, учитывающих взаимодействие соседних заместителей в молекулах алкилароматических соединений и галогеналкилбензолов. Они получены на основе экспериментальных данных или вычислены методом молекулярной механики ММХ.
Таблица достаточно объемна. Знакомство с ее структурой и приемы работы с методом изложены ниже в приложении к соединениям различных классов и сопровождены конкретными примерами.
Таблица 1.1
Некоторые многовалентные группы метода Бенсона для идеально-газового состояния
| Группа | Валентность | Комментарий |
|
С |
4 | Четырехвалентный углерод в молекулах алканов, циклоалканов и в алкильных или циклоалкильных заместителях |
|
=С |
2 | Углерод при двойной связи в молекулах алкенов, циклоалкенов и в алкенильных или циклоалкенильных заместителях; обращаем внимание на то, что символ Cd не относится к атому углерода при двойной связи, а принадлежит кадмию |
|
Сb |
1 | Углерод ароматического ядра, не принадлежащий узловым атомам углерода в соединениях с конденсированными ядрами |
|
Сp |
3 | Узловой углеродный атом ароматических углеводородов с конденсированными ядрами |
|
Ct |
1 | Углерод при тройной связи (алкины) |
|
=С= |
0 | алленовый углерод (центральный углерод в структурах типа >C=C=C<) |
|
=Cim |
2 | Углерод при двойной связи с азотом в имино-группе (С в >C=N-) |
|
CO |
2 | Карбонильная группа в молекулах альдегидов, кетонов, сложных эфиров, карбоновых кислот |
|
О |
2 | Кислород в простых эфирах, спиртах, а также некарбонильный кислородный атом в сложных эфирах, карбоновых кислотах и ангидридах карбоновых кислот |
|
N |
3 | Трехвалентный азот (амины) |
|
=Nim |
1 | Азот имино-группы (N в >C=N-) |
|
=Naz |
1 | Азот азо-группы (N в -N=N-) |
|
Nb |
0 | Ароматический азот (пиридин, пиразин и пиримидин, но не пиридазин) |
|
CS |
2 | Тиокарбонил |
|
S |
2 | Двухвалентная сера (сульфиды) |
|
SO2 |
2 | Группа сульфонов |
|
SO |
2 | Сульфоксидная группа |
|
1-Ad |
1 | 1-Адамантильный фрагмент |
Алканы
Прогнозирование ![]() алканов
состоит в вычислении аддитивной составляющей энтальпии образования и
введении поправок на гош-взаимодействия.
алканов
состоит в вычислении аддитивной составляющей энтальпии образования и
введении поправок на гош-взаимодействия.
Расчет аддитивной составляющей производится следующим образом.
Записывается структурная формула алкана.
В молекуле алкана выделяются все атомы углерода с их первым окружением, для которых принята следующая символика: CH3–(C) - первичный, CH2–(2C) - вторичный, CH–(3C) - третичный, C–(4C) – четвертичный, т.е. символом "C" обозначены насыщенные атомы углерода. Поскольку углерод является четырехвалентным, то в условном обозначении для каждого из ключевых атомов указаны четыре атома, с которыми он связан. Значения парциальных вкладов для вторичного, третичного и четвертичного атомов углерода, приведенные в табл. 1.2, применяются не только для алканов или алкильной составляющей молекул других классов органических соединений, но и для насыщенных циклических фрагментов молекул.
Cуммированием парциальных вкладов, приведенных в первой части табл. 1.2 с подзаголовками “CH3 , CH2, CH и C группы”, получают аддитивную составляющую свойства. Количество слагаемых при этом равно количеству атомов углерода в молекуле. Так, для бутанов количество парциальных вкладов равно четырем, для октанов - восьми и т.п.
Значение аддитивной составляющей свойства еще не определяет его величины. Следующим этапом расчета является учет всех необходимых поправок. При прогнозировании энтальпий образования алканов методом Бенсона вводятся поправки на гош-взаимодействие алкильных фрагментов в молекуле, которые разделены тремя углерод-углеродными связями. Расчет поправок на гош-взаимодействие производится следующим образом.
* В молекуле алкана выделяются все неконцевые углерод-углеродные связи.
* Для каждой из выделенных связей рисуются три проекции Ньюмена, в которых молекула алкана представлена скошенными конформациями, то есть алкильные фрагменты молекул, разделенные тремя связями, повернуты относительно друг друга на 60 градусов.
* Для каждого из трех конформеров определяется количество гош-взаимодействий типа “алкил-алкил (взаимодействия типа “водород-алкил” и “водород-водород” считаются незначимыми). Наименьшее количество гош-взаимодействий, полученное при этом, характеризует рассматриваемую связь и участвует далее в расчете суммарной гош-поправки. Таким образом, при рассмотрении любой из неконцевых связей допускается, что молекула находится именно в той конформации, для которой стерические напряжения являются наименьшими из возможных.
*
Избранные для каждой из неконцевых
связей количества гош-взаимодействий суммируются. Сумма умножается на
значение, рекомендованное в табл. 1.2 (подраздел “Поправки на гош- и
1,5-отталкивающие взаимодействия”) для одной гош-поправки,
которое равно 3,35 кДж/моль. Суммарная величина поправок прибавляется к
аддитивной составляющей свойства. В результате получаем значение ![]() для рассматриваемого алкана.
для рассматриваемого алкана.
Пример 1.1
Рассчитать ![]() 2,2,4-триметилгексана.
2,2,4-триметилгексана.
Решение
1. Структурная формула молекулы рассматриваемого вещества такова:
Таблица 1.2
Групповые составляющие для расчета идеально-газовых свойств по Бенсону
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
CH3 группы
|
CH3–(Al) |
-42,19 | ||||||||
|
CH3–(BO3) |
-42,19 | ||||||||
|
CH3–(B) |
-42,19 | ||||||||
|
CH3–(Cb) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | 73,59 |
|
CH3–(Cd) |
-42,19 | ||||||||
|
CH3–(CO) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | 73,59 |
|
CH3–(Ct) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | 73,59 |
|
CH3–(C) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | 73,59 |
|
CH3–(Ge) |
-42,19 | ||||||||
|
CH3–(Hg) |
-42,19 | ||||||||
|
CH3–(N) |
-42,19 | 127,25 | 25,95 | 32,65 | 39,95 | 45,21 | 54,42 | 61,95 | 73,67 |
|
CH3–(O) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,54 | 61,83 | 73,59 |
|
CH3–(Pb) |
-42,19 | ||||||||
|
CH3–(PO) |
-42,19 | 127,25 | 25,91 | 32,82 | 39,95 | 45,17 | 54,54 | 61,83 | 73,59 |
|
CH3–(P) |
-42,19 | 127,25 | 25,91 | 32,82 | 39,95 | 45,17 | 54,54 | 61,83 | 73,59 |
|
CH3–(P=N) |
-42,19 | 127,25 | 25,91 | 32,82 | 39,95 | 45,17 | 54,54 | 61,83 | 73,59 |
|
CH3–(Si) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | 73,59 |
|
CH3–(Sn) |
-42,19 | ||||||||
|
CH3–(SO2) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | |
|
CH3–(SO3) |
-42,19 | 127,29 | |||||||
|
CH3–(SO4) |
-42,19 | 127,29 | |||||||
|
CH3–(SO) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | |
|
CH3–(S) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | |
|
CH3–(Zn) |
-42,19 | ||||||||
|
CH3–(=C) |
-42,19 | 127,29 | 25,91 | 32,82 | 39,95 | 45,17 | 54,5 | 61,83 | 73,59 |
|
CH3–(=Naz) |
-42,19 | ||||||||
|
CH3–(=Nim) |
-42,28 | ||||||||
|
Ct – группы |
|||||||||
| Ct–(Cb) | 122,23 | 26,92 | 10,76 | 14,82 | 14,65 | 20,59 | 22,35 | 23,02 | 24,28 |
| Ct–(Ct) | 123,78 | 24,57 | 14,82 | 16,99 | 18,42 | 19,42 | 20,93 | 21,89 | 23,32 |
| Ct–(C) | 115,32 | 26,58 | 13,1 | 14,57 | 15,95 | 17,12 | 19,25 | 20,59 | 26,58 |
| Ct–(=C) | 122,23 | 26,92 | 10,76 | 14,82 | 14,65 | 20,59 | 22,35 | 23,02 | 24,28 |
| Ct-(Br) | 98,79 | 151,11 | 34,74 | 36,42 | 37,67 | 38,51 | 39,77 | 40,6 | |
| Ct-(Cl) | 74,51 | 139,81 | 33,07 | 35,16 | 36,42 | 37,67 | 39,35 | 40,18 | |
| Ct-(F) | 10,46 | 122,02 | 28,55 | 31,65 | 33,99 | 35,79 | 38,3 | 39,85 | 41,77 |
| Ct-(H) | 112,72 | 103,39 | 22,06 | 25,07 | 27,17 | 28,76 | 31,27 | 33,32 | 37,04 |
| Ct-(I) | 141,48 | 158,64 | 35,16 | 36,84 | 38,09 | 38,93 | 40,18 | 41,02 | |
| Ct-(CN) | 267,06 | 148,18 | 43,11 | 47,3 | 50,65 | 53,16 | 56,93 | 59,86 | 64,04 |
|
CH2 – группы |
|||||||||
|
CH2–(2Cb) |
-27,21 | ||||||||
|
CH2–(2CО) |
-31,81 | 47,3 | 16,03 | 26,66 | 32,15 | 37,8 | 45,46 | 51,74 | |
|
CH2–(2C) |
-20,64 | 39,43 | 23,02 | 29,09 | 34,53 | 39,14 | 46,34 | 51,65 | 59,65 |
|
CH2–(2О) |
-67,39 | 32,65 | 11,85 | 21,18 | 31,48 | 38,17 | 43,2 | 47,26 | |
|
CH2–(2=С) |
-17,96 | 42,7 | 19,67 | 28,46 | 35,16 | 40,18 | 47,3 | 52,74 | 60,28 |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
CH2–(Сb,CO) |
-22,6 | 40,18 | |||||||
|
CH2–(Сb,Ge) |
-18,63 | ||||||||
|
CH2–(Сb,N) |
-24,4 | ||||||||
|
CH2–(Сb,O) |
-33,91 | 40,6 | 15,53 | 26,26 | 34,66 | 40,98 | 49,35 | 55,25 | |
|
CH2–(Сb,Sn) |
-32,52 | ||||||||
|
CH2–(Сb,SO2) |
-29,8 | 40,18 | 15,53 | 27,5 | 34,66 | 40,98 | 49,77 | 55,25 | |
|
CH2–(Сb,S) |
-19,8 | 20,51 | 38,09 | 49,02 | 57,43 | 63,71 | 72,58 | 78,82 | |
|
CH2–(Сb,=C) |
-17,96 | 42,7 | 19,67 | 28,46 | 35,16 | 40,18 | 47,3 | 52,74 | 60,28 |
|
CH2–(СO,N) |
-22,27 | ||||||||
|
CH2–(СO,O) |
-28,46 | ||||||||
|
CH2–(Сt,CO) |
-22,6 | 44,37 | |||||||
|
CH2–(Сt,O) |
-27,21 | ||||||||
|
CH2–(С,Al) |
2,93 | ||||||||
|
CH2–(С,BO3) |
-9,21 | ||||||||
|
CH2–(С,B) |
-8,66 | ||||||||
|
CH2–(С,Cb) |
-20,34 | 39,1 | 24,45 | 31,85 | 37,59 | 41,9 | 48,1 | 52,49 | 57,6 |
|
CH2–(С,Cd) |
-1,26 | ||||||||
|
CH2–(С,CO) |
-21,77 | 40,18 | 25,95 | 32,23 | 36,42 | 39,77 | 46,46 | 51,07 | |
|
CH2–(С,Ct) |
-19,8 | 43,11 | 20,72 | 27,46 | 33,19 | 38,01 | 45,46 | 51,03 | 59,44 |
|
CH2–(С,Ge) |
-18,33 | ||||||||
|
CH2–(С,Hg) |
-11,22 | ||||||||
|
CH2–(С,N) |
-27,63 | 41,02 | 21,77 | 28,88 | 34,74 | 39,35 | 46,46 | 51,49 | |
|
CH2–(С,N=P) |
81,21 | ||||||||
|
CH2–(С,O) |
-33,91 | 41,02 | 20,89 | 28,67 | 34,74 | 39,47 | 46,5 | 51,61 | 61,11 |
|
CH2–(С,Pb) |
-7,12 | ||||||||
|
CH2–(С,PO) |
-14,23 | ||||||||
|
CH2–(С,P) |
-10,34 | ||||||||
|
CH2–(С,Si) |
-31,94 | ||||||||
|
CH2–(С,Sn) |
-9,13 | ||||||||
|
CH2–(C,SO2) |
-32,11 | 39,35 | 17,12 | 24,99 | 31,56 | 36,84 | 44,58 | 49,94 | |
|
CH2–(C,SO3) |
-35,58 | 41,02 | |||||||
|
CH2–(C,SO4) |
-36,42 | 41,02 | |||||||
|
CH2–(C,SO) |
-29,18 | 39,35 | 19,05 | 26,87 | 33,28 | 38,34 | 45,84 | 51,15 | |
|
CH2–(C,S) |
-23,65 | 41,36 | 22,52 | 29,64 | 36 | 41,73 | 51,32 | 59,23 | |
|
CH2–(C,Zn) |
-7,45 | ||||||||
|
CH2–(C,=C) |
-19,92 | 41,02 | 21,43 | 28,71 | 34,83 | 39,72 | 46,97 | 52,24 | 60,11 |
|
CH2–(C,=Naz) |
-25,12 | ||||||||
|
CH2–(=C,CO) |
-15,91 | ||||||||
|
CH2–(=C,O) |
-27,21 | 37,25 | 19,51 | 29,18 | 36,21 | 41,36 | 48,3 | 53,29 | |
|
CH2–(=C,SO2) |
-29,51 | 43,95 | 20,34 | 28,51 | 34,95 | 40,1 | 47,17 | 52,49 | |
|
CH2(CN)–(Ct) |
108,41 | ||||||||
|
CH2(CN)–(C) |
94,18 | 168,27 | 47,72 | 56,93 | 64,04 | 70,74 | 80,79 | 85,81 | |
|
CH2(CN)–(=C) |
95,86 | ||||||||
|
CH2(NCS)–(C) |
120,97 | 213,48 | 61,95 | ||||||
|
CH2(NO2)–(C) |
-60,28 | 202,6 | 52,7 | 66,22 | 77,52 | 86,48 | 99,58 | 108,41 | |
|
CH2(NO)–(C) |
74,09 | ||||||||
|
CH2–(=C,SO) |
-27,58 | 42,28 | 18,42 | 26,62 | 29,05 | 38,72 | 45,92 | 51,28 | |
|
CH2–(=C,S) |
-27 | 45,63 | 22,23 | 28,59 | 34,45 | 40,85 | 50,98 | 59,48 | |
|
CH – группы |
|||||||||
| CH–(2C,Al) | -31,48 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| CH–(2C,B) | 4,6 | ||||||||
| CH–(2C,Cb) | -4,1 | -50,86 | 20,43 | 27,88 | 33,07 | 36,63 | 40,73 | 42,9 | 44,7 |
| CH–(2C,CO) | -7,12 | -50,23 | 18,96 | 25,87 | 30,89 | 35,12 | 41,11 | 43,99 | |
| CH–(2C,Ct) | -7,2 | -46,84 | 16,7 | 23,48 | 28,67 | 32,57 | 38,09 | 41,44 | 46,55 |
| CH–(2C,Hg) | 15,15 | ||||||||
| CH–(2C,N) | -21,77 | -48,97 | 19,67 | 26,37 | 31,81 | 35,16 | 40,18 | 42,7 | |
| CH–(2C,O) | -30,14 | -46,04 | 20,09 | 27,79 | 33,91 | 36,54 | 41,06 | 43,53 | |
| CH–(2C,Sn) | 14,15 | ||||||||
|
CH–(2C,SO2) |
-18,75 | -50,23 | 18,5 | 26,16 | 31,65 | 35,5 | 40,35 | 43,11 | |
|
CH–(2C,SO3) |
-14,65 | -48,97 | |||||||
|
CH–(2C,SO4) |
-25,12 | -48,97 | |||||||
| CH–(2C,SO) | -20,93 | -48,97 | |||||||
| CH–(2C,S) | -11,05 | -47,38 | 20,3 | 27,25 | 32,57 | 36,38 | 41,44 | 44,24 | |
| CH–(2C,=C) | -6,2 | -48,93 | 17,41 | 24,74 | 30,72 | 34,28 | 39,6 | 42,65 | 47,22 |
| CH–(2C,=Naz) | -14,15 | ||||||||
| CH–(3Cb) | -5,06 | ||||||||
| CH–(3CO) | -51,36 | ||||||||
| CH–(3C) | -7,95 | -50,52 | 19 | 25,12 | 30,01 | 33,7 | 38,97 | 42,07 | 46,76 |
| CH–(C,2Cb) | -5,19 | 15,65 | 24,48 | 30,63 | 34,73 | 39,92 | 43,14 | ||
| CH–(C,2=C) | -5,19 | 15,65 | 24,48 | 30,63 | 34,73 | 39,92 | 43,14 | ||
| CH–(C,Cb,О) | -25,44 | 21,51 | 30,54 | 36,94 | 39,46 | 42,80 | 44,35 | ||
| CH–(C,2CO) | -22,6 | -42,7 | |||||||
| CH–(C,2O) | -68,23 | -48,56 | 22,02 | 23,06 | 27,67 | 31,77 | 35,41 | 38,97 | |
| CH(CN)–(2C) | 107,99 | 82,88 | 45,21 | 54 | 60,69 | 66,14 | 72 | 79,11 | |
|
CH(NO2)–(2C) |
-56,93 | 112,6 | 50,19 | 63,67 | 74,17 | 82,08 | 92,84 | 99,2 | |
|
CH(NO2)2–(Cb) |
-57,35 | ||||||||
|
CH(NO2)2–(C) |
-38,09 | 276,68 | 80,79 | 101,3 | 117,2 | 129,76 | 146,09 | 156,13 | |
| CH(NO)–(2C) | 82,04 | ||||||||
|
C – группы |
|||||||||
| C–(2C,2O) | -77,86 | -149,85 | 19,25 | 19,25 | 23,02 | 25,53 | 27,63 | 28,46 | |
| C–(2C,2=С) | 4,85 | 14,94 | 25,02 | 31,42 | 35,02 | 37,66 | 37,74 | ||
| C–(2C,2Сb) | 4,85 | 14,94 | 25,02 | 31,42 | 35,02 | 37,66 | 37,74 | ||
| C–(3C,Cb) | 11,76 | -147,26 | 19,72 | 28,42 | 33,86 | 36,75 | 38,47 | 37,51 | 31,94 |
| C–(3C,CO) | 5,86 | -138,13 | 9,71 | 18,33 | 23,86 | 27,17 | 30,43 | 31,69 | |
| C–(3C,Ct) | 1,93 | -146,5 | 0,33 | 7,33 | 14,36 | 19,97 | 25,2 | 26,71 | |
| C–(3C,N) | -13,39 | -142,74 | 18,42 | 25,95 | 30,56 | 33,07 | 35,58 | 35,58 | |
| C–(3C,O) | -27,63 | -140,48 | 18,12 | 25,91 | 30,35 | 32,23 | 34,32 | 34,49 | |
| C–(3C,Sn) | 34,16 | ||||||||
|
C–(3C,SO2) |
2,09 | -144,41 | 9,71 | 18,33 | 23,86 | 27,17 | 30,43 | 31,23 | |
|
C–(3C,SO3) |
-6,28 | -143,57 | |||||||
|
C–(3C,SO4) |
-16,74 | -143,57 | |||||||
| C–(3C,SO) | -9,29 | -144,41 | 12,81 | 19,17 | 20,26 | 27,63 | 31,56 | 33,32 | |
| C–(3C,S) | -2,3 | -144,04 | 19,13 | 26,25 | 31,18 | 34,11 | 36,5 | 33,91 | |
| C–(3C,=C) | 7,03 | -145,33 | 16,7 | 25,28 | 31,1 | 34,58 | 37,34 | 37,51 | 34,45 |
| C–(3C,=Naz) | -12,56 | ||||||||
| C–(4Cb) | 29,3 | ||||||||
| C–(4C) | 2,09 | -146,92 | 18,29 | 25,66 | 30,81 | 33,99 | 36,71 | 36,67 | 33,99 |
| C–(4N) | 129,89 | ||||||||
| C(CN)–(3C) | 123,9 | -12,14 | 36,21 | 46,71 | 53,96 | 58,81 | 64,92 | 67,77 | |
|
C(CN)2–(2C) |
293,43 | 118,46 | 61,62 | 74,47 | 83,72 | 90,46 | 99,54 | 104,48 | |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
C(CN)3–(C) |
479,28 | ||||||||
|
C(NO2)–(3C) |
-50,65 | 16,32 | 41,4 | 55,84 | 66,39 | 73,75 | 82,92 | 87,32 | |
|
C(NO2)2–(2C) |
-34,32 | ||||||||
|
C(NO2)3–(C) |
-6,07 | ||||||||
| C(NO)–(3C) | 86,23 | ||||||||
|
Ароматические (Cb и Cp) группы |
|||||||||
| Cb–(B) | 46,04 | ||||||||
| Cb–(Cb) | 20,76 | -36,17 | 13,94 | 17,66 | 20,47 | 22,06 | 24,11 | 24,91 | 25,32 |
| Cb–(CO) | 15,49 | -32,23 | 11,18 | 13,14 | 15,4 | 17,37 | 20,76 | 22,77 | |
| Cb–(Ct) | 23,78 | -32,65 | 15,03 | 16,62 | 18,33 | 19,76 | 22,1 | 23,48 | 24,07 |
| Cb–(C) | 23,06 | -32,19 | 11,18 | 13,14 | 15,4 | 17,37 | 20,76 | 22,77 | 25,03 |
| Cb–(Ge) | 20,76 | ||||||||
| Cb–(Hg) | -7,53 | ||||||||
| Cb–(N) | -2,09 | 40,56 | 16,53 | 21,81 | 24,86 | 26,45 | 27,33 | 27,46 | |
| Cb–(O) | -3,77 | -42,7 | 16,32 | 22,19 | 25,95 | 27,63 | 28,88 | 28,88 | |
| Cb–(Pb) | 23,06 | ||||||||
| Cb–(PO) | 9,63 | ||||||||
| Cb–(P) | -7,53 | ||||||||
| Cb–(P=N) | 9,63 | ||||||||
| Cb–(Si) | 23,06 | -32,19 | 11,18 | 13,14 | 15,4 | 17,37 | 20,76 | 22,77 | 25,03 |
| Cb–(Sn) | 23,06 | ||||||||
|
Cb–(SO2) |
9,63 | 36 | 11,18 | 13,14 | 15,4 | 17,37 | 20,76 | 22,77 | |
| Cb–(SO) | 9,63 | 43,53 | 11,18 | 13,14 | 15,4 | 17,37 | 20,76 | 22,77 | |
| Cb–(S) | -7,53 | 42,7 | 16,32 | 22,19 | 25,95 | 27,63 | 28,88 | 28,88 | |
| Cb–(=C) | 23,78 | -32,65 | 15,03 | 16,62 | 18,33 | 19,76 | 22,1 | 23,48 | 24,07 |
| Cb–(=Nim) | -2,09 | -40,56 | 16,53 | 21,81 | 24,86 | 26,45 | 27,33 | 27,46 | |
| Cb-(Br) | 44,79 | 90,41 | 32,65 | 36,42 | 39,35 | 41,44 | 43,11 | 43,95 | |
| Cb-(Cl) | -15,91 | 79,11 | 30,98 | 35,16 | 38,51 | 40,6 | 42,7 | 43,53 | |
| Cb-(F) | -183,34 | 67,39 | 26,37 | 31,81 | 35,58 | 38,09 | 41,02 | 42,7 | |
| Cb-(H) | 13,81 | 48,26 | 13,56 | 18,59 | 22,85 | 26,37 | 31,56 | 35,2 | 40,73 |
| Cb-(I) | 94,18 | 99,2 | 33,49 | 37,25 | 40,18 | 41,44 | 43,11 | 43,95 | |
|
Cb(CHN2) |
215,57 | 167,43 | 47,3 | ||||||
| Cb(CN) | 149,85 | 85,81 | 41,86 | 48,14 | 52,74 | 55,67 | 59,86 | 62,79 | |
|
Cb(N3) |
317,29 | 116,37 | 34,74 | ||||||
| Cb(NCO) | -29,3 | 120,13 | 55,25 | 64,04 | 70,32 | 74,51 | 79,95 | 82,88 | 85,81 |
| Cb(NCS) | 190,87 | 123,06 | 32,23 | ||||||
|
Cb(NO2) |
-1,67 | 129,76 | 38,93 | 50,23 | 59,44 | 66,56 | 76,18 | 80,37 | |
| Cb(NO) | 22,6 | ||||||||
|
Cb(SO2N3) |
312,26 | ||||||||
|
Cb(SO2OH) |
-547,93 | 123,48 | 65,42 | 79,49 | 84,51 | 97,61 | 109,25 | 113,31 | |
| Cp–(2Cb,Cp) | 20,09 | -20,93 | 12,56 | 15,49 | 17,58 | 19,25 | 21,77 | 23,02 | |
| Cp–(3Cp) | 6,28 | 5,86 | 8,37 | 12,14 | 14,65 | 16,74 | 19,67 | 21,35 | |
| Cp–(Cb,2Cp) | 15,49 | -20,93 | 12,56 | 15,49 | 17,58 | 19,25 | 21,77 | 23,02 | |
|
Группы =С=, =С–, =СH–, =Сim |
|||||||||
| =C–(2Cb) | 33,49 | -53,16 | |||||||
| =C–(2C) | 43,28 | -53,16 | 17,16 | 19,3 | 20,89 | 22,02 | 24,28 | 25,45 | 26,62 |
| =C–(2=C) | 19,25 | -36,84 | |||||||
| =C–(C,Сt) | 35,69 | 18,41 | 22,47 | 24,81 | 25,86 | 27,20 | 27,70 | ||
| =C–(CO,O) | 48,56 | -52,74 | 23,4 | 29,3 | 31,31 | 32,44 | 33,57 | 34,03 | |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| =C–(C,Cb) | 36,17 | -61,11 | 18,42 | 22,48 | 24,82 | 25,87 | 27,21 | 27,71 | 28,13 |
| =C–(C,CO) | 31,39 | -49,39 | 22,94 | 29,22 | 31,02 | 31,98 | 33,53 | 34,32 | |
| =C–(C,N) | -53,96 | ||||||||
| =C–(C,СN) | 163,80 | 66,57 | 40,75 | 47,20 | 52,22 | 55,48 | 60,46 | 62,47 | |
| =C–(C,O) | 43,11 | -53,16 | 17,16 | 19,3 | 20,89 | 22,02 | 24,28 | 25,45 | |
|
=C–(C,SO2) |
60,69 | -40,18 | 15,49 | 26,04 | 33,32 | 38,51 | 44,62 | 47,47 | |
| =C–(C,S) | 45,75 | -51,95 | 14,65 | 14,94 | 16,03 | 17,12 | 18,46 | 20,93 | |
| =C–(C,=C) | 37,17 | -61,11 | 18,42 | 22,48 | 24,82 | 25,87 | 27,21 | 27,71 | 28,13 |
| =CC–(=C,O) | 37,25 | -61,11 | 18,42 | 22,9 | 24,82 | 26,29 | 27,21 | 27,71 | |
|
=C(CN)2 |
339,89 | 66,56 | 56,93 | 69,28 | 78,19 | 84,76 | 93,51 | 98,74 | |
|
=C(NO2)–(C) |
18,42 | ||||||||
| =CH–(B) | 65,3 | ||||||||
| =CH–(Cb) | 28,38 | 26,71 | 18,67 | 24,24 | 28,25 | 31,06 | 34,95 | 37,63 | 41,77 |
| =CH–(CO) | 20,93 | 33,36 | 31,73 | 37,04 | 38,8 | 40,31 | 43,45 | 46,21 | |
| =CH–(Ct) | 28,38 | 26,71 | 18,67 | 24,24 | 28,25 | 31,06 | 34,95 | 37,63 | 41,77 |
| =CH–(C) | 35,96 | 33,36 | 17,41 | 21,05 | 24,32 | 27,21 | 32,02 | 35,37 | 40,27 |
| =CH–(O) | 36 | 33,49 | 17,41 | 21,05 | 24,32 | 27,21 | 32,02 | 35,37 | 40,27 |
| =CH–(Sn) | 36,71 | ||||||||
|
=CH–(SO2) |
52,32 | 49,81 | 12,72 | 19,55 | 24,82 | 28,63 | 32,94 | 36,29 | |
| =CH–(S) | 35,83 | 33,49 | 17,41 | 21,05 | 24,32 | 27,21 | 32,02 | 35,37 | |
| =CH–(=C) | 28,38 | 26,71 | 18,67 | 24,24 | 28,25 | 31,06 | 34,95 | 37,63 | 41,77 |
| =CH–(=Nim) | 28,38 | ||||||||
|
=CH2 |
26,2 | 115,57 | 21,35 | 26,62 | 31,44 | 35,58 | 42,15 | 47,17 | 55,21 |
|
=CH(CHN2) |
251,15 | 193,8 | 72,42 | ||||||
| =CH(CN) | 155,71 | 156,13 | 43,11 | 50,23 | 56,09 | 61,11 | 68,65 | 73,67 | |
| =CH(NCS) | 178,74 | 187,11 | 51,9 | ||||||
|
=CH(NO2) |
29,72 | 185,85 | 51,49 | 63,21 | 72,83 | 80,37 | 90,41 | 97,11 | 105,9 |
| =Cim–(2C) | 43,11 | ||||||||
| =Cim–(Cb,N) | -5,86 | ||||||||
| =Cim–(Cb,O) | -12,98 | ||||||||
| =Cim–(C,N) | -59,86 | ||||||||
| =Cim–(C,O) | -66,97 | ||||||||
| =CimH–(C) | 36 | ||||||||
| =CimH–(N) | -47,72 | ||||||||
| =CimH–(O) | -54,83 | ||||||||
|
=CimH2 |
26,37 | ||||||||
| =C= | 143,16 | 25,12 | 16,32 | 18,42 | 19,67 | 20,93 | 22,19 | 23,02 | 23,86 |
|
Кислородсодержащие группы |
|||||||||
| O–(2C) | -97,11 | 36,33 | 14,23 | 15,49 | 15,49 | 15,91 | 18,42 | 19,25 | |
| O–(2O) | 79,53 | 39,35 | 15,49 | 15,49 | 15,49 | 15,49 | 17,58 | 17,58 | 20,09 |
| O–(2PO) | -228,13 | ||||||||
|
O–(2SO2) |
-16,74 | ||||||||
| O–(2=C) | -138,13 | 42,28 | 14,02 | 16,32 | 17,58 | 18,84 | 21,35 | 22,6 | |
| O–(2CО) | -212,97 | -1,72 | 7,45 | 13,39 | 16,74 | 21,46 | 24,48 | ||
| O–(2Cb) | -88,28 | 4,56 | 5,10 | 6,28 | 8,33 | 11,92 | 14,69 | ||
| O–(Cb,CO) | -153,62 | 42,7 | 8,62 | 11,3 | 13,02 | 14,32 | 16,24 | 17,5 | |
| O–(CO,O) | -79,53 | 34,32 | 1,51 | 6,28 | 9,63 | 11,89 | 15,28 | 17,33 | |
| O–(C,B) | -290,62 | ||||||||
| O–(C,Cb) | -92,27 | 49,81 | 2,6 | 3,01 | 4,94 | 7,45 | 11,89 | 14,99 | |
| O–(C,CO) | -180,41 | 35,12 | 11,64 | 15,86 | 18,33 | 19,8 | 20,55 | 21,05 | |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| O–(C,Cr) | -98,37 | ||||||||
| O–(C,O) | -18,84 | 39,35 | 15,49 | 15,49 | 15,49 | 15,49 | 17,58 | 17,58 | 20,009 |
| O–(C,PO) | -170,36 | ||||||||
| O–(C,P) | -98,37 | ||||||||
| O–(C,P=N) | -170,36 | ||||||||
| O–(C,Ti) | -98,37 | ||||||||
| O–(C,V) | -98,37 | ||||||||
| O–(C,=C) | -127,67 | 40,6 | 12,72 | 13,9 | 14,65 | 15,49 | 17,54 | 18,96 | |
|
O–(O,SO2) |
12,56 | ||||||||
| O–(=C,CO) | -189,2 | 15,91 | 6,03 | 12,47 | 16,66 | 18,79 | 20,8 | 21,77 | |
| OH–(B) | -483,47 | ||||||||
| OH–(Cb) | -158,64 | 121,81 | 18 | 18,84 | 20,09 | 21,77 | 25,12 | 27,63 | |
| OH–(CO) | -243,2 | 102,64 | 15,95 | 20,85 | 24,28 | 26,54 | 30,01 | 32,44 | 37,34 |
| OH–(Ct) | -158,64 | 146,21 | |||||||
| OH–(C) | -158,56 | 121,68 | 18,12 | 18,63 | 20,18 | 21,89 | 25,2 | 27,67 | 33,65 |
| OH–(O) | -68,1 | 116,58 | 21,64 | ||||||
| OH–(PO) | -272,08 | ||||||||
| OH–(P) | -245,71 | ||||||||
|
OH–(SO2) |
-159,06 | ||||||||
| OH–(SO) | -159,06 | ||||||||
| OH–(S) | -159,06 | ||||||||
| OH–(=C) | -158,64 | 146,21 | |||||||
| O(CN)–(Cb) | 29,3 | 122,23 | 34,74 | ||||||
| O(CN)–(C) | 8,37 | 165,34 | 41,86 | ||||||
| O(CN)–(=C) | 31,39 | 180,41 | 54,42 | ||||||
|
O(NO2)–(C) |
-81,21 | 203,01 | 39,93 | 48,3 | 55,5 | 65,3 | 68,61 | 72,75 | |
| O(NO)–(C) | -24,7 | 175,39 | 38,09 | 43,11 | 46,88 | 50,23 | 55,67 | 58,18 | 60,69 |
| CO–(2Cb) | -159,41 | 22,01 | 28,33 | 32,09 | 35,48 | 40,25 | 41,21 | ||
| CO–(C,О) | -146,86 | 20,00 | 24,98 | 28,03 | 30,96 | 33,56 | 37,11 | 39,16 | |
| CO–(С,CО) | -122,17 | 22,84 | 26,44 | 29,96 | 32,93 | 37,66 | 40,84 | ||
| CO–(=C,О) | -135,98 | 24,98 | 28,03 | 31,00 | 33,56 | 37,11 | 39,16 | ||
| CO–(Cb,О) | -135,98 | 9,12 | 11,51 | 16,65 | 21,05 | 26,32 | 29,54 | ||
| CO–(C,N) | -137,24 | 67,78 | 22,47 | 25,82 | 29,58 | 32,05 | 40,25 | 46,82 | |
| CO–(2C) | -131,38 | 62,80 | 23,39 | 26,44 | 29,66 | 32,47 | 37,20 | 40,21 | |
| CO–(C,Сb) | -129,29 | 23,77 | 28,95 | 32,22 | 34,98 | 39,29 | 40,84 | ||
| (CO)Br–(Cb) | -158,23 | ||||||||
| (CO)Cl–(Cb) | -218,92 | 167,43 | |||||||
| (CO)Cl–(C) | -200,92 | 176,64 | 42,28 | 46,04 | 49,39 | 51,9 | 55,67 | 57,76 | |
| (CO)H–(H) | -108,78 | 224,56 | 35,44 | 39,25 | 43,76 | 48,20 | 55,94 | 61,97 | |
| (CO)H–(Cb) | -121,81 | 148,18 | 33,53 | 44,2 | 48,77 | 59,48 | 68,56 | 74,01 | |
| (CO)H–(CO) | -105,9 | 89,16 | 28,13 | 32,78 | 37,25 | 41,4 | 47,84 | 50,73 | |
| (CO)H–(Ct) | -121,81 | 148,18 | |||||||
| (CO)H–(C) | -121,81 | 146,21 | 29,43 | 32,94 | 36,92 | 40,52 | 46,71 | 51,07 | |
| (CO)H–(N) | -123,9 | 146,21 | 29,43 | 32,94 | 36,92 | 40,52 | 46,71 | 51,07 | |
| (CO)H–(O) | -134,37 | 146,21 | 29,43 | 32,94 | 36,92 | 40,52 | 46,71 | 51,07 | |
| (CO)H–(=C) | -121,81 | 148,18 | 24,32 | 30,22 | 39,77 | 48,77 | 63,12 | 74,68 | |
| (CO)I–(Cb) | -99,2 | ||||||||
|
Галогенсодержащие группы |
|||||||||
| CBr–(3C) | -1,67 | -8,37 | 39,35 | 47,72 | 52,74 | 55,25 | 56,93 | 56,09 | |
|
CBr3–(C) |
37,67 | 245,29 | 72,12 | 78,65 | 82,92 | 85,64 | 88,66 | 89,66 | |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
CBrF2–(C) |
-395,56 | ||||||||
| CCl–(2C,O) | -54,58 | ||||||||
| CCl–(3C) | -53,58 | -22,6 | 36,96 | 43,87 | 47,72 | 49,52 | 52,07 | 53,12 | |
|
CCl2–(2C) |
-92,93 | 93,76 | 51,07 | 62,29 | 66,76 | 68,98 | 70,99 | 71,24 | |
|
CCl2F–(C) |
-266,22 | ||||||||
|
CCl3–(CO) |
-43,11 | ||||||||
|
CCl3–(C) |
-104,23 | 210,97 | 68,23 | 75,35 | 79,95 | 82,88 | 86,23 | 87,9 | |
| CClF–(2C) | -225,2 | ||||||||
|
CClF2–(C) |
-444,96 | 185,06 | 57,35 | 67,39 | 73,25 | 77,86 | 82,88 | 85,39 | |
| CF–(3C) | -216,83 | -32,23 | 28,46 | 37,09 | 42,7 | 46,71 | 52,03 | 53,24 | |
| CF–(3N) | -103,14 | ||||||||
|
CF2–(2C) |
-414,4 | 74,51 | 39,01 | 46,97 | 53,24 | 57,85 | 63,46 | 65,84 | |
|
CF2–(2N) |
-391,08 | ||||||||
|
CF2–(C,CO) |
-396,36 | ||||||||
|
CF2–(C,O) |
-466,72 | ||||||||
|
CF3–(Cb) |
-691,5 | 179,15 | 52,32 | 64,04 | 72 | 77,44 | 84,14 | 87,9 | |
|
CF3–(CO) |
-641,02 | ||||||||
|
CF3–(C) |
-702,97 | 177,9 | 53,16 | 62,79 | 68,65 | 74,93 | 80,79 | 83,72 | |
|
CF3–(N) |
-674,76 | ||||||||
|
CF3–(S) |
-629,13 | 162,83 | 41,36 | 54,46 | 62,08 | 68,52 | 76,06 | 79,99 | |
|
CF(NO2)2–(Cb) |
-277,1 | ||||||||
|
CF(NO2)2–(C) |
-195,9 | ||||||||
|
CH2Br–(Cb) |
-16,53 | 176,64 | 30,51 | 46,46 | 52,2 | 57,3 | 65,26 | 69,95 | |
|
CH2Br–(C) |
-22,6 | 170,78 | 38,09 | 46,04 | 52,74 | 57,35 | 64,88 | 70,32 | |
|
CH2Br–(=C) |
-16,53 | 171,62 | 40,6 | 47,72 | 54,42 | 59,86 | 67,81 | 73,67 | |
|
CH2Cl–(Cb) |
-73,42 | ||||||||
|
CH2Cl–(CO) |
-44,79 | ||||||||
|
CH2Cl–(C) |
-69,07 | 158,23 | 37,25 | 44,79 | 51,49 | 56,09 | 64,04 | 69,9 | |
|
CH2Cl–(=C) |
-68,65 | ||||||||
|
CH2F–(C) |
-223,11 | 148,18 | 33,91 | 41,86 | 50,23 | 54,42 | 63,62 | 69,49 | |
|
CH2I–(Cb) |
35,16 | 186,27 | 33,91 | 45,17 | 53,7 | 59,9 | 68,15 | 73,8 | |
|
CH2I–(CO) |
43,07 | ||||||||
|
CH2I–(C) |
33,49 | 179,99 | 38,51 | 46,04 | 54 | 58,18 | 66,14 | 72 | |
|
CH2I–(O) |
15,91 | 170,36 | 34,41 | 43,91 | 51,19 | 56,72 | 64,25 | 69,36 | |
|
CH2I–(=C) |
33,28 | ||||||||
| CHBr–(2C) | -14,23 | 79,95 | 37,38 | 44,62 | 50,06 | 53,75 | 58,81 | 61,62 | |
| CHBrCl–(C) | -37,67 | 191,29 | 51,9 | 58,6 | 63,3 | 68,23 | 74,93 | 79,53 | |
| CHBrF–(C) | -228,13 | ||||||||
| CHCl–(2C) | -61,95 | 69,78 | 35,45 | 42,7 | 48,89 | 53,41 | 59,82 | 64,38 | |
| CHCl–(C,CO) | -94,22 | ||||||||
| CHCl–(C,O) | -90,41 | 66,56 | 37,67 | 41,44 | 43,95 | 46,88 | |||
|
CHCl2–(CO) |
48,93 | ||||||||
|
CHCl2–(C) |
-87,9 | 182,92 | 50,65 | 58,6 | 64,46 | 69,07 | 74,93 | 78,28 | |
| CHClF–(C) | -256,59 | ||||||||
| CHF–(2C) | -205,11 | 58,6 | 30,56 | 37,84 | 43,83 | 48,39 | 54,83 | 58,64 | |
|
CHF2–(C) |
-455 | 163,67 | 41,44 | 50,23 | 57,35 | 63,21 | 69,9 | 74,51 | |
| CHI–(2C) | 43,95 | 89,16 | 38,64 | 45,67 | 50,9 | 54,42 | 59,31 | 61,95 | |
| CHI–(C,=С) | 55,73 | 34,02 | 41,92 | 49,45 | 52,72 | 58,58 | 62,34 | ||
|
CHI2–(C) |
108,83 | 228,55 | 56,93 | 63,42 | 69,61 | 74,17 | 79,7 | 81,58 | |
| CI–(3C) | 54,42 | 41,15 | 49,18 | 54,08 | 56,3 | 57,72 | 56,93 | ||
| =СI–(C) | 98,74 | 37,24 | 38,49 | 38,07 | 39,33 | 39,75 | 40,17 | ||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| =СCl–(=C) | -14,90 | 34,73 | 38,49 | 39,33 | 41,42 | 41,42 | 41,42 | ||
| =СI–(=C) | 92,63 | 38,49 | 41,42 | 41,84 | 43,10 | 43,10 | 42,26 | ||
|
=CBr2 |
31,39 | 199,25 | 51,49 | 55,25 | 58,18 | 59,86 | 62,37 | 63,62 | |
| =CBrCl | 27,21 | 188,78 | 50,65 | 53,16 | 56,51 | 59,02 | 61,53 | 62,79 | |
| =CBrF | -131,02 | 177,9 | 45,21 | 50,23 | 53,58 | 56,51 | 59,86 | 61,53 | |
| =CCl–(C) | -8,79 | 62,79 | |||||||
|
=CCl2 |
-7,53 | 176,22 | 47,72 | 52,32 | 55,67 | 58,18 | 61,11 | 62,79 | |
| =CClF | -180,83 | 166,6 | 43,11 | 48,97 | 52,74 | 55,67 | 59,44 | 61,53 | |
| =CF–(=C) | -144,83 | ||||||||
|
=CF2 |
-324,4 | 156,13 | 40,6 | 46,04 | 50,23 | 53,16 | 57,76 | 60,69 | |
| =CHBr | 46,04 | 160,32 | 33,91 | 39,77 | 44,37 | 47,72 | 51,9 | 55,25 | |
| =CHCl | -5,02 | 148,18 | 33,07 | 38,51 | 43,11 | 46,88 | 51,49 | 54,83 | |
| =CHF | -157,39 | 137,3 | 28,46 | 35,16 | 39,77 | 43,95 | 49,39 | 53,16 | |
| =CHI | 102,55 | 169,53 | 36,84 | 41,86 | 45,63 | 48,56 | 52,74 | 55,67 | |
| =CimBr–(Cb) | 29,3 | ||||||||
| =CimBr–(C) | -24,7 | ||||||||
| =CimCl–(Cb) | 14,65 | ||||||||
| =CimCl–(C) | -39,35 | ||||||||
| =CimF–(Cb) | -184,6 | ||||||||
| =CimF–(C) | -238,59 | ||||||||
| =CimHBr | -12,56 | ||||||||
| =CimHCl | -27,21 | ||||||||
| =CimHF | -226,45 | ||||||||
| =CimHI | 92,09 | ||||||||
| =CimI–(Cb) | 133,95 | ||||||||
| =CimI–(C) | 79,95 | ||||||||
|
Азотсодержащие группы |
|||||||||
|
CH2(N3)–(C) |
267,89 | 195,48 | 64,46 | ||||||
|
=CH(N3) |
340,73 | 182,08 | 54,42 | ||||||
| N–(2C,B) | -41,57 | ||||||||
| N–(2C,Cb) | 109,67 | -64,88 | 2,6 | 8,46 | 13,69 | 17,29 | 21,89 | 23,4 | |
| N–(2C,CO) | 25,53 | -70,74 | 13,02 | 19,17 | 23,52 | 26,16 | 28,42 | 28,76 | |
| N–(2C,N) | 122,23 | -57,76 | |||||||
| N–(2C,PO) | 74,51 | ||||||||
| N–(2C,P) | 134,78 | ||||||||
|
N–(2C,SO2) |
-85,39 | 25,2 | 26,58 | 31,56 | 34,45 | 37,8 | 38,47 | ||
| N–(2C,SO) | 66,97 | 17,58 | 24,61 | 25,62 | 27,33 | 28,59 | 34,91 | ||
| N–(2C,S) | 125,16 | 15,99 | 21,64 | 25,99 | 29,05 | 30,93 | 38,68 | ||
| N–(2C,Ti) | 163,67 | ||||||||
| N–(2C,=C) | 102,13 | ||||||||
| N–(2C,=Nim) | 122,23 | ||||||||
| N–(3Cb) | 125,99 | ||||||||
| N–(3C) | 102,13 | -56,34 | 14,57 | 19,09 | 22,73 | 24,99 | 27,46 | 27,92 | 27,21 |
| N–(Cb,2СO) | -2,09 | -69,9 | 4,1 | 12,81 | 17,71 | 20,3 | 22,1 | 22,14 | |
| N–(C,2СO) | -24,7 | 63,62 | 4,48 | 12,99 | 18,04 | 20,93 | 22,94 | 27,08 | |
| N–(C,=С,N) | 124,74 | ||||||||
| Nb pyrid | 70,16 | 46,18 | 8,37 | 12,92 | 15,72 | 17,47 | 19,28 | 20,10 | 20,88 |
| NbO | 18,84 | ||||||||
|
NF2–(C) |
-32,65 | 26,5 | 34,58 | 40,9 | 45,63 | 50,9 | 53,54 | ||
| NH–(2Cb) | 68,23 | 18 | 9,04 | 13,06 | 17,29 | 21,35 | 28,3 | 32,98 | |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| NH–(2CO) | -77,44 | 31,81 | 15,03 | 23,19 | 28,05 | 30,93 | 33,28 | 34,28 | |
| NH–(2C) | 64,46 | 37,42 | 17,58 | 21,81 | 25,66 | 28,59 | 33,07 | 36,21 | 39,97 |
| NH–(Cb,CO) | 1,67 | -12,14 | 2,39 | 6,32 | 9,96 | 13,94 | 16,91 | 18,21 | |
| NH–(Cb,N) | 92,51 | 47,72 | |||||||
| NH–(C,Cb) | 62,37 | 28,46 | 15,99 | 20,47 | 23,9 | 26,29 | 30,1 | 32,36 | |
| NH–(C,CO) | -18,42 | 16,32 | 2,76 | 6,49 | 10,3 | 14,57 | 17,75 | 18,96 | |
| NH–(C,N) | 87,48 | 40,18 | 20,09 | 24,28 | 27,21 | 29,3 | 32,65 | 34,74 | 37,67 |
| NH–(C,=C) | 64,46 | ||||||||
| NH–(C,=Nim) | 87,9 | ||||||||
| NH–(=C,N) | 90 | ||||||||
|
NH2–(Cb) |
20,09 | 124,36 | 23,94 | 27,25 | 30,64 | 33,78 | 39,39 | 43,83 | 51,4 |
|
NH2–(CO) |
-62,37 | 103,35 | 17,04 | 24,03 | 29,85 | 34,7 | 41,69 | 46,97 | |
|
NH2–(C) |
20,09 | 124,36 | 23,94 | 27,25 | 30,64 | 33,78 | 39,39 | 43,83 | 51,4 |
|
NH2–(N) |
47,72 | 121,81 | 25,53 | 30,98 | 35,16 | 38,93 | 43,95 | 48,14 | 55,25 |
|
NH2–(=C) |
20,09 | ||||||||
|
NH2–(=Nim) |
47,72 | ||||||||
|
N(NO2)–(2C) |
50,23 | ||||||||
| =Naz–(Cb) | 132,69 | ||||||||
| =Naz–(C) | 113,02 | 35,58 | 11,3 | 17,16 | 20,59 | 22,35 | 23,82 | 23,9 | |
| =Naz–(N) | 96,27 | 35,58 | 8,87 | 17,5 | 23,06 | 28,34 | 28,71 | 29,51 | |
| =NazH | 105,06 | 112,18 | 18,33 | 20,47 | 22,77 | 24,86 | 28,34 | 31,06 | 35,33 |
| =Nim–(Cb) | 65,3 | 25,12 | 12,56 | ||||||
| =Nim–(C) | 89,16 | 24,7 | 10,38 | 13,98 | 16,53 | 17,96 | 19,21 | 19,25 | |
| =Nim–(N) | 104,23 | ||||||||
| =NimH | 50,23 | 51,49 | 12,35 | 19,17 | 27 | 32,27 | 38,22 | 41,52 | |
|
Серосодержащие группы |
|||||||||
| S–(2Cb) | 108,41 | -113,02 | 8,37 | 8,41 | 9,38 | 11,47 | 15,91 | 19,72 | |
| S–(2C) | 48,18 | 55,04 | 20,89 | 20,76 | 21,01 | 21,22 | 22,65 | 23,98 | |
| S–(2O) | 37,67 | ||||||||
| S–(2S) | 13,39 | 56,09 | 19,67 | 20,93 | 21,35 | 21,77 | 22,19 | 22,6 | |
| S–(2=C) | -19 | 68,98 | 20,05 | 23,36 | 23,15 | 26,33 | 33,24 | 40,73 | |
| S–(Cb,B) | -32,65 | ||||||||
| S–(Cb,S) | 60,69 | -33,49 | 12,1 | 14,19 | 15,57 | 17,37 | 20,01 | 21,35 | |
| S–(C,B) | -60,69 | ||||||||
| S–(C,Cb) | 80,2 | -32,65 | 12,64 | 14,19 | 15,53 | 16,91 | 19,34 | 20,93 | |
| S–(C,S) | 29,51 | 51,78 | 21,89 | 22,69 | 23,06 | 23,06 | 22,52 | 21,43 | |
| S–(C,=C) | 41,73 | 55,25 | 17,66 | 21,26 | 23,27 | 24,15 | 24,57 | 24,57 | |
| S–(N,S) | -20,51 | ||||||||
| SH–(Cb) | 50,06 | 52,99 | 21,43 | 22,02 | 23,32 | 25,24 | 29,26 | 32,82 | |
| SH–(CO) | -5,9 | 130,6 | 31,94 | 33,86 | 33,99 | 34,2 | 35,58 | 34,49 | |
| SH–(C) | 19,34 | 137 | 24,53 | 25,95 | 27,25 | 28,38 | 30,56 | 32,27 | |
| SH–(=C) | 25,53 | ||||||||
| SO–(2Cb) | -66,97 | -99,2 | 23,94 | 38,05 | 40,6 | 47,93 | 47,97 | 47,09 | |
| SO–(2C) | -66,97 | 75,76 | 37,17 | 41,98 | 43,95 | 45,17 | 45,96 | 46,76 | |
| SO–(2N) | -132,11 | ||||||||
| SO–(2O) | -213,48 | ||||||||
| SO–(C,Cb) | -72,04 | -12,56 | |||||||
|
SO2–(2Cb) |
-296,44 | -72,42 | 34,99 | 46,17 | 56,72 | 62,54 | 66,39 | 66,81 | |
|
SO2–(2C) |
-288,82 | 87,48 | 48,22 | 50,1 | 55,88 | 59,77 | 64,38 | 66,47 | |
|
SO2–(2N) |
-132,11 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
SO2–(2O) |
-417,5 | ||||||||
|
SO2–(2=С) |
-308,08 | 56,51 | 48,22 | 50,1 | 55,88 | 59,77 | 64,38 | 66,47 | |
|
SO2–(Сb,SO2) |
-325,32 | -13,39 | 41,06 | 48,14 | 56,59 | 61,66 | 65,76 | 67,1 | |
|
SO2–(Сb,=C) |
-296,44 | -26,37 | 41,4 | 48,14 | 55,88 | 61,16 | 65,8 | 66,64 | |
|
SO2–(С,Cb) |
-289,24 | 5,86 | 41,61 | 48,14 | 56,3 | 60,74 | 65,38 | 66,64 | |
|
SO2–(С,=C) |
-316,95 | 75,76 | |||||||
|
SO3–(2С) |
-396,82 | 126,83 | |||||||
|
SO4–(2С) |
-602,34 | 138,55 | |||||||
| S(CN)–(Сb) | 196,74 | 138,55 | 39,77 | ||||||
| S(CN)–(С) | 175,81 | 181,67 | 46,88 | ||||||
| S(CN)–(=С) | 198,83 | 196,74 | 59,44 | ||||||
|
(SO2Cl)–(O) |
-406,03 | ||||||||
|
(SO2F)–(O) |
-594,39 | ||||||||
|
Фосфорсодержащие группы |
|||||||||
| P–(3Сb) | 118,46 | ||||||||
| P–(3С) | 29,3 | ||||||||
| P–(3N) | -279,61 | ||||||||
| P–(3O) | -279,61 | ||||||||
|
PCl2–(C) |
-209,71 | ||||||||
| PO–(3Cb) | -221,43 | ||||||||
| PO–(3C) | -304,73 | ||||||||
| PO–(3N) | -437,84 | ||||||||
| PO–(3O) | -437,84 | ||||||||
| PO–(C,2O) | -416,49 | ||||||||
|
P=N–(2Cb, N=P, P=N) |
-95,86 | ||||||||
|
P=N–(2C, N=P, P=N) |
-64,88 | ||||||||
|
P=N–(2O, N=P, P=N) |
-181,67 | ||||||||
| P=N–(C,3Cb) | -107,58 | ||||||||
| P=N–(C,3C) | 2,09 | ||||||||
| (PO)Cl–(C,O) | -471,33 | ||||||||
|
(PO)Cl2–(C) |
-514,86 | 221,72 | |||||||
| (PO)F–(2O) | -701,97 | ||||||||
|
(P=N)Cl2–(N=P,P=N) |
-243,62 | ||||||||
|
Группы, содержащие атомы бора и кремния |
|||||||||
| B–(2C,O) | 122,65 | ||||||||
| B–(3C) | 3,73 | ||||||||
| B–(3N) | 102,13 | ||||||||
| B–(3O) | 102,13 | ||||||||
| B–(3S) | 102,13 | ||||||||
| B–(B,2O) | -376,56 | ||||||||
| B–(C,N,O) | -43,95 | ||||||||
| BBr–(2Cb) | -239,64 | ||||||||
| BBr–(2C) | -112,6 | ||||||||
|
BBr2–(Cb) |
-244,45 | ||||||||
| BCl–(2C) | -178,74 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| BCl–(2N) | -83,05 | ||||||||
| BCl–(2O) | -82,46 | ||||||||
|
BCl2–(Cb) |
-381,25 | ||||||||
|
BCl2–(N) |
-284,22 | ||||||||
|
BCl2–(O) |
-256,17 | ||||||||
|
BF2–(C) |
-786,52 | ||||||||
| B–(2C,O) | 122,65 | ||||||||
| B–(3C) | 3,73 | ||||||||
| B–(3N) | 102,13 | ||||||||
| B–(3O) | 102,13 | ||||||||
| B–(3S) | 102,13 | ||||||||
| B–(B,2O) | -376,56 | ||||||||
| B–(C,N,O) | -43,95 | ||||||||
| BBr–(2Cb) | -239,64 | ||||||||
| BBr–(2C) | -112,6 | ||||||||
|
BBr2–(Cb) |
-244,45 | ||||||||
| BCl–(2C) | -178,74 | ||||||||
| BCl–(2N) | -83,05 | ||||||||
| BCl–(2O) | -82,46 | ||||||||
|
BCl2–(Cb) |
-381,25 | ||||||||
|
BCl2–(N) |
-284,22 | ||||||||
|
BCl2–(O) |
-256,17 | ||||||||
|
BF2–(C) |
-786,52 | ||||||||
|
BF2–(=C) |
-807,45 | ||||||||
| BH–(2O) | 83,3 | ||||||||
| BI–(2C) | -37,25 | ||||||||
|
BO3–(3C) |
-873,59 | ||||||||
| Si–(2C,2Si) | -19,88 | ||||||||
| Si–(3C,Si) | -55,04 | ||||||||
| Si–(4Cb) | -608,2 | ||||||||
| Si–(4C) | -64,46 | 184,51 | 113,23 | 134,95 | 154,5 | 171,2 | 198,62 | 219,72 | 252,91 |
| SiBr–(3C) | -251,15 | ||||||||
| SiCl–(3C) | -227,38 | ||||||||
|
SiCl2–(2C) |
-364,13 | ||||||||
|
SiCl3–(C) |
-529,85 | ||||||||
| SiH–(3C) | -59,36 | ||||||||
|
SiH2–(2C) |
-88,15 | ||||||||
|
SiH3–(C) |
-8,37 | 129,13 | -39,64 | ||||||
| SiHCl–(2C) | 208,33 | ||||||||
|
SiHCl2–(C) |
-359,98 | ||||||||
|
Металлсодержащие группы |
|||||||||
| Al–(3C) | 38,51 | ||||||||
| AlH–(2C) | -2,76 | ||||||||
| Cd–(2C) | 194,22 | ||||||||
| Cr–(4O) | -267,89 | ||||||||
| Ge–(3Cb,Ge) | 124,24 | ||||||||
| Ge–(3C,Ge) | 26,41 | ||||||||
| Ge–(4Cb) | 86,4 | ||||||||
| Ge–(4C) | 98,03 | ||||||||
| Hg–(2Cb) | 269,57 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| Hg–(2C) | 177,9 | ||||||||
| HgBr–(Cb) | 75,76 | ||||||||
| HgBr–(C) | 20,43 | ||||||||
| HgCl–(Cb) | 41,44 | ||||||||
| HgCl–(C) | -11,8 | ||||||||
| HgI–(Cb) | 116,79 | ||||||||
| HgI–(C) | 66,05 | ||||||||
| Pb–(4Cb) | 341,57 | ||||||||
| Pb–(4C) | 305,15 | ||||||||
| Sn–(3Cb,Sn) | 147,3 | ||||||||
| Sn–(3C,Cb) | 146,21 | ||||||||
| Sn–(3C,Sn) | 110,51 | ||||||||
| Sn–(3C,=C) | 157,39 | ||||||||
| Sn–(4Cb) | 109,92 | ||||||||
| Sn–(4C) | 151,53 | ||||||||
| Sn–(4=C) | 151,53 | ||||||||
| SnBr–(3C) | -7,53 | ||||||||
| SnCl–(3C) | -41,02 | ||||||||
| SnCl–(3=C) | -34,32 | ||||||||
|
SnCl2–(2C) |
-205,94 | ||||||||
|
SnCl2–(2=C) |
-212,22 | ||||||||
|
SnCl3–(C) |
-374,63 | ||||||||
|
SnCl3–(=C) |
-344,08 | ||||||||
| SnH–(3C) | 145,67 | ||||||||
| SnI–(3C) | 41,44 | ||||||||
| Ti–(4N) | -514,86 | ||||||||
| Ti–(4O) | -657,18 | ||||||||
| V–(4O) | -364,17 | ||||||||
| Z–(2C) | 139,39 | ||||||||
|
Поправки для 3- и 4-членных циклов |
|||||||||
|
Азетидиновый цикл |
109,67 | 122,65 | |||||||
|
b-Пропиолак- тоновый цикл |
100,04 | 116,79 | |||||||
|
Циклобутано- вый фрагмент |
109,67 | 124,74 | -19,3 | -16,28 | -13,14 | -11,05 | -7,87 | -5,78 | -2,8 |
| Циклобутано-новое кольцо | 94,6 | -116,74 | |||||||
| Циклобутено-вое кольцо | 124,74 | 121,39 | -10,59 | -9,17 | -7,91 | -7,03 | -6,2 | -5,57 | -5,11 |
| Циклопропа-новое кольцо | 115,53 | 134,37 | -12,77 | -10,59 | -8,79 | -7,95 | -7,41 | -6,78 | -6,36 |
| Циклопропено-вое кольцо | 224,78 | 140,64 | |||||||
|
Дикетеновый цикл |
92,09 | ||||||||
|
Диметилсила- циклобутано-вый цикл |
-53,62 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| Этиленоксид-ный цикл | 112,18 | 127,67 | -8,37 | -11,72 | -12,56 | -10,88 | -9,63 | -8,63 | |
| Этиленсуль-фидный цикл | 74,09 | 123,36 | -11,93 | -10,84 | -11,13 | -12,64 | 18,09 | 24,36 | |
| Этиленимин-ный цикл | 115,95 | 132,27 | |||||||
| Малоновый ангидрид (цикл) | 92,09 | 116,79 | |||||||
| Метиленцик-лобутановый цикл | 109,67 | ||||||||
| Метиленцикло-пропановый цикл | 171,2 | ||||||||
| Тиаэтановый цикл | 81,08 | 113,77 | -19,21 | -17,5 | -16,37 | -16,37 | -19,25 | -23,86 | |
|
Триметилен- оксидный цикл |
107,58 | 115,95 | -19,25 | -20,93 | -17,58 | -14,65 | -10,88 | 0,84 | |
|
Поправки для 5- и 6-членных циклов |
|||||||||
| 1,2-Дигидро-тиофен-1,1-диоксидный цикл | 24,03 | 85,81 | |||||||
| 1,3-Цикло-гексадиено-вый фрагмент | 20,09 | 100,46 | |||||||
| 1,3-Диоксано-вый цикл | 0,84 | 66,14 | |||||||
| 1,3-Диоксола-новый цикл | 25,12 | 92,09 | |||||||
| 1,3,5-Триокса-новый цикл | 27,63 | 53,58 | |||||||
| 1,4-Циклогек-садиеновый фрагмент | 2,09 | 106,32 | |||||||
| 1,4-Диоксано-вый цикл | 13,81 | 69,28 | -19,21 | -20,8 | -15,91 | -10,97 | -6,4 | -1,8 | |
|
2-Тиоленовый цикл |
20,93 | 106,32 | |||||||
|
3-Тиоленовый цикл |
20,93 | 106,32 | |||||||
| Циклогексано-вое кольцо | 78,69 | -24,28 | -17,16 | -12,14 | -5,44 | 4,6 | 9,21 | 13,81 | |
| Циклогексано-новый фраг-мент | 9,21 | 66,56 | |||||||
| Циклогексено-вый фрагмент | 5,86 | 82,88 | -17,92 | -12,72 | -8,29 | -5,99 | -1,21 | 0,33 | 3,39 |
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
Циклопента- диеновый фрагмент |
25,12 | 117,2 | -14,44 | -11,85 | -8,96 | -6,91 | -5,36 | -4,35 | |
| Циклопента-новый фраг-мент | 26,37 | 114,27 | -27,21 | -23,02 | -18,84 | -15,91 | -11,72 | -8,08 | -1,55 |
|
Циклопента- ноновый фрагмент |
21,77 | 102,97 | |||||||
| Циклопенте-новый фраг-мент | 24,7 | 107,99 | -25,03 | -22,39 | -20,47 | -17,33 | -12,26 | -9,46 | -4,52 |
| Дигидрофура-новый цикл | 19,67 | 92,09 | |||||||
| Дигидропира-новый цикл | 5,02 | 84,55 | |||||||
|
Диметилсила- Циклопента-новый цикл |
11,59 | ||||||||
| Фурановый цикл | 37,25 | 110,51 | -20,51 | -18 | -15,07 | -12,56 | -10,88 | -10,05 | |
| Глутаровый ангидрид (цикл) | 3,35 | 84,14 | |||||||
| Малеиновый ангидрид (цикл) | 15,07 | 114,69 | |||||||
| Пиперидино-вый цикл | 5,86 | 77,86 | -24,7 | -19,67 | -12,14 | -3,77 | 9,21 | 17,58 | |
| Пирролидино-вый цикл | 28,46 | 111,76 | -25,83 | -23,36 | -20,09 | -16,74 | -12,01 | -9,08 | |
| Сукциновый ангидрид (цикл) | 18,84 | 126,41 | |||||||
| Сукцинимид-ный цикл | 33,49 | ||||||||
| Тетрагидрофу-рановый цикл | 24,7 | 105,9 | -25,12 | -24,28 | -20,09 | -15,91 | -11,3 | -7,53 | |
| Тетрагидропи-рановый цикл | 2,09 | 78,69 | |||||||
| Тиоциклогек-сановый цикл | 73,08 | -26,04 | -17,83 | -9,38 | -2,89 | 3,6 | 5,4 | ||
| Тиолановый цикл | 7,24 | 98,62 | -20,51 | -19,55 | -15,4 | -15,32 | -18,46 | -23,32 | |
| Тиофеновый цикл | 7,12 | 98,62 | -20,51 | -19,55 | -15,4 | -15,32 | -18,46 | -23,32 | |
|
Поправки для 7-17-членных циклов |
|||||||||
| 1,3-Циклогеп-тадиеновый фрагмент | 27,63 | 81,21 | |||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
| 1,3,5-Цикло-гептатриено-вый фрагмент | 19,67 | 99,2 | |||||||
| 1,3,5-Цикло-октатриено-вый фрагмент | 37,25 | 88,32 | |||||||
|
цис-Цикло- ноненовый фрагмент |
41,44 | 46,88 | |||||||
|
цис-Цикло- октеновый фрагмент |
25,12 | 50,23 | |||||||
| Циклодекано-вый фрагмент | 52,74 | ||||||||
| Циклодекано-новый фрагм. | 15,07 | 49,81 | |||||||
| Циклододека-новый фрагм. | 18,42 | ||||||||
| Циклододека-ноновый фрагмент | 12,56 | 28,05 | |||||||
| Циклогепта-деканоновый фрагмент | 4,6 | -10,5 | |||||||
| Циклогепта-новый фрагм. | 26,79 | 66,56 | -38,01 | ||||||
| Циклогепта-ноновый фрагмент | 9,63 | 72 | |||||||
| Циклогепте-новый фрагм. | 0 | 65,3 | |||||||
| Циклононано-вый фрагмент | 53,58 | 51,07 | |||||||
| Циклононано-новый фрагм. | 19,67 | 58,18 | |||||||
| Циклооктано-вый фрагмент | 41,44 | 51,49 | -44,16 | ||||||
| Циклооктано-новый фрагм. | 6,28 | 64,46 | |||||||
| Циклооктатет-раеновый фрагмент | 71,58 | 115,53 | |||||||
| Циклопента-деканоновый фрагмент | 8,79 | 7,95 | |||||||
| Циклоундека-ноновый фрагмент | 18,42 | 39,77 | |||||||
| Тиациклогеп-тановый цикл | 16,28 | 72,42 | |||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
транс-Цикло-ноненовый фрагмент |
53,58 | 46,88 | |||||||
|
транс-Цикло-октеновый фрагмент |
44,79 | 62,79 | |||||||
|
Поправки для полициклических структур |
|||||||||
| 1,3-Бензо-диоксоловый цикл | 69,49 | ||||||||
| 1,4-Бензо-диоксоловый цикл | 8,37 | 66,14 | |||||||
|
1,4-Диазаби-цикло[2.2.2]- октановый цикл |
14,23 | ||||||||
| Цикл диангидрида 1,2,4,5-бензол-тетракарбоновой кислоты | 88,32 | 226,04 | |||||||
|
Бицикло[1.1.0] бутановый фрагмент |
238,59 | 289,66 | |||||||
|
Бицикло[2.1.0] пентановый фрагмент |
231,48 | 270,82 | |||||||
|
Бицикло[2.2.1] гептановый фрагмент |
67,48 | ||||||||
|
Бицикло[3.1.0] гексановый фрагмент |
136,88 | 254,92 | |||||||
|
Бицикло[4.1.0] гептановый фрагмент |
121,01 | 232,31 | |||||||
|
Бицикло[5.1.0] октановый фрагмент |
123,9 | 211,8 | |||||||
|
Бицикло[6.1.0] нонановый фрагмент |
130,18 | 205,94 | |||||||
| Бицикло-[2.2.1]-гепта-2,5-диеновый фрагмент | 132,27 | ||||||||
| Бифенильный цикл | 246,13 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
Цикл цис-бицикло[3.3.0]-октан-2-она |
22,6 | 226,04 | |||||||
|
Цикл цис-декагидронаф-талин-2-она |
64,04 | ||||||||
|
цис-Октагид-ро-1Н-индено-вый цикл |
34,32 | ||||||||
| Дибензофура-новый цикл | 17,58 | 117,2 | |||||||
| Додекагидро-дибензофурановый цикл | 47,72 | ||||||||
| Фталевый ангидрид (цикл) | 43,11 | 114,69 | |||||||
| Спиропента-новый цикл | 265,8 | 282,96 | |||||||
|
Цикл транс-бицикло[3.3.0]-октан-2-она |
46,04 | 226,04 | |||||||
|
Цикл транс-декагидронаф-талин-2-она |
87,48 | ||||||||
|
транс-Окта-гидро-1Н-инденовый цикл |
30,14 | ||||||||
| Ксантеновый цикл | 5,02 | 92,09 | |||||||
|
Поправки на гош- и 1,5-отталкивающие взаимодействия |
|||||||||
| 1,5-Н-оттал-кивание (на-полненность метилами) | 6,28 | ||||||||
| Дитретичные эфиры | 32,65 | ||||||||
|
Гош – через С-В-связь |
3,35 | ||||||||
|
Гош – через кислород простого эфира |
2,09 | ||||||||
| Гош – группа, присоединенная к О” прос-того эфира | 1,26 | ||||||||
|
Гош – (алкан/ алкан) |
3,35 | ||||||||
Продолжение табл. 1.2
| Группа |
кДж/моль |
|
|
|||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | ||||
|
Гош – (алкен/ негалоген) |
2,09 | |||||||||
|
Гош – (алкил/ CN-группа) |
0,42 | |||||||||
|
Гош – (алкил/ NO2) |
||||||||||
|
Гош – (алкил/ ONO) |
3,35 | |||||||||
| Гош – (галоген /галоген) | 10,46 | |||||||||
|
Гош – (NO2/NO2) |
27,63 | |||||||||
|
Гош – (винил /СN-группа) |
-15,49 | |||||||||
|
Поправки на цис- и взаимодействия |
||||||||||
|
Второй цис – через 1 двой-ную связь |
8,37 | |||||||||
|
Бут-2-еновый фрагмент С–С=С–С |
5,02 | -5,61 | -4,56 | -3,39 | -2,55 | -1,63 | -1,09 | |||
|
Бут-3-еновый фрагмент С–С–С=С |
-2,51 | -5,61 | -4,56 | -3,39 | -2,55 | -1,63 | -1,09 | |||
|
цис- между двумя трет-бутильными группами |
41,86 | -5,61 | -4,56 | -3,39 | -2,55 | -1,63 | -1,09 | |||
|
цис- галоген / (алкан, алкен) |
-3,35 | -4,06 | -2,93 | -2,22 | -1,97 | -1,00 | -0,54 | |||
|
цис- содер-жащий 1 трет-бутильную группу |
16,72 | -5,61 | -4,56 | -3,39 | -2,55 | -1,63 | -1,09 | |||
|
цис- (алкил/ CN-группа) |
-14,65 | -11,72 | ||||||||
|
цис- (CN-груп-па/CN-группа) |
20,93 | |||||||||
|
цис- (галоген/ галоген) |
-1,26 | -0,79 | -0,04 | -0,13 | -0,71 | 0,00 | -0,13 | |||
|
цис- не с трет-бутильным фрагментом |
4,19 | -5,61 | -4,56 | -3,39 | -2,55 | -1,63 | -1,09 | |||
| Несколько азогрупп =Naz, соединенных с ароматичес-ким азотом Nb (резонанс) | -25,12 | |||||||||
Окончание табл. 1.2
| Группа |
кДж/моль |
|
|
||||||
| 298 | 400 | 500 | 600 | 800 | 1000 | 1500 | |||
|
орто – между атомами Cl |
9,21 | -9,63 | -2,09 | 5,02 | 2,09 | -2,51 | -1,26 | ||
|
орто – между атомами F |
18 | -5,86 | |||||||
|
орто – между NH2 и NO2 |
-5,02 | ||||||||
|
орто – в пири-диновом коль-це (Nb-CH3) |
-7,20 | ||||||||
|
орто – (алкан, алкен / NO2) |
18,84 | ||||||||
|
орто – (алкан, алкен)/(Br,Cl,I) |
2,51 | ||||||||
|
Другие орто (неполярный / неполярный) |
3,14 | -6,74 | 4,69 | 5,65 | 5,44 | 4,9 | 3,68 | 2,76 | -0,21 |
|
Другие орто (неполярный / полярный) |
1,42 | ||||||||
|
Другие орто – (полярный / полярный) |
10,05 | ||||||||
|
пара – в пири-диновом коль-це(Nb-CH3) |
-3,24 | ||||||||
|
Элементы |
|||||||||
| Al | 0 | 28 | 24 | 26 | 27 | 28 | 31 | 32* | 32 |
| B | 0 | 6 | 11 | 15 | 19 | 21 | 23 | 25 | 28 |
|
Br2 |
0 | 152 | 76 | 37* | 37 | 37 | 38 | 38 | 38 |
| C | 0 | 6 | 9 | 12 | 15 | 17 | 20 | 22 | 24 |
| Cd | 0 | 52 | 26 | 27 | 28 | 30* | 30 | 30 | 21* |
|
Cl2 |
0 | 223 | 34 | 35 | 36 | 37 | 37 | 37 | 38 |
|
F2 |
0 | 203 | 31 | 33 | 34 | 35 | 36 | 37 | 38 |
| Ge | 0 | 31 | 23 | 24 | 25 | 25 | 26 | 27 | 28* |
|
H2 |
0 | 130 | 29 | 29 | 29 | 29 | 30 | 30 | 32 |
| Hg | 0 | 76 | 28 | 27 | 27 | 27 | 21* | 21 | 21 |
|
I2 |
0 | 116 | 54 | 81* | 37* | 38 | 38 | 38 | 38 |
|
N2 |
0 | 191 | 29 | 29 | 30 | 30 | 31 | 33 | 35 |
|
O2 |
0 | 205 | 29 | 30 | 31 | 32 | 34 | 35 | 37 |
| Pb | 0 | 65 | 27 | 27 | 28 | 29 | 30* | 29 | 29 |
| S | 0 | 32 | 23 | 32* | 38 | 34 | 18* | 19* | 19 |
| Si | 0 | 19 | 20 | 22 | 23 | 24 | 26 | 27 | 28 |
| Sn | 0 | 51 | 27 | 29 | 31 | 29* | 28 | 28 | 28 |
| Ti | 0 | 31 | 25 | 26 | 27 | 28 | 30 | 32 | 33* |
| V | 0 | 29 | 25 | 26 | 27 | 27 | 29 | 31 | 36 |
| Zn | 0 | 42 | 25 | 26 | 27 | 28 | 31* | 31 | 21* |
* Означает, что фазовый переход (плавление, испарение, кристаллизация) лежит между указанной температурой (Т) и предыдущей более низкой температурой.
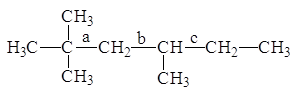
2. Расчет энтальпии образования приведен в табл. 1.3.
Таблица 1.3
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
|
CH3–(C) |
5 | -42,19 | -210,95 |
|
CH2–(2C) |
2 | -20,64 | -41,28 |
|
CH–(3C) |
1 | -7,95 | -7,95 |
|
C–(4C) |
1 | 2,09 | 2,09 |
| Аддитивная составляющая свойства | 9 | -258,09 | |
|
Поправки на гош-взаимодействие |
4 | 3,35 | 13,40 |
|
|
-244,69 |
3. Расчет поправки на гош-взаимодействие.
В молекуле 2,2,4-триметилгексана три неконцевых углерод-углеродных связи:
а) все три проекции Ньюмена для молекулы 2,2,4-триметилгексана, вращающейся по связи “а”, эквивалентны и имеют 2 значимых гош-взаимодействия;
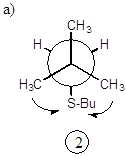
б) при вращении по связи “b” имеем для двух конформеров по 1 значимому гош-взаимодействию и для одного конформера - 2 взаимодействия. В расчет суммарной поправки принимается 1 гош-взаимодействие;
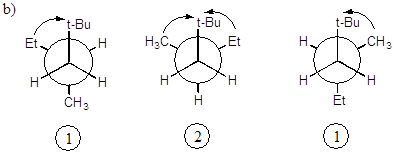
в) при вращении по связи “с” также имеем для двух конформеров по 1 значимому гош-взаимодействию и для одного конформера - 2 взаимодействия. В расчет суммарной поправки принимается 1 гош-взаимодействие.
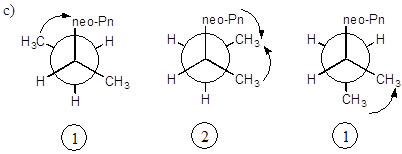
Таким образом, суммарная поправка на гош-взаимодействие
![]() для 2,2,4-триметилгексана
составляет
для 2,2,4-триметилгексана
составляет ![]() = (2+1+1)×3,35 = 13,4 кДж/моль.
= (2+1+1)×3,35 = 13,4 кДж/моль.
4. Значение энтальпии образования 2,2,4-триметилгексана равно сумме аддитивной составляющей свойства и поправки на гош-взаимодействие:
![]() = –258,09+13,4 = –244,69 кДж/моль.
= –258,09+13,4 = –244,69 кДж/моль.
В справочнике [1] рекомендована величина ![]() = –243,2 кДж/моль, т.е. относительная
погрешность прогнозирования составляет
= –243,2 кДж/моль, т.е. относительная
погрешность прогнозирования составляет
(–243,2+244,69)·100/( –243,2) = – 0,6 %.
Выполненный нами анализ возможностей метода Бенсона
для прогнозирования ![]() алканов показал
следующее. Для линейных алканов средняя абсолютная погрешность расчета
составляет 0,14 кДж/моль, т.е. находится на уровне погрешности современного
калориметрического эксперимента. Для большинства разветвленных структур
погрешность расчета существенно выше и достигает 3-4 кДж/моль даже при относительно
невысокой степени разветвления молекул. Для алканов, имеющих значительные напряжения
в молекуле, например, в случае нескольких последовательно расположенных
четвертичных и (или) третичных углеродных атомов или нескольких четвертичных атомов
углерода, разделенных двумя связями, погрешность расчета может достигать 10 и
более кДж/моль. Это обстоятельство необходимо учитывать, особенно в тех случаях,
когда расчетные данные предполагается использовать не только при термохимических,
но и при более строгих термодинамических расчетах.
алканов показал
следующее. Для линейных алканов средняя абсолютная погрешность расчета
составляет 0,14 кДж/моль, т.е. находится на уровне погрешности современного
калориметрического эксперимента. Для большинства разветвленных структур
погрешность расчета существенно выше и достигает 3-4 кДж/моль даже при относительно
невысокой степени разветвления молекул. Для алканов, имеющих значительные напряжения
в молекуле, например, в случае нескольких последовательно расположенных
четвертичных и (или) третичных углеродных атомов или нескольких четвертичных атомов
углерода, разделенных двумя связями, погрешность расчета может достигать 10 и
более кДж/моль. Это обстоятельство необходимо учитывать, особенно в тех случаях,
когда расчетные данные предполагается использовать не только при термохимических,
но и при более строгих термодинамических расчетах.
Очевидно, что для соединений других классов, молекулы которых имеют значительные напряжения вследствие разветвленности алкильных фрагментов, погрешность прогнозирования будет столь же значительной, как и для алканов с близким строением молекул.
Циклоалканы
Прогнозирование ![]() циклоалканов
состоит в вычислении аддитивной составляющей энтальпии образования и
введении следующих поправок:
циклоалканов
состоит в вычислении аддитивной составляющей энтальпии образования и
введении следующих поправок:
· на напряжение циклов, присутствующих в молекуле рассматриваемого вещества;
· на гош-взаимодействия для алифатической части молекулы, которая производится аналогично рассмотренному выше подходу.
Как указывалось выше, аддитивная составляющая свойства
формируется на тех же четырех константах для первичного, вторичного, третичного
и четвертичного атомов углерода, что и в случае алканов. Количество парциальных
вкладов в свойство равно числу атомов углерода в молекуле. Расчет аддитивной
составляющей ![]() производится аналогично
тому, что изложен в примере 1.1.
производится аналогично
тому, что изложен в примере 1.1.
Подход к расчету иллюстрируется примерами, приведенными в табл. 1.4.
Таблица 1.4
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
| транс-1,4-Диметилциклогексан | |||
|
CH3–(C) |
2 | -42,19 | -84,19 |
|
CH2–(2C) |
4 | -20,64 | -82,56 |
|
CH–(3C) |
2 | -7,95 | -15,90 |
| Аддитивная составляющая свойства | 8 | -182,84 | |
|
|
-182,84 | ||
| Бицикло[2.2.1]гептан | |||
|
CH2–(2C) |
5 | -20,64 | -103,20 |
|
CH–(3C) |
2 | -7,95 | -15,90 |
| Аддитивная составляющая свойства | 7 | -119,10 | |
| Поправки на напряжение цикла | 1 | 67,48 | 67,48 |
|
|
-51,62 | ||
Поправки на напряжение циклов приведены в табл. 1.2 (подразделы “Поправки на 3,4-, 5,6-, 7-17-членные циклы и полициклические соединения”). Количество поправок для циклических структур в последней редакции метода Бенсона расширено по сравнению с предыдущими версиями [6, 7], однако не охватывает все возможные ситуации. Полагаем, что структуры, приведенные в табл. 1.2, должны стимулировать пользователя к самостоятельному поиску способов оценки значений поправок для интересующих циклических соединений. При этом наряду с экспериментальными данными во многих случаях для циклических структур могут достаточно эффективно использоваться методы молекулярной механики.
При расчете поправок на гош-взаимодействие учитываются все неконцевые связи алкильных заместителей, в том числе и -углерод-углеродные связи, т.е. связи между циклом и алкильным, но не метильным заместителем.
АлкеныПрогнозирование ![]() алкенов
состоит в вычислении аддитивной составляющей энтальпии образования и
введении поправок:
алкенов
состоит в вычислении аддитивной составляющей энтальпии образования и
введении поправок:
· на цис-взаимодействия заместителей (табл. 1.2, подраздел “Поправки цис-, орто/пара взаимодействия”), если таковые имеются в молекуле;
· на гош-взаимодействие для насыщенной части молекулы; расчет производится аналогично рассмотренному выше подходу;
· на гош-взаимодействие алкенильного фрагмента с рядом расположенными группами (табл. 1.2, подраздел “Поправки на гош- и 1,5-отталкивающие взаимодействия”).
При расчете аддитивной составляющей алкенов для атомов углерода при двойной связи приняты символы: =СH2, =СН–(С) и =С–(2С). Эти атомы имеют за пределами двойной связи в первом окружении только два атома: водорода и (или) углерода.
Суммарное количество парциальных вкладов в свойство равно числу углеродных атомов в молекуле.
Например, для 2-пентена будем иметь: 1 группу CH3–(=С), 2 группы =СH–(C), 1 группу CH2–(C,=С) и 1 группу CH3–(C).
При расчете поправок на гош-взаимодействие для насыщенной части молекулы учитываются все неконцевые углерод-углеродные связи, начиная с связи. При рассмотрении связи величина поправки, равная 3,35 кДж/моль, применяется только для гош-взаимодействий типа “алкан-алкан”. Для гош-взаимодейстий типа “алкен-алкан” используется поправка, равная 2,09 кДж/моль (в табл. 1.2 она отнесена к категории “алкен-негалоген”).
Расчет иллюстрируется примерами, приведенными в табл. 1.5.
Таблица 1.5
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
| Бицикло[2.2.1]гепт-2-ен | |||
|
CH2–(2C) |
3 | -20,64 | -61,92 |
|
CH–(3С) |
2 | -7,95 | -15,90 |
|
=СН–(С) |
2 | 35,96 | 71,92 |
| Аддитивная составляющая свойства | 7 | -5,90 | |
| Поправки на напряжение циклов | 1 |
(67,48+132,27)/2 = 99,88 |
99,88 |
|
|
93,97 | ||
| Бицикло[2.2.1]гепта-2,5-диен | |||
|
CH2–(2C) |
1 | -20,64 | -20,64 |
|
CH–(3С) |
2 | -7,95 | -15,90 |
|
=СН–(С) |
4 | 35,96 | 143,84 |
Окончание табл. 1.5
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
| Аддитивная составляющая свойства | 7 | 107,30 | |
| Поправки на напряжение циклов | 1 | 132,27 | 132,27 |
|
|
239,57 |
Необходимо заметить, что значения цис-поправок существенно зависят от эффективных объемов взаимодействующих групп. Однако в табл. 1.2 приводятся только две цис-поправки для алкильных групп. Нам представляется вполне оправданным привлечение методов молекулярной механики для их оценки в ситуациях, не прописанных в табл. 1.2.
Ацетиленовые углеводороды
Прогнозирование ![]() ацетиленовых
углеводородов состоит в вычислении аддитивной составляющей энтальпии
образования и введении поправки на гош-взаимодействие для насыщенной
части молекулы. Алкинильный фрагмент молекулы является плоским и практически не
создает стерических затруднений при своем вращении, которые могли бы требовать
введения специальных поправок при расчете
ацетиленовых
углеводородов состоит в вычислении аддитивной составляющей энтальпии
образования и введении поправки на гош-взаимодействие для насыщенной
части молекулы. Алкинильный фрагмент молекулы является плоским и практически не
создает стерических затруднений при своем вращении, которые могли бы требовать
введения специальных поправок при расчете ![]() .
.
Расчет иллюстрируется примером, приведенным в табл. 1.6.
Таблица 1.6
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
| 1,3,5,7,9-Декапентаин | |||
|
Ct–(H) |
2 | 112,72 | 225,44 |
|
Ct–(Ct) |
8 | 123,78 | 990,24 |
| Аддитивная составляющая свойства | 10 | 1215,68 | |
|
|
1215,68 | ||
Для атомов углерода при тройной связи принят символ Ct при расчете аддитивной составляющей свойства. В первом окружении атома Ct за пределами тройной связи находится только один атом или одна группа (табл. 1.2, подраздел “Сt группы”).
Суммарное количество парциальных вкладов в свойство алкинов равно числу углеродных атомов в молекуле. Например, для 3-метил-1-пентина будем иметь: 1 группу Ct-(H), 1 группу Ct-(C), 1 группу CН-(2С,Ct), 1 группу CН2-(2C), 2 группы CН3-(C).
При расчете поправок на гош-взаимодействие для насыщенной части молекулы учитываются все неконцевые углерод-углеродные связи, начиная с связи.
Ароматические углеводороды
Прогнозирование ![]() ароматических
углеводородов состоит в вычислении аддитивной составляющей энтальпии
образования и введении поправок:
ароматических
углеводородов состоит в вычислении аддитивной составляющей энтальпии
образования и введении поправок:
· на взаимодействие заместителей, находящихся при соседних углеродных атомах в ароматическом ядре;
· на гош-взаимодействие для насыщенной части молекулы; расчет производится аналогично рассмотренному выше подходу.
Для ароматических атомов углерода используются две разновидности символов: Cb и Cp (табл. 1.1). Атом Cb единообразно связан тремя углерод-углеродными связями с соседними атомами ароматического ядра. Эта информация вынесена в символ, поэтому в первом окружении атома Cb указывается только одна группа, находящаяся за пределами ароматического ядра. Атом Cp, являющийся узловым в соединениях с конденсированными ароматическими ядрами, может иметь в ближайшем окружении три различных атома. Как минимум один из них также является узловым. Два других могут быть либо неузловыми ароматическими углеродными атомами (Cb), либо узловыми (Cp). Парциальные вклады в свойство для указанных комбинаций атомов различны, что отражено в табл. 1.2 (подраздел “Ароматические Сb и Сp группы”).
Суммарное количество парциальных вкладов в свойство
при расчете его аддитивной составляющей равно числу углеродных атомов в
молекуле. Например, аддитивная составляющая ![]() 1,3,5-триметилбензола
будет слагаться из парциальных вкладов типа Cb–(C)
- 3 шт., Cb–(H) - 3 шт., CH3–(Cb) -3 шт.
1,3,5-триметилбензола
будет слагаться из парциальных вкладов типа Cb–(C)
- 3 шт., Cb–(H) - 3 шт., CH3–(Cb) -3 шт.
При расчете поправок на гош-взаимодействие учитываются все неконцевые углерод-углеродные связи, начиная с связи. Взаимодействия типа “гош-алкил-фенил” или “гош-фенил-фенил считаются (в редакции [5]) незначимыми. Опыт нашей работы с алкилароматическими углеводородами показывает [25], что это является лишь некоторым приближением. Значения указанных эффектов чувствительны к наличию заместителей в положениях “2 фенильного фрагмента даже при относительно малом эффективном объеме этих заместителей.
Для поправок, учитывающих взаимодействие алкильных заместителей, находящихся при соседних углеродных атомах ароматического ядра, приводится в редакции [5], как и в [6, 7], всего одно значение (табл. 1.2, подраздел “Поправки цис-, орто/пара взаимодействия”), которое вычислено, на наш взгляд, на базе сведений только для метилбензолов. На основании исследования химического равновесия было показано, например в [25, 26], что значения указанных эффектов изменяются на порядок и более при переходе от метильных к третбутильным заместителям. По этой причине набор орто-поправок, определенных нами по экспериментальным данным и охватывающий достаточно широкий диапазон возможных комбинаций заместителей, представлен в табл. 1.11 раздела 1.1.2.
Особенности расчета ![]() ароматических
углеводородов иллюстрируются примерами, приведенными в табл. 1.7.
ароматических
углеводородов иллюстрируются примерами, приведенными в табл. 1.7.
Таблица 1.7
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
| 1,2-Дигидронафталин | |||
|
CH2–(С,Cb) |
1 | -20,34 | -20,34 |
|
CH2–(C,=C) |
1 | -19,92 | -19,92 |
|
=CH–(C) |
1 | 35,96 | 35,96 |
|
=CH–(Cb) |
1 | 28,38 | 28,38 |
|
Cb–(=C) |
1 | 23,78 | 23,78 |
|
Cb–(C) |
1 | 23,06 | 23,06 |
|
Cb-(H) |
4 | 13,81 | 55,24 |
| Аддитивная составляющая свойства | 10 | 126,16 | |
|
|
126,16 | ||
| 1,4-Дигидронафталин | |||
|
CH2–(Сb,=C) |
2 | -17,96 | -35,92 |
|
=CH–(C) |
2 | 35,96 | 71,92 |
|
Cb–(C) |
2 | 23,06 | 46,12 |
|
Cb-(H) |
4 | 13,81 | 55,24 |
| Аддитивная составляющая свойства | 10 | 137,36 | |
|
|
137,36 | ||
| Перилен | |||
|
Cp–(3Cp) |
2 | 6,28 | 12,56 |
|
Cp–(Cb,2Cp) |
4 | 15,49 | 61,96 |
|
Cp–(2Cb,Cp) |
2 | 20,09 | 40,18 |
|
Cb-(H) |
12 | 13,81 | 165,72 |
| Аддитивная составляющая свойства | 20 | 280,42 | |
|
|
280,42 | ||
Кислородсодержащие соединения
Прогнозирование ![]() кислородсодержащих
соединений основано на тех же принципах, которые изложены для углеводородов, т.е.
с опорой на структурную формулу молекулы рассматриваемого вещества формируется
аддитивная составляющая свойства. При этом кислород обозначен символом “О”
и участвует в расчетах как самостоятельный структурный фрагмент во всех
случаях, кроме присутствия его в составе карбонильной группы, которая вводится
в расчет в качестве одной структурной единицы, обозначаемой символом “СО”.
Таким образом, количество парциальных вкладов в свойство равно суммарному
числу атомов углерода и кислорода для соединений, не содержащих карбонильных
групп. Для карбонильных соединений количество парциальных вкладов в свойство
равно суммарному числу атомов углерода и кислорода минус число карбонильных
групп в молекуле интересующего вещества.
кислородсодержащих
соединений основано на тех же принципах, которые изложены для углеводородов, т.е.
с опорой на структурную формулу молекулы рассматриваемого вещества формируется
аддитивная составляющая свойства. При этом кислород обозначен символом “О”
и участвует в расчетах как самостоятельный структурный фрагмент во всех
случаях, кроме присутствия его в составе карбонильной группы, которая вводится
в расчет в качестве одной структурной единицы, обозначаемой символом “СО”.
Таким образом, количество парциальных вкладов в свойство равно суммарному
числу атомов углерода и кислорода для соединений, не содержащих карбонильных
групп. Для карбонильных соединений количество парциальных вкладов в свойство
равно суммарному числу атомов углерода и кислорода минус число карбонильных
групп в молекуле интересующего вещества.
После расчета аддитивной составляющей ![]() вводятся необходимые поправки,
которые приведены в табл. 1.2 вслед за значениями парциальных вкладов. Для циклических
кислородсодержащих соединений они даются в качестве поправки на цикл, для алифатических фрагментов молекул это
может быть гош-поправка и т.п.
вводятся необходимые поправки,
которые приведены в табл. 1.2 вслед за значениями парциальных вкладов. Для циклических
кислородсодержащих соединений они даются в качестве поправки на цикл, для алифатических фрагментов молекул это
может быть гош-поправка и т.п.
В табл. 1.8 приведен пример расчета ![]() кислородсодержащего соединения.
кислородсодержащего соединения.
Таблица 1.8
|
Тип атома или группы |
Количество атомов или групп данного типа | Парциальный вклад, кДж/моль |
Вклад в свойство, кДж/моль |
| Изопропил-неопентиловый эфир | |||
|
CH3–(C) |
5 | -42,19 | -210,95 |
|
C–(4C) |
1 | 2,09 | 2,09 |
|
CH2–(С,O) |
1 | -33,91 | -33,91 |
|
CH–(2C,O) |
1 | -30,14 | -30,14 |
|
O–(2C) |
1 | -97,11 | -97,11 |
| Аддитивная составляющая свойства | 9 | -370,01 | |
|
Поправки на гош-взаимодействие через кислород простого эфира |
1 | 2,09 | 2,09 |
|
Поправки на гош-взаимодействие с участием группы, прикрепленной к кислороду простого эфира |
2 | 1,26 | 2,52 |
|
|
-365,41 | ||
Надеемся, что приведенная выше информация поможет в
работе с методом Бенсона при прогнозировании ![]() интересующих
соединений; при этом она достаточно убедительна, чтобы использовать иные
подходы, если необходимы более надежные сведения об энтальпиях образования.
Опыт показывает, что точности метода Бенсона оказывается достаточно для
выполнения большинства технохимических расчетов, например, при определении
суммарного теплового эффекта протекающих в реакторе превращений или при расчете
перепада температур в зоне реакции. Однако более строгие расчеты, например
детальный термодинамический анализ процессов, предъявляют во многих случаях
более жесткие требования к качеству исходной информации. Учитывая то, что с течением
времени пополняется объем базы экспериментальных данных, целесообразно не
просто использовать разработанный ранее наиболее совершенный метод прогнозирования
свойства, но и перенастраивать его параметры с учетом всего объема накопленной
на данный момент информации. Квалифицированное решение указанной задачи требует
владения общими приемами; некоторые из них рассмотрены ниже. На примере прогнозирования
основных термодинамических свойств веществ различных классов нами анализируется
логика совершенствования существующих или создания новых аддитивных методов. В
качестве модельного избран метод Татевского по связям, последовательно и четко
передающий роль строения молекул в формировании свойства вещества.
интересующих
соединений; при этом она достаточно убедительна, чтобы использовать иные
подходы, если необходимы более надежные сведения об энтальпиях образования.
Опыт показывает, что точности метода Бенсона оказывается достаточно для
выполнения большинства технохимических расчетов, например, при определении
суммарного теплового эффекта протекающих в реакторе превращений или при расчете
перепада температур в зоне реакции. Однако более строгие расчеты, например
детальный термодинамический анализ процессов, предъявляют во многих случаях
более жесткие требования к качеству исходной информации. Учитывая то, что с течением
времени пополняется объем базы экспериментальных данных, целесообразно не
просто использовать разработанный ранее наиболее совершенный метод прогнозирования
свойства, но и перенастраивать его параметры с учетом всего объема накопленной
на данный момент информации. Квалифицированное решение указанной задачи требует
владения общими приемами; некоторые из них рассмотрены ниже. На примере прогнозирования
основных термодинамических свойств веществ различных классов нами анализируется
логика совершенствования существующих или создания новых аддитивных методов. В
качестве модельного избран метод Татевского по связям, последовательно и четко
передающий роль строения молекул в формировании свойства вещества.
© 2009 База Рефератов