
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Окись этилена
Курсовая работа: Окись этилена
Содержание
Введение. 2
Глава 1. Оксид этилена. Физические и химические свойства. Строение молекулы. 3
Глава 2. Производство оксида этилена. 5
2.1. Синтез окиси этилена через этиленхлоргидрин. 5
2.2. Каталитическое окисление этилена. 9
2.3. Гомогенное газофазное окисление этилена в окись этилена. 13
Глава 3. Применение оксида этилена. 18
Заключение. 22
Список использованной литературы. 23
Окись этилена является одним из наиболее крупнотоннажных продуктов органического синтеза, получаемых на основе этилена. Производные окиси этилена (гликоли и их эфиры, этаноламины, поверхностно-активные оксиэтилированные вещества) нашли широкое применение для синтеза антифризов, синтетических волокон, текстильных веществ, синтетических каучуков и пластических масс, взрывчатых веществ, при добыче и переработке нефти, для очистки природных газов и газов нефтепереработки. Такой большой объем использования окиси этилена требует производства окиси этилена в больших количествах.
Согласно современных данных производство окиси этилена составляет около 5 млн. тонн и масштабы производства ее возрастают. Поэтому перед современной химической промышленностью стоит задача разработать методы и пути интенсификации получения окиси этилена, улучшения качества продукта, уменьшения затрат на ее производство.
Актуальность темы: работа должна способствовать изучению путей получения и использования окиси этилена, интенсификации получения окиси этилена, улучшения качества продукта, уменьшения затрат на ее производство.
Цель работы: определить основные способы получения окиси этилена в современных условиях, их позитивные и негативные стороны, рассмотреть использование окиси этилена в химическом синтезе.
Задачи: разработать пути совершенствования получения и переработки окиси этилена в химической промышленности.
Глава 1. Оксид этилена. Физические и химические свойства. Строение молекулы.
Окись этилена
впервые получил и описал ее главные свойства в 1859 г. французский химик Адольф
Шарль Вюрц. Занимаясь изучением производных этиленгликоля, Вюрц получил окись
этилена действием раствора едкого кали на этиленхлоргидрин и определил, что
новое соединение кипит при +13,5°С ![]() , смешивается во всех
отношениях с водой, образует с сульфатом натрия кристаллическое соединение
освежающего вкуса, восстанавливает водный раствор нитрата серебра, но не дает
кристаллического осадка при действии эфирного раствора аммиака.
, смешивается во всех
отношениях с водой, образует с сульфатом натрия кристаллическое соединение
освежающего вкуса, восстанавливает водный раствор нитрата серебра, но не дает
кристаллического осадка при действии эфирного раствора аммиака.
Окись этилена
![]() относится к циклическим простым
эфирам. Структурная формула вещества приведена ниже.
относится к циклическим простым
эфирам. Структурная формула вещества приведена ниже.

Вследствие напряженности трехчленного эпоксидного цикла оксид этилена и другие похожие соединения обладают высокой реакционной способностью.
При обычной температуре и давлении окись этилена находится в газообразном состоянии. При низких температурах окись этилена представляет собой легколетучую бесцветную жидкость со специфическим эфирным запахом (т. кип. 10,7ºС; т. затв. – 113,3°С); с водой образует гидрат с 7 молекулами H2O (температура плавления 12,8°С). Молекулярный вес ее составляет 44,054 г/моль. С водой окись этилена смешивается во всех отношениях, с воздухом образует взрывчатые смеси. Окись этилена обладает инсектецидными и бактерицидными свойствами.
Чистая окись
этилена не является проводником электрического тока, но, растворяя соли
(например, хлористый натрий и особенно азотнокислый калий), образует
токопроводящие растворы. Некоторые исследователи считают, что водные растворы
окиси этилена не проводят электрический ток. По другим данным, водные раствори
ее являются слабыми проводниками тока, хотя авторы объясняют
электропроводность этих растворов вторичными причинами, в частности
образованием небольших количеств гликолевой кислоты. Диэлектрическая проницаемость окиси
этилена при ![]() составляет 13,9. Дипольный
момент равен 1,88 – 1,91 D.
составляет 13,9. Дипольный
момент равен 1,88 – 1,91 D.
Окись
этилена – одно из самых реакционноспособных органических соединений. Благодаря
легкости размыкания напряженного трехчленного эпоксидного цикла окись этилена
может присоединять вещества, содержащие подвижный атом водорода, образуя ![]() –оксиэтилпроизводные, а
также может полимеризироваться. При нагревании до 500°С без катализаторов или
до 150 – 300°С в присутствии некоторых катализаторов (активная окись алюминия,
фосфорная и соляная кислоты, фосфаты) окись этилена необратимо изомеризуется в
ацетальдегид с выделением большого количества тепла. Путем гидратации окиси этилена
получается этиленгликолъ. Окись этилена способна полимеризироваться под
влиянием третичных аминов, хлорного олова и некоторых других катализаторов с
образованием твердой белой массы, представляющей собой смесь
–оксиэтилпроизводные, а
также может полимеризироваться. При нагревании до 500°С без катализаторов или
до 150 – 300°С в присутствии некоторых катализаторов (активная окись алюминия,
фосфорная и соляная кислоты, фосфаты) окись этилена необратимо изомеризуется в
ацетальдегид с выделением большого количества тепла. Путем гидратации окиси этилена
получается этиленгликолъ. Окись этилена способна полимеризироваться под
влиянием третичных аминов, хлорного олова и некоторых других катализаторов с
образованием твердой белой массы, представляющей собой смесь
полимергомологов состава ![]() . При
полимеризации выделяется очень большое количество тепла, и процесс может
протекать со взрывом. Высокомолекулярный полиоксиэтилен растворим в воде, и
поэтому его применяют в качестве эмульгатора и загустителя.
. При
полимеризации выделяется очень большое количество тепла, и процесс может
протекать со взрывом. Высокомолекулярный полиоксиэтилен растворим в воде, и
поэтому его применяют в качестве эмульгатора и загустителя.
Окись этилена вступает также и в много других реакций с другими веществами, практически важные реакции мы рассмотрим ниже в разделе, касающемся применения окиси этилена.
Глава 2. Производство оксида этилена.
Окись этилена впервые получил А. Вюрц в 1859 году действием концентрированного раствора щелочи на этиленхлоргидрин. Этот метод получения окиси этилена довольно давно был освоен химической промышленностью и долгое время был единственным практически значимым методом получения окиси этилена.
Но работа с хлором, который
является довольно токсичным, привела к необходимости поиска других способов получения
![]() . И начиная с 30 годов прошлого
ХХ века начались исследования процессов каталитического окисления этилена. На сегодня
разрабатываются методы некаталитического окисления этилена и этана в окись
этилена.
. И начиная с 30 годов прошлого
ХХ века начались исследования процессов каталитического окисления этилена. На сегодня
разрабатываются методы некаталитического окисления этилена и этана в окись
этилена.
2.1. Синтез окиси этилена через этиленхлоргидрин
Технологический процесс производства окиси этилена хлоргидринным способом включает три основные стадии:
1) получение этиленхлоргидрина;
2)
получение
окиси этилена взаимодействием этиленхлоргидрина
с едкой щелочью;
3) очистку окиси этилена.
В первой стадии процесса хлор и этилен пропускают в воду. При этом хлор гидролизуется:
![]()
Таким образом, при пропускании хлора в воду получается хлорная вода, содержащая соляную кислоту, хлорноватистую кислоту и молекулярный хлор, относительное количество которого увеличивается по мере поглощения хлора водой. Если в воде растворяется малое количество хлора, он гидролизуется почти полностью, с увеличением концентрации хлора в воде степень его гидролизе уменьшается.
Образующаяся хлорноватистая кислота присоединяется к этилену, давая этнленхлоргидрин:
![]()
При пропускании этилена в хлорную воду всегда протекают одновременно две реакции: образование этиленхлоргидрина в результате взаимодействия с этиленом хлорноватистой кислоты и образование дихлорэтана при взаимодействии с этиленом растворенного (молекулярного) хлора:
![]()
Относительное количество образующегося дихлорэтана будет возрастать по мере увеличения концентрации этиленхлоргидрина в воде, так как одновременно повышается концентрация хлористого водорода, а следовательно, увеличивается количество недиссоциированного хлора, реагирующего с этиленом с образованием дихлорэтана.
Выделение высококонцентрированного этиленхлоргидрина из разбавленных растворов связано с большими трудностями. Несмотря на значительную разницу температур кипения этиленхлоргидрина (129°С) и воды разделить их обычной ректификацией невозможно, так как они образуют азеотропную смесь, содержащую 41% этиленхлоргидрина и кипящую при 98°С. Поэтому путем ректификации в лучшем случае удается отделить 41%-ный водный раствор этиленхлоргидрина. На практике во второй стадии процесса при получении окиси этилена непосредственно используют разбавленные растворы этиленхлоргидрина.
Окись этилена образуется при взаимодействии этиленхлоргидрина со щелочью:
![]()
Выход окиси этилена может значительно понизиться вследствие протекания побочной реакции – омыления этиленхлоргидрина разбавленной щелочью в этиленгликоль:
![]()
Чем ниже концентрация реагирующих компонентов, тем больше образуется этиленгликоля и тем ниже выход окиси этилена. Более благоприятные условия создаются, если в колонну, в которой проводится обработка этиленхлоргидрина щелочью, снизу вводить пар и подогревать 4 – 6%-ный раствор этиленхлоргидрина до температуры кипения азеотропной смеси этиленхлоргидрина и воды. При этом содержание этиленхлоргидрина в парах повышается до 41% и во взаимодействие со щелочью, орошающей колонну, вступает не разбавленный, а концентрированный этиленхлоргидрин. Концентрация применяемой щелочи также должна быть достаточно высокой (40%-ный раствор едкого натра или 30%-ное известковое молоко). Таким образом, реакция протекает фактически между концентрированными этиленхлоргидрином и щелочью, и образование этиленгликоля сводится к минимуму.
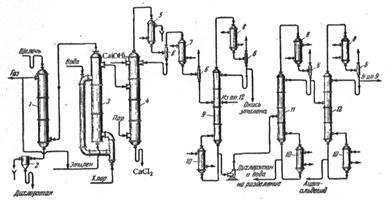
Рис. 2.1. Схема производства окиси этилена непрерывным методом через этиленхлоргидрин.
На рис. 2.1 приведена технологическая схема
производства окиси этилена через этиленхлоргидрин непрерывным методом ![]() . В стальной реакционной
колонне 3, футерованной кислотоупорными плитками, производится
гипохлорирование этилена с образованием этиленхлоргидрина. Колонна снабжена
двумя боковыми соединяющимися отводами (верхним и нижним). Газообразный хлор подается
через диффузор в нижний отвод и распыляется в поступающей сверху воде, а
этилен вводится снизу в основную часть реакционной колонны. Благодаря такому
устройству аппарата реакционная жидкость интенсивно циркулирует и
перемешивается; условия гидролиза хлора и взаимодействия хлорноватистой кислоты
с этиленом улучшаются, а, следовательно, уменьшается возможность образования
дихлорэтана.
. В стальной реакционной
колонне 3, футерованной кислотоупорными плитками, производится
гипохлорирование этилена с образованием этиленхлоргидрина. Колонна снабжена
двумя боковыми соединяющимися отводами (верхним и нижним). Газообразный хлор подается
через диффузор в нижний отвод и распыляется в поступающей сверху воде, а
этилен вводится снизу в основную часть реакционной колонны. Благодаря такому
устройству аппарата реакционная жидкость интенсивно циркулирует и
перемешивается; условия гидролиза хлора и взаимодействия хлорноватистой кислоты
с этиленом улучшаются, а, следовательно, уменьшается возможность образования
дихлорэтана.
Для повышения выхода этиленхлоргидрина в колонну 3 вводят большой избыток этилена против стехиометрически требуемого количества. Отходящий из колонны избыточный этилен после очистки возвращают в производственный цикл. Кроме этилена в отходящем из колонны газе содержатся пары дихлорэтана и хлористый водород, нейтрализуемый в насадочном скруббере 1 холодным раствором щелочи. При этом одновременно конденсируется большая часть паров дихлорэтана, который вместе с отработанной щелочью выводят из скруббера в разделитель 2. После расслаивания жидкостей дихлорэтан направляют на очистку, а отработанную щелочь сливают. Чтобы в циркулирующем газе не накапливались инертные примеси, часть газа непрерывно отбирают, очищают от остатка паров дихлорэтана в угольном адсорбере и далее используют как топливо.
Образующийся в колонне раствор этиленхлоргидрина (4 – 6%-ный) поступает в реакционную колонну 4, где при 100°С обрабатывается щелочью (30%-ное известковое молоко). Реакционную массу подогревают паром, вводимым в нижнюю часть колонны. Получаемая в результате омыления этиленхлоргидрина окись этилена вместе с парами побочных продуктов (дихлорэтан, ацетальдегид) через дефлегматор 5 поступает в конденсатор 7, охлаждаемый водой или рассолом. Конденсат разделяют в ректификационной тарельчатой колонне 9. Дистиллятом этой колонны является окись этилена, направляемая после ожижения в конденсаторе 8 на дальнейшее использование.
Кроме колонных аппаратов (рис. 2.1), для омыления этиленхлоргидрина успешно применяют омылители спирального типа. В омылителях подобного типа достигается более полное омыление этиленхлоргидрина.
При получении окиси этилена хлоргидринным методом общая степень превращения этилена достигает 95%; выход этиленхлоргидрина составляет около 80% от теоретического (считая на этилен). На 1 тонну окиси этилена получается около 200 кг дихлорэтана.
Существенными недостатками процесса получения окиси этилена через этиленхлоргидрин являются большой расход хлора и извести, а также значительные капитальные затраты.
Более экономичен процесс прямого каталитического окисления этилена в окись этилена. При этом методе расходуется только этилен и воздух, не требуется затрат хлора и извести, не образуется побочный продукт - дихлорэтан и меньше капитальные затраты. Поэтому метод прямого окисления приобретает все большее распространение.
2.2. Каталитическое окисление этилена
Для проведения реакции прямого окисления этилена
было предложено большое число высокоактивных катализаторов. Почти все они
содержат в качестве основного компонента серебро ![]() .
Применяемые катализаторы можно разделить на две основные группы:
.
Применяемые катализаторы можно разделить на две основные группы:
· сплошные серебряные катализаторы;
· активное серебро на носителе (трегерные катализаторы).
Катализаторы первой группы представляют собой металлическое серебро, которое обычно гранулируют и гранулы обрабатывают кислотами, что увеличивает поверхность катализатора и повышает его активность. Если катализатор предназначается для проведения процесса окисления этилена в псевдоожиженном слое, металлическое серебро измельчают до порошкообразного состояния и формуют в виде таблеток или шариков.
Предложены также сплавные скелетные катализаторы; серебро сплавляют с кальцием, который извлекается затем уксусной кислотой. Недостатком сплошных скелетных катализаторов является их высокая стоимость из-за большого расхода серебра.
Трегерные катализаторы готовят нанесением активного серебра на носитель (окись алюминия, карборунд, силикагель, пемза). Для приготовления трегерного катализатора чаще всего пропитывают носитель растворами некоторых соединений серебра (например, водным раствором нитрата серебра) с последующим восстановлением до металлического серебра.
В настоящее время в
промышленности используются только серебряные катализаторы, но в последние годы
появились сообщения об окислении этилена в окись этилена в присутствии солей
или окисей других металлов. Из них особого внимания заслуживает процесс
получения окиси этилена в паровой фазе на катализаторе, представляющем собой
смесь ![]() и
и ![]() . Окисление этилена
производилось кислородом при разрежении в интервале температур 400 – 600°С с 90
100 %-ным выходом окиси этилена.
. Окисление этилена
производилось кислородом при разрежении в интервале температур 400 – 600°С с 90
100 %-ным выходом окиси этилена.
В жидкой фазе окисление этилена протекает в среде дибутилфталата в присутствии окиси ртути. При этом образуется окись этилена, хотя и в меньшем количестве, чем в присутствии катализаторов, содержащих серебро. Окисление этилена в этих условиях осуществляется за счет восстановления окислов металлов.
Большое влияние на выход окиси этилена оказывает соотношение вводимых в процесс воздуха и этилена. Максимальный выход получается при соотношении воздух : этилен от 7:1 до 8:1, что соответствует содержанию в газовой смеси 12 об. % этилена и 88 об. % воздуха. Однако такие смеси взрывоопасны и поэтому приходится проводить процесс в менее выгодных условиях при концентрации этилена ниже нижнего предела взрываемости, который составляет 2,75 об. % этилена в смеси с воздухом.
При получении окиси этилена можно использовать в качестве окислителя технический кислород. В этом случае желательно применять концентрированный этилен (98 %-ный и выше). В присутствии парафиновых углеводородов выход окиси этилена понижается; при наличии в газе гомологов этилена в процессе окисление развиваются высокие температуры и затрудняется отвод выделяющегося тепла. Присутствие ацетилена в исходной газовой смеси недопустимо, так как с серебром он образует взрывчатый ацетеленид серебра. Если исходный этилен содержит ацетилен, то его удаляют путем промывки газа селективными растворителями (ацетоном, диметилформамидом) или гидрируют до этилена на никелевом катализаторе.
От соединений серы исходный газ очищают обычным методом – промывкой щелочью и водой.
При пропускании смеси этилена и воздуха над катализатором при 200 – 300ºС одновременно протекают две реакции:
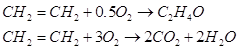
Обычно до окиси этилена окисляется не больше 55 60% этилена, а 40 – 45% его полностью сгорает до CО2 и Н2О.
В промышленных установках прямого окисления используются контактные аппараты с неподвижным или с псевдоожиженным слоем катализатора.
Реактор с неподвижным слоем катализатора, работающий под давлением до 21 атм., представляет собой кожухо-трубный аппарат, трубки которого заполнены зерненным катализатором. Так как окислы железа каталитически ускоряют реакцию полного окисления этилена, трубки изготавливают из хромоникелевых аустенитных сталей или из обычных углеродистых сталей и серебрят изнутри. Благодаря малому сечению трубок реагирующие газы проходят по ним с большой скоростью. Таким образом, достигается повышенная теплоотдача от газа к стенкам трубок и сравнительно равномерное охлаждение контактной массы. Интенсивный отвод реакционного тепла в этом процессе весьма важен, так как при температуре свыше 300°С может происходить полное окисление этилена.
Окись этилена извлекают из контактных газов в
скрубберах, орошаемых водой, затем отгоняют из водного раствора, осушают и
конденсируют. Транспортируют окись этилена в жидком виде в стальных баллонах.
Если целевым продуктом производства является этиленгликоль, контактные газы
промывают горячим 1%-ным раствором серной кислоты, в результате чего окись
этилена гидратируется до этиленгликоля ![]() .
.
Изучен и разработан процесс получения окиси этилена каталитическим окислением этилена в псевдоожиженном слое катализатора. Благодаря высокому коэффициенту теплоотдачи в псевдоожиженном слое катализатора (значительно большему, чем в аппаратах с неподвижным слоем катализатора) при окислении требуется меньшая поверхность теплообмена, а следовательно, и меньшие габариты реакционных аппаратов.
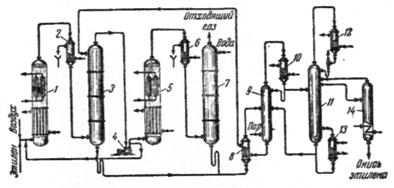
Рис. 2.2. Схема производства окиси этилена прямым окислением этилена в псевдоожиженном слое катализатора.
1) реактор первой ступени; 2, 6) холодильники; 3) абсорбер первой ступени; 4) компрессор; 5) реактор второй ступени; 7) абсорбер второй ступени; 8) теплообменник; 9) отпарная колонна; 10, 12) дефлегматоры; 11) ректификационная колонна; 13) кипятильник; 14) разделительная колонна.
В нижней части реакционного аппарата помещены трубы, охлаждаемые высокотемпературным теплоносителем, циркулирующим в межтрубном пространстве. Над трубами расположены охлаждающие элементы, а еще выше фильтры из пористой окиси алюминия. Равномерное распределение псевдоожиженного катализатора по трубам реактора достигается благодаря тому, что аппарат заполняют катализатором до уровня, значительно превышающего высоту труб (над трубной решеткой создается слой катализатора. Равномерность подачи этилена во все трубы автоматически регулируется специальными приборами.
Для данного процесса требуется прочный катализатор, не требующий регенерации или реактивации в течение длительного времени и не подвергающийся заметному истиранию.
Процесс проводят под давлением в две ступени. Смесь этилена и воздуха нагнетается в контактный реактор 1 первой ступени, где до 50% этилена превращается в окись этилена. Продукты реакции охлаждаются в холодильнике 2, после чего в абсорбере 3 первой ступени из них извлекается окись этилена.
Часть непрореагировавших газов возвращают в реактор 1, а остальной газ подают в реактор 5 второй ступени. Общая степень превращения этилена во второй ступени окисления составляет 70%.
Из контактных газов после второй ступени окисления окись этилена извлекают водой в абсорбере 7 второй ступени. Из абсорберов 3 и 7 водный раствор окиси этилена через теплообменник 8 направляют в отпарную колонну 9. Отгоняемая из этой колонны паро-газовая смесь поступает через дефлегматор 10 на разделение в ректификационную колонну 11. Окончательная очистка окиси этилена от CO2 производится в колонне 14. Получаемый по этому способу продукт представляет собой 99,5%-ную окись этилена.
При прямом окислении расход этилена несколько выше, чем при хлоргидринном методе. Однако этот недостаток вполне окупается другими достоинствами метода прямого окисления, который следует считать весьма перспективным.
2.3. Гомогенное газофазное окисление этилена в окись этилена
При прямом гомогенном окислении этилена кислородом образуется ряд ценных продуктов: окись этилена, формальдегид, органические кислоты. сейчас разрабатываются методы синтеза окиси этилена гомогенным окислением этилена в газовой фазе, так как для этого процесса не требуется затрат ни дорогого катализатора, ни хлора. Кроме того, при этом способе получения окиси этилена не требуются этилен и воздух такой высокой степени очистки, как при каталитическом окислении этилена. К недостаткам этого метода относятся многообразие образующихся продуктов и низкая селективность, что объясняется цепной природой происходящих превращений и высокой температурой. Однако развитие теории цепных процессов открывает новые пути совершенствования реакций газофазного окисления этилена.
Рассмотрим влияние условий на процесс образования окиси этилена. Первым фактором мы рассмотрим влияние температуры.
При температуре ниже
300°С этилен не взаимодействует с кислородом, медленное окисление начинается
при 300°С ![]() . С повышением температуры скорость
процесса резко возрастает. Оптимальной температурой считают ту, при которой
65% поданного в зону реакции кислорода вступает во взаимодействие с этиленом.
. С повышением температуры скорость
процесса резко возрастает. Оптимальной температурой считают ту, при которой
65% поданного в зону реакции кислорода вступает во взаимодействие с этиленом.
При температуре ниже 400°С степень превращения кислорода за один проход составляет примерно 35%. При температуре выше 550°С резко возрастает скорость окисления этилена до двуокиси углерода и воды, а скорость образования окиси этилена уменьшается.
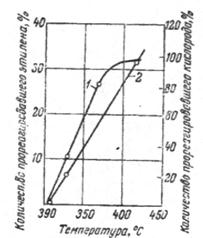
Рис. 2.3. Влияние температуры на глубину окисления этилена.
На рис. 2.3 представлена температурная зависимость степени превращения исходных компонентов при прямом окислении этилена. Состав исходной смеси – 80% С2Н4 и 12% О, время реакции 20 сек; стеклянный реактор длиной ~500 мм и диаметром 46 мм. Из рассмотрения кривых, представленных на рис. 2.3 можно сделать выводы:
1. С ростом температуры степень конверсии этилена возрастает.
2.
Количество
реагирующего кислорода сначала быстро растет с повышением температуры – при
360°С в реакцию вступает более 80% исходного кислорода. Выше этой температуры
кривая расхода кислорода
резко изменяет свой наклон и асимптотически приближается к 100% ![]() .
.
В данном процессе возможно протекание нескольких побочных реакций. В частности возможно при температурах 320 - 335ºС образование формальдегида:
![]()
Другой побочной реакцией, которая может идти в этих условиях, является образование бирадикала диметиленоксида и дальнейшее его взаимодействие с этиленом с образованием пропилена и формальдегида:
![]()
Такой процесс наблюдался
при взаимодействии окиси этилена с этиленом при температурах выше 400°С. При
температурах ниже 350°С образование пропилена не происходило ![]() .
.
Исследования показали влияние
на процессы окисления этилена добавления небольших количеств озона, который ускорял
процессы окисления. Это можно считать доказательством цепного механизма окисления
этилена в окись этилена ![]() .
.
В наше время существуют полупромышленные установки для получения окиси этилена методом гомогенного окисления.
Схема процесса приведена на рис. 2.4. Реакционная смесь после реактора 2 поступает в холодильник 7 и далее в скруббер 9, где большая часть образующихся продуктов поглощается водой. Газовая смесь после скруббера вновь возвращается в реактор; предварительно к ней добавляют этан и кислород. Основными продуктами реакции являются окись этилена, уксусный и муравьиный альдегид, перекись водорода, окись и двуокись углерода. Оптимальный выход окиси этилена (36%) соответствует степени конверсии кислорода менее 35%.
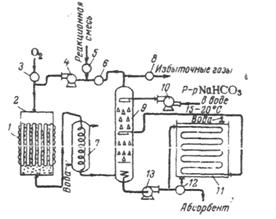
Рис. 2.4. Схема установки для гомогенного окисления смеси этилена и этана.
1) змеевик для обогрева и охлаждения реактора, 2) реактор, 3) вентиль для подачи кислорода, 4) циркуляционный насос, 5) вентиль для подачи реакционной смеси, 6) вентиль для подачи рециркуляционного газа, 7) холодильник. 8) вентиль для отвода избыточных газов, 9) скруббер, 10) насос орошения скруббера, 11) холодильник для адсорбента, 12) вентиль для подачи адсорбента на ректификацию, 13) насос для отвода адсорбента.
Съем окиси этилена с 1 л реакционного объема составляет 60 г/ч. Если стенки реактора покрыть раствором борной кислоты, то показатели процесса улучшаются. При дешевом сырье этот процесс представляется экономически выгодным. Наиболее дорогостоящей стадией, определяющей экономику процесса, является выделение продуктов реакции.
Глава 3. Применение оксида этилена.
Оксид этилена ![]() используется для получения
многих крупнотоннажных химических продуктов и промежуточных соединений. На рисунке
3.1 приведены в общем виде направления получения основных химических продуктов на
основе окиси этилена.
используется для получения
многих крупнотоннажных химических продуктов и промежуточных соединений. На рисунке
3.1 приведены в общем виде направления получения основных химических продуктов на
основе окиси этилена.
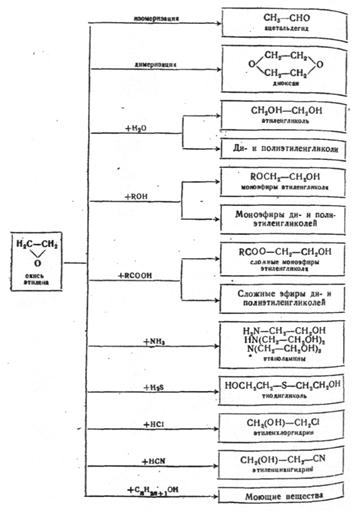
Рис. 3.1. Синтезы на основе окиси этилена.
Далее мы рассмотрим получение основных продуктов, получаемых из окиси этилена.
При нагревании до 500°С без катализаторов или до 150 – 300°С в присутствии некоторых катализаторов (активная окись алюминия, фосфорная и соляная кислоты, фосфаты) окись этилена необратимо изомеризуется в ацетальдегид:
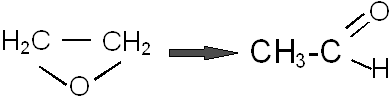
Причем при каталитической изомеризации в качестве побочного продукта образуются диоксан и этиленацеталь ацетальдегида.
Гидрированием окиси этилена при повышенном давлении и температуре 80ºС в присутствии никелевого катализатора можно получить этиловый спирт (этанол).

Данная реакция в промышленности почти не используется, поскольку для получения этанола есть более простые и дешевые способы получения. При повышении температуры гидрирования получаем моноэтиловый эфир этиленгликоля.
Путем гидратации окиси этилена можно получить важный химический продукт – этиленгликоль.
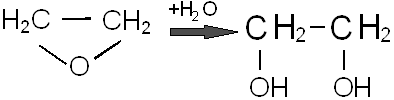
Гидратацию можно проводить при 50 – 100°С в присутствии катализаторов (следы серной, фосфорной и других кислот) или без катализатора при 200°С и повышенном давлении. Кроме этиленгликоля, при этом образуются диэтиленгликоль, триэтиленгликоль, а также высшие полиэтиленгликоли:
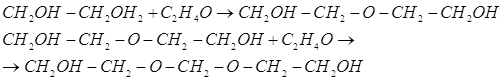
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, растворителей, взрывчатых веществ и пр.
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 об. % этиленгликоля, замерзает при -25°С, а 60%-ный водный раствор при -40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Диэтиленгликоль НОСН2СН2—О—СН2СН2ОН (т. кип. 245,5°С) применяется как растворитель и как уплотняющая жидкость для тормозных гидравлических приспособлений; в текстильной промышленности его используют при отделке и крашении тканей. Триэтиленгликоль и тетраэтиленгликоль являются растворителями и пластификаторами.
Аналогично реакции гидратации протекают реакции окиси этилена со спиртами. При этом образуются моноэфиры этиленгликоля, диэтиленгликоля.

Моноэфиры этиленгликоля, известные под названием целлозольвов и моноэфиры диэтиленгликоля применяются в качестве растворителей лаков и красок.
Окись этилена способна
полимеризироваться под влиянием третичных аминов, хлорного олова и некоторых
других катализаторов с образованием твердой белой массы, представляющей собой
смесь полимергомологов состава ![]() . При полимеризации выделяется
очень большое количество тепла, и процесс может протекать со взрывом. Высокомолекулярный
полиоксиэтилен (мол. вес
. При полимеризации выделяется
очень большое количество тепла, и процесс может протекать со взрывом. Высокомолекулярный
полиоксиэтилен (мол. вес ![]() ) растворим в воде, и поэтому его
применяют в качестве эмульгатора и загустителя.
) растворим в воде, и поэтому его
применяют в качестве эмульгатора и загустителя.
В растворе этанола при 0ºС
окись этилена реагирует с натрийацетоуксусным эфиром. Образующийся при этом ацетобутиролактон
в присутствии разбавленной серной кислоты дает ![]() -ацетопропиловый
спирт
-ацетопропиловый
спирт ![]() .
.

Ацетобутиролактон используют
для получения витамина В1, а ![]() -ацетопропиловый
спирт используют для получения противомалярийных препаратов и витамина С.
-ацетопропиловый
спирт используют для получения противомалярийных препаратов и витамина С.
Окись этилена способна
присоединять углеводороды. Так в присутствии безводного хлорида алюминия окись этилена
с бензолом образует ![]() - фенилэтиловый спирт
с выходом около 60 – 65%
- фенилэтиловый спирт
с выходом около 60 – 65%
![]() .
.
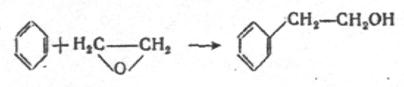
Данное вещество обладает приятным запахом и поэтому широко применяется в парфюмерии.
ЗаключениеОкись этилена, являясь одним из самых реакционноспособных органических веществ, широко используется в химической промышленности для получения этиленгликоля, полиэтиленгликоля, этанола, формальдегида, и многих других многотоннажных химических продуктов.
Для получения окиси этилена современная химия использует три основных метода его получения: получение из этилена каталитическим окислением последнего, некаталитическое окисление этилена и получение из этиленхлоргидрина. Сопоставляя показатели этих процессов можно сделать вывод, что хлоргидринный метод является наиболее экономичным. Но для своего проведения он требует использования хлора, что требует специальной конструкции реакторов, использования хлоростойких материалов и футеровки реакторов, а также следования некоторым правилам техники безопасности при работе с хлором. Каталитические методы получения окиси этилена не требуют этого, но они требуют большего расхода электроэнергии и высокой чистоты химического сырья для процесса. Поскольку загрязненное серой и другими веществами сырье способно вывести из строя катализаторы. Метод некаталитического окисления этилена в окись этилена является наиболее перспективным, но он пока не вышел за границы полупромышленного применения.
Список использованной литературы
1. Бесков В.С., Сафронов В.С. Общая химическая технология и основы промышленной экологии. – М.: Химия, 1999. – 412 с.
2. Зимаков П. В., Дымент О. Н., Богословская Н. А. и др. Окись этилена – М.: Химия, 1967. – 319 с.
3. Клименко А.П. Получение этилена из нефти и газа. – М.: ГНТИНиГТЛ, 1962. – 412 с.
4. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: ОНТВ РФ, 1936. – 318 с.
5. Общая органическая химия. Т.1: Стереохимия, углеводороды, галогенсодержащие соединения. Под ред. Д. Бартона и У. Д. Оллиса. – М.: Химия, 1981. – 735 с.
6. Одабашян Г.В., Швец В.Ф. Лабораторный практикум по химии и технологии органического и нефтехимического синтеза. – М.: Химия, 1992.
7. Паушкин Я.М., Адельсон С.С. Технология нефтехимического синтеза. – М.: Химия, 1976. 648 с.
8. Синтезы органических соединений. Методические указания к лабораторному практикуму. Под ред. Б. Д. Березина. – Иваново, Изд. Ив. ХТУ, 1976. – 110 с.
9. Смит В., Бочков А., Кейпл Р. Органический синтез: Наука и искусство. – М.: Мир, 2001. – 345 с.
10. Современные методы органического синтеза. Под ред. проф. Б. В. Иоффе. – Л.: Изд. ЛГУ, 1980. – 232 с.
11. Углеводороды. М.: РХТУ им. Менделеева, 2000. – 287 с.
12. Хавкинс Э. Дж. Органические перекиси, их получение и реакции. – М. – Л.: Химия, 1964. – 387 с.
13. Юкельсон И.И. Технология основного органического синтеза. – М.: Химия, 1968. – 847 с.
© 2009 База Рефератов