
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Подготовка и конденсация воды
Курсовая работа: Подготовка и конденсация воды
Курсовая работа
“Подготовка и конденсация воды”
Одесса 2010
Введение
В настоящее время вода широко используется в различных областях промышленности в качестве теплоносителя и рабочего тела, чему способствует широкое распространение воды в природе и ее особые термодинамические свойства, связанные со строением молекул. Полярность молекул воды, характеризуемая дипольным моментом, определяет большую энергию взаимного притяжения молекул воды (ориентационное взаимодействие) при температуре 10…30 С и соответственно большую теплоту фазового перехода при парообразовании, высокую теплоемкость и теплопроводность. Значение диэлектрической постоянной воды, также зависящей от дипольного момента, определяет своеобразие свойств воды как растворителя.
При нагреве воды на поверхностях нагрева образуются твердые отложения накипеобразующих солей. При испарении воды в пар переходят коррозионно-активные газы, которые способствуют разрушению поверхности охлаждения и генерируют новые вещества, образующие отложения из продуктов коррозии.
Надежность работы энергетического оборудования на станции непосредственно связана с качеством подпиточной воды котлов. Правильно рассчитанный, смонтированный и эксплуатируемый комплекс водоподготовки, дополненный химической программой коррекции котловой воды, является необходимым условием долговечной и экономичной работы любого котлоагрегата.
В условиях эксплуатации энергетического оборудования на ТЭС или АЭС при организации водного режима необходимо создавать условия, при которых обеспечиваются минимальные значения скорости коррозии и снижение накипных отложений. Отложения могут образовываться из примесей, поступающих в воду теплоэнергетических установок от внешних и от внутренних источников.
Исходные данные
Исходной водой является вода Бассейны Ингула со следующим химическим составом:
-биогенные компоненты:
![]() =1,66 мг/л;;
=1,66 мг/л;;
NO2+=0,030 мг/л;
NO3+=0,11 мг/л;
Fe=0,11 мг/л;
P=0,060мг/л;
Si=5,9 мг/л;
-окисляемость:
БО=28,4 мгО2/л;
ПО=7,8мгО2/л;
-главные ионы:
HCO3-=294,7 мг/л;
SO42-=67,8 мг/л;
Cl-=55,7 мг/л;
Ca2+=92,3 мг/л;
Mg2+=15,9 мг/л;
Na++K+=38,5мг/л;
-Жо=5,9 мг-экв/л;
Блоки: 210МВт 6шт.
Таблица 1
| Общая концентрация |
Электро провод ность, χ=Сλf мкСм/см |
|||||||||
|
Молекуля рная масса "М" |
Эквива лентная масса "Э" |
Обозначения | Исх. концентрация | Скорректированная концентрация | ||||||
| [H] мг/кг | [C]мг-экв/кг | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | |||||
| 40,08 | 20,04 | Ca2+ | 51,8 | 2,585 | 51,8 | 2,585 | 0,0013 | 0,005 | 110,67 | |
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 10,8 | 0,899 | 0,0004 | 0,001 | 40,8 | |
| 23 | 23 | Na+ | 6,4 | 0,278 | 11,884 | 0,517 | 0,0005 | 0,001 | 23,84 | |
| 1 | 1 | H+ | ||||||||
| Сумма Kt | 3,762 | 4,001 | ||||||||
| 17 | 17 | OH- | ||||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 199,7 | 3,274 | 0,0033 | 0,020 | 134,18 | |
| 60 | 30 | CO32- | ||||||||
| 96 | 48 | SO42- | 17,3 | 0,360 | 17,3 | 0,360 | 0,0002 | 0,002 | 20,75 | |
| 35,46 | 35,46 | Cl- | 13,0 | 0,367 | 13,0 | 0,367 | 0,0004 | 0,001 | 25,78 | |
| Сумма An | 4,001 | 4,001 | ||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
|
||||||
| NH4-,мг/л | 0,60 | моль/л | 0,006 |
|
||||||
| NO2-, мг/л | 0,02 | f’ | 0,921 |
|
||||||
| NO3-, мг/л | 0,11 | f“ | 0,720 |
|
||||||
| Fe, мг/л | 0,10 | CО2ф,моль/л | 0,00002 |
|
||||||
| P, мг/л | 0,04 | СО2р,моль/л | 0,00016 |
|
||||||
| Si, мг/л | 0,00 | рНф | 8,59 |
|
||||||
| БО, мгО2/л | 10,7 | рНр | 7,75 |
|
||||||
| ПО, мгО2/л | 4,00 | Ис | 0,84 |
|
||||||
| Жо, мг-экв/л | 3,7 | Жо-расчетное значение, мг-экв/л | 3,48 |
|
||||||
| СС,мг/л | СС, расчетное значение мг/л | 304,48 |
|
|||||||
| Электропроводность,Сf,мкСм/см | 356,02 |
|
||||||||
Расчёт и корректировка исходного состава воды
Для начала найдём эквивалентные массы ионов:
Э = М/Z,
где М- молярная масса иона;
Z- заряд иона.
Э(Са2+) = 40,08/2 = 20,04 г-экв;
Эквиваленты остальных ионов считаются аналогично.
Расчет начинаем с анионного состава воды:
[С] = [Н]/Э,
где [Н]- концентрация иона, выраженная в мг/л,
Э- эквивалент иона.
С(HCO3-) =3,274мг-экв/кг;
С(SO42-) = 0,360мг-экв/кг;
C(Cl-) = 0,367 мг-экв/кг.
Σ An = 4,001мг-экв/кг.
Рассчитаем катионный состав воды:
С(Са2+) = 2,585мг-экв/кг;
С(Mg2+) = 0,899мг-экв/кг;
С(Na+) = 0,278мг-экв/кг;
Σ Kt = 3,762мг-экв/кг.
Правильность определения концентраций катионов и анионов, т.е. солей, образованных эквивалентным количеством ионов, проверяют на основании закона электронейтральности по уравнению:
Σ Kt=ΣAn.
При несоблюдении этого условия, следует скорректировать состав воды. Это достигается путём добавления натрия Na+.
Т.о. закон электронейтральности соблюдается.
Пересчитаем значения концентраций примесей в другие виды концентраций: [N]= [Н]/(М.1000), моль/л;
Пересчёт остальных концентраций осуществляется аналогично.
[С]= [Н]/104,%
Ионная сила раствора равна полусумме произведений молярных концентраций на квадраты их зарядов.
μ =
0,5 ![]()
Коэффициент активности – функция ионной силы раствора:
lg f' =
-0.5Zi2 ![]() ,
,
f = 10![]() ,
,
Концентрация в природных водах недиссоциированных молекул Н2СО3 составляет обычно лишь доли процента от общего количества свободной углекислоты, под которым понимают сумму Н2СО3+ СО2.
Равновесное значение суммы Н2СО3+ СО2, моль/кг
Н2СО3+ СО2
=  ,
,
и рН равновесное
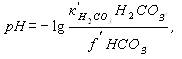
Таблица 2
| Молекуляр- | Эквивалент- | Обозначения | Концентрации после коагуляции | Электропровод- | |||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность, мкСм/см | |
| 40.08 | 20.04 | Ca2+ | 51.800 | 2.585 | 0.0013 | 0.005 | 109.97 |
| 24.03 | 12.01 | Mg2+ | 10.800 | 0.899 | 0.0004 | 0.001 | 40.54 |
| 23 | 23 | Na+ | 11.884 | 0.517 | 0.0005 | 0.001 | |
| 1 | 1 | H+ | |||||
| Сумма Kt | 4.001 | ||||||
| 17 | 17 | OH- | |||||
| 61 | 61 | HCO3- | 169.200 | 2.774 | 0.003 | 0.017 | 113.50 |
| 60 | 30 | CO32- | |||||
| 96 | 48 | SO42- | 41.300 | 0.860 | 0.000 | 0.000 | 49.23 |
| 35.46 | 35.46 | Cl- | 13.000 | 0.367 | 0.000 | 0.001 | 25.74 |
| Сумма An | 4.001 | ||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения | ||||
| NH4+, мг/л | 0.300 | моль/л | 0.006 | ||||
| NO2-, мг/л | 0.011 | f' | 0.920 | ||||
| NO3-, мг/л | 0.055 | f'' | 0.715 | ||||
| Fe, мг/л | 0.030 | СО2 моль/л | 0.0005 | ||||
| P, мг/л | 0.022 | pH | 7.153 | ||||
| Si, мг/л | 0.000 | Жо - расчетное значение, мг-экв/л | 3.484 | ||||
| БО, мгО2/л | 5.350 | CC, расчетное значение мг/л | 297.984 | ||||
| ПО, мгО2/л | 2.000 | Электропроводность, СfмкСм/см | 362.783 | ||||
| Dk,мг-экв/л | 0.500 | ||||||
Вывод: Величина pH имеет оптимальное значение, т.к. входит в интервал 5,5-7,5. Бикарбонатная щелочность увеличилась на дозу коагулянта, а содержание сульфатов увеличилось.
Коагуляция исходной воды
В данном случае, в качестве коагулянта использовался сернокислый алюминий Al2(SO4)3.
Доза добавляемого коагулянта:
Dk = 0,07.ПО = 0,12.8,1 = 0,972мг-экв/л.
Т.к. Dk>0,5 принимаем это значение равное 0,5 мг-экв/л.
Оптимальное значение рН при коагуляции с сернокислым алюминием находится в интервале 5,5 7,5. Значение величины рН среды при коагуляции оказывает влияние на скорость и полноту гидролиза.
При коагуляции в обрабатываемой воде увеличивается содержание сульфатов, но уменьшается бикарбонатная щелочность на дозу коагулянта. Катионный состав воды не меняется.
Таблица 3
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После гидратного известкования | Электропровод- | ||||||||||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность,мкСм/см | |||||||||||
| 40,08 | 20,04 | Ca2+ | 65,606 | 3,274 | 0,0016 | 0,0066 | 31,088 | 1,551 | 0,0008 | 0,0031 | 69,44 | ||||||||||
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 0,0004 | 0,0011 | 7,782 | 0,648 | 0,0003 | 0,0008 | 30,74 | ||||||||||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 0,517 | 0,0005 | 0,0012 | 24,11 | ||||||||||
| 1 | 1 | H+ | |||||||||||||||||||
| Сумма Kt | 4,69 | 2,716 | |||||||||||||||||||
| 17 | 17 | OH- | 5,100 | 0,300 | 0,0003 | 0,0005 | 55,4 | ||||||||||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 0,0033 | 0,02 | 19,215 | 0,315 | 0,0003 | 0,0019 | 13,05 | ||||||||||
| 60 | 30 | CO32- | 5,550 | 0,185 | 0,0001 | 0,0006 | 9,65 | ||||||||||||||
| 96 | 48 | SO42- | 17,3 | 0,360 | 0,0002 | 0,0017 | 41,3 | 0,860 | 0,0004 | 0,0041 | 51,8 | ||||||||||
| 35,46 | 35,46 | Cl- | 37,43 | 21,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 75,06 | ||||||||||
| Сумма An | 4,69 | 2,716 | |||||||||||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
|
|||||||||||||||||
| NH4+, мг/л | 0,3 | моль/л | 0,004 |
|
|||||||||||||||||
| NO2-, мг/л | 0,011 | f' | 0,931 |
|
|||||||||||||||||
| NO3-, мг/л | 0,055 | f'' | 0,752 |
|
|||||||||||||||||
| Fe, мг/л | 0,33 | СО2 моль/л | 0,0005 |
|
|||||||||||||||||
| P, мг/л | 0,022 | pH | 10,446 |
|
|||||||||||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 2,199 |
|
|||||||||||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 154,249 |
|
|||||||||||||||||
| ПО, мгО2/л | 2 | Электропроводность, СfмкСм/см | 329,249 |
|
|||||||||||||||||
| Dk,мг-экв/л | 0,5 |
|
|||||||||||||||||||
| Dи,мг-экв/л | 3,78 |
|
|||||||||||||||||||
| Иизв,мг-экв/л | 0,300 |
|
|||||||||||||||||||
| DCaCl2,мг-экв/л | -0,689 |
|
|||||||||||||||||||
| Mg2+max | 0,596 |
|
|||||||||||||||||||
Коагуляция с известкованием исходной воды (гидратный режим)
Гидратный режим известкования благоприятен для удаления магния, соединений железа, кремния и для осветления воды.
Для расчёта данной таблицы использовали коагулянт – сернокислое железо FeSO4 и гашёную известь Са(ОН)2. Оптимальное значение рН находится в интервале 9 – 10,5. Доза коагулянта Dk = 0,5 мг-экв/л.
Т.к. воды относятся к III группе и являются щелочными, т.е содержание ионов НСО3- находится в избытке по сравнению с остаточной жесткостью, то известкование в этом случае является нецелесообразным. Воду из III группы переводят в I путем добавления CaCl2 эквивалентно содержанию HCO3-.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост = ![]() мг-экв/л.
мг-экв/л.
Используя закон электронейтральности, находим остаточную концентрацию ионов Са2+:
Концентрация сульфатов увеличивается на дозу коагулянта.
Таблица 4
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После бикарбонатного известкования | Электропровод- | ||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность, мкСм/см | |||
| 40,08 | 20,04 |
Ca2+ |
51,8 | 2,585 | 0,0013 | 0,0052 | 21,443 | 1,07 | 0,0005 | 0,0021 | 48,48 | ||
| 24,03 | 12,01 |
Mg2+ |
10,8 | 0,899 | 0,0004 | 0,0011 | 10,8 | 0,899 | 0,0004 | 0,0011 | 43,17 | ||
| 23 | 23 |
Na+ |
11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 0,517 | 0,0005 | 0,0012 | 24,18 | ||
| 1 | 1 |
H+ |
|||||||||||
| Сумма Kt | 4,001 | 2,486 | |||||||||||
| 17 | 17 |
OH- |
1,190 | 0,070 | 0,0001 | 0,0001 | 12,97 | ||||||
| 61 | 61 |
HCO3- |
199,7 | 3,274 | 0,0033 | 0,02 | 23,485 | 0,385 | 0,0004 | 0,0023 | 16,0 | ||
| 60 | 30 |
CO32- |
3,450 | 0,115 | 0,0001 | 0,0003 | 6,07 | ||||||
| 96 | 48 |
SO42- |
17,3 | 0,36 | 0,0002 | 0,0017 | 41,3 | 0,86 | 0,0004 | 0,0041 | 52,42 | ||
| 35,46 | 35,46 |
Cl- |
37,43 | 1,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 75,28 | ||
| Сумма An | 4,69 | 2,486 | |||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
|
|||||||||
|
NH4+, мг/л |
0,3 | моль/л | 0,004 |
|
|||||||||
|
NO2-, мг/л |
0,011 | f' | 0,934 |
|
|||||||||
|
NO3-, мг/л |
0,055 | f'' | 0,761 |
|
|||||||||
| Fe, мг/л | 0,03 |
СО2 моль/л |
0,0005 |
|
|||||||||
| P, мг/л | 0,022 | pH | 9,816 |
|
|||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 1,969 |
|
|||||||||
|
БО, мгО2/л |
5,35 | CC, расчетное значение мг/л | 149,792 |
|
|||||||||
|
ПО, мгО2/л |
2,0 | Электропроводность, СfмкСм/см | 278,574 |
|
|||||||||
|
Dk,мг-экв/л |
0,5 |
|
|||||||||||
|
Dи,мг-экв/л |
3,481 |
|
|||||||||||
| Иизв,мг-экв/л | 0,07 |
|
|||||||||||
|
DCaCl2,мг-экв/л |
0 |
|
|||||||||||
Коагуляция и известкование исходной воды (карбонатный режим)
В качестве коагулянта используется сернокислое железо, доза которого Dk = 0,5 мг-экв/л.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост = ![]() мг-экв/л.
мг-экв/л.
Концентрацию магния не изменяется.
Остаточная концентрация кальция рассчитывается из закона электронейтральности (концентрация ионов магния и натрия не изменяется):
Карбонатный режим применяют: 1) когда вынужденно приходится использовать в качестве коагулянта сернокислый алюминий; 2) при необходимости исключить выделение магниевых соединений, чтобы в случае соблюдения определённых гидравлических условий получать при известковании крупнокристаллический осадок. При карбонатном режиме несколько уменьшается расход извести (по сравнению с гидратным режимом).
Таблица 5
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После известкования и содирования | Электропровод- | |||||||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность,мкСм/см | ||||||||
| 40,08 | 20,04 | Ca2+ | 65,606 | 3,274 | 0,0016 | 0,0066 | 1,922 | 0,096 | 0,00005 | 0,0002 | 4,54 | |||||||
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 0,0004 | 0,0011 | 5,185 | 0,432 | 0,0002 | 0,0005 | 21,64 | |||||||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 2,238 | 0,0005 | 0,0012 | 105,89 | |||||||
| 1 | 1 | H+ | ||||||||||||||||
| Сумма Kt | 4,69 | 8,199 | ||||||||||||||||
| 17 | 17 | OH- | 5,950 | 0,350 | 0,0004 | 0,0006 | 65,54 | |||||||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 0,0033 | 0,02 | 12,200 | 0,200 | 0,0002 | 0,0012 | 8,4 | |||||||
| 60 | 30 | CO32- | 9,000 | 0,300 | 0,0002 | 0,0009 | 16,53 | |||||||||||
| 96 | 48 | SO42- | 17,3 | 0,36 | 0,0002 | 0,0017 | 41,3 | 0,86 | 0,0004 | 0,0041 | 54,74 | |||||||
| 35,46 | 35,46 | Cl- | 37,43 | 1,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 76,1 | |||||||
| Сумма An | 4,69 | 2,766 | ||||||||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
|
||||||||||||||
| NH4+, мг/л | 0,3 | моль/л | 0,003 |
|
||||||||||||||
| NO2-, мг/л | 0,011 | f' | 0,944 |
|
||||||||||||||
| NO3-, мг/л | 0,055 | f'' | 0,795 |
|
||||||||||||||
| Fe, мг/л | 0,030 | СО2 моль/л | 0,0005 |
|
||||||||||||||
| P, мг/л | 0,022 | pH | 10,519 |
|
||||||||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 0,528 |
|
||||||||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 158,519 |
|
||||||||||||||
| ПО, мгО2/л | 42,0 | Электропроводность, СfмкСм/см | 353,369 |
|
||||||||||||||
| Dk,мг-экв/л | 0,5 |
|
||||||||||||||||
| Dи,мг-экв/л | 3,948 |
|
||||||||||||||||
| Иизв,мг-экв/л | 0,350 |
|
||||||||||||||||
| Dс,мг-экв/л | 1,722 |
|
||||||||||||||||
| DCaCl2,мг-экв/л | -0,689 |
|
||||||||||||||||
| Mg2+max | 0,403 |
|
||||||||||||||||
| Са2+мах | 0,088 |
|
||||||||||||||||
Коагуляция с известкованием и содированием исходной воды
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Происходящие при известково-содовом умягчении основные химические процессы описываются следующими уравнениями:
а2СО3 → 2 Nа+ + СО32-;
Са(ОН)2 → Са2+ +2ОН-;
СО2 + 2ОН- → СО32- + Н2О;
Н+ + ОН- → Н2О
НСО3- → Н+ + СО32-
НСО3- + ОН- = СО32- + Н2О;
Са2+ + СО32- → СаСО3↓;
Мg2+ + 2ОН- → Мg(ОН)2↓.
Приняв значение ОН- определяем остаточную концентрацию ионов кальция и магния. Концентрация сульфатов увеличивается на дозу коагулянта.
Т.о. остаточную концентрацию натрия определяем из закона электронейтральности.
Таблица 6
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После известкования с обескремниванием | Электропровод- | |||||||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность, мкСм/см | ||||||||
| 40,08 | 20,04 | Ca2+ | 65,606 | 3,274 | 0,0016 | 0,0066 | 33,328 | 1,663 | 0,00108 | 0,0033 | 74,53 | |||||||
| 24,03 | 12,01 | Mg2+ | 108 | 0,899 | 0,0004 | 0,0011 | 6,440 | 0,536 | 0,0003 | 0,0006 | 25,46 | |||||||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 0,517 | 0,0005 | 0,0012 | 24,12 | |||||||
| 1 | 1 | H+ | ||||||||||||||||
| Сумма Kt | 4,69 | 0,276 | ||||||||||||||||
| 17 | 17 | OH- | 5,100 | 0,300 | 0,0003 | 0,0005 | 55,42 | |||||||||||
| 61 | 61 | HCO3- | 1997 | 3,274 | 0,0033 | 0,02 | 23,485 | 0,385 | 0,0004 | 0,0023 | 15,96 | |||||||
| 60 | 30 | CO32- | 3,450 | 0,115 | 0,0001 | 0,0003 | 6,00 | |||||||||||
| 96 | 48 | SO42- | 17,3 | 0,36 | 0,00202 | 0,0017 | 41,3 | 0,86 | 0,0004 | 0,0041 | 51,85 | |||||||
| 35,46 | 35,46 | Cl- | 37,43 | 1,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 75,08 | |||||||
| Сумма An | 4,69 | 2,716 | ||||||||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
|
||||||||||||||
| NH4+, мг/л | 0,3 | моль/л | 0,004 |
|
||||||||||||||
| NO2-, мг/л | 0,011 | f' | 0,932 |
|
||||||||||||||
| NO3-, мг/л | 0,055 | f'' | 0,753 |
|
||||||||||||||
| Fe, мг/л | 0,03 | СО2 моль/л | 0,00052 |
|
||||||||||||||
| P, мг/л | 0,022 | pH | 10,446 |
|
||||||||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 2,199 |
|
||||||||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 157,317 |
|
||||||||||||||
| ПО, мгО2/л | 2,0 | Электропроводность, СfмкСм/см | 328,418 |
|
||||||||||||||
| Dk,мг-экв/л | 0,5 |
|
||||||||||||||||
| Dи,мг-экв/л | 3,711 |
|
||||||||||||||||
| Иизв,мг-экв/л | 0,300 |
|
||||||||||||||||
| DCaCl2,мг-экв/л | 0,689 |
|
||||||||||||||||
| Mg2+max | 0,493 |
|
||||||||||||||||
Вывод: Для данных вод с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальной схемой предочистки является К+Иг+Ф и К+Иб+Ф.
Коагуляция с известкованием и магнезиальным обескремниванием исходной воды
Основным из числа методов магнезиального обескремнивания воды является метод обескремнивания каустическим магнезитом. Одновременно с обескремниванием воды проводят её известкование и коагуляцию.
Известкование при магнезиальном обескремнивании производится для того, чтобы снизить щёлочность воды и создать должную величину рН. При рН<10удаление кремнекислых соединений будет затруднено из-за недостаточной диссоциации Н2SiО3. Кроме того, вследствие низкой концентрации в воде ионов ОН- обескремнивающий реагент будет взаимодействовать с бикарбонат-ионами исходной воды, свободной угольной кислотой, а также введённым в воду коагулянтом:
МgО + Н2О → Мg(ОН)2 → Мg2+ + 2ОН-;
ОН- + Н+ → Н2О;
НСО3- → СО32- + Н+;
СО2 + Н2О → Н2СО3 → Н+ + НСО3- → 2 Н+ + СО32-;
СО32- + Са2+ → СаСО3↓;
2 ОН- + Fе2+ → Fе(ОН)2.
Экспериментальные данные подтверждают, что обескремнивание наиболее эффективно происходит в узком интервале величин рН=10,1 – 10,3, достигая в отдельных случаях 10,4. Оптимум рН несколько различен для разных вод.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
При расчёте данной таблицы использовали коагулянт FeSO4, доза которого Dk = 0,5 мг-экв/л, остаточную концентрацию кальция определяем из закона электронейтральности.
Таблица 7
| Обозначение | Ед. изм. | Числ. Знач. |
| N | МВт | 210 |
| Qдв=(Q01+Q02+Q03+Q04+Q05) | т/ч | 215.6 |
| Q01=nrD1 | т/ч | 126.63 |
| Q02 | т/ч | 25 |
| Q03=0,12*0,15*0,7*n*N | т/ч | 42.34 |
| Q04=nr1D1z | т/ч | 2.01 |
| Q05=0,1*(Q01+Q02+Q03+Q04) | т/ч | 19.6 |
| D1 | т/ч | 670 |
| n | шт | 6 |
| r | доли | 0.03 |
| X1 | доли | 0.05 |
| X | доли | 0.02 |
| r1 | доли | 0.03 |
| z | доли | 0.1 |
| Qдвб=(1+X) (1+X1)*Qдв | т/ч | 446,29 |
Вывод: Количество воды, поступающей в осветлители на обработку известью и другими реагентами составляет Qдвб=446,9 т/ч.
Расчет производительности ВПУ
Производительность ВПУ по обессоленной воде:
![]() ,
,
где ![]() - потеря
суммарной паропроизводительности парогенераторов, т/ч:
- потеря
суммарной паропроизводительности парогенераторов, т/ч:
![]() ,
,
r – доля потери пара и конденсата в контуре блока;
n=6 - количество энергоблоков на станции;
![]() -
паропроизводительность парогенератора, т/ч;
-
паропроизводительность парогенератора, т/ч;
![]() -
дополнительная производительность установки, зависящая от мощности блока, т/ч;
-
дополнительная производительность установки, зависящая от мощности блока, т/ч;
![]() -
дополнительная производительность ВПУ, связанная с возможной потерей конденсата
при разогреве мазута, т/ч. Для АЭС
-
дополнительная производительность ВПУ, связанная с возможной потерей конденсата
при разогреве мазута, т/ч. Для АЭС ![]() =0;
=0;
![]() - потери пара
конденсата, которые возникают в теплосетях, т/ч:
- потери пара
конденсата, которые возникают в теплосетях, т/ч:
![]() ,
,
z – доля потери конденсата в подогревателях воды тепловых сетей;
r1 – доля отбора пара на подогрев воды в тепловых сетях;
![]() -
дополнительная производительность для компенсации отпуска воды на другие
объекты, т/ч:
-
дополнительная производительность для компенсации отпуска воды на другие
объекты, т/ч:
![]()
Количество исходной воды, поступающей в осветлитель, т/ч:
![]()
х - доля потери воды с продувкой воды (при обезвоживании шлама и возврате фугата в осветлитель х=0);
х1 - доля потери на собственные нужды.
Таблица 8
| Расчет оборотной системы охлаждения | ||||||||
| Обознач. | Ед. изм. | Исх. вода | ОСО 1 | +H2SO4 | ОСО 2 | +H2SO4 | OCO 3 | |
| Ca2+ | мг-экв/л | 5,87 | Нецелесообразно, т.к концентрация HCO3- в исходной воде превышает нормированное значение 3 мг-экв/л | 5,87 | 39,09 | 5,87 | 41,36 | |
| Mg2+ | мг-экв/л | 2,96 | 2,96 | 19,75 | 2,96 | 20,89 | ||
| Na+ | мг-экв/л | 3,82 | 3,82 | 25,43 | 3,82 | 26,91 | ||
| ∑Кt | мг-экв/л | 12,65 | 12,65 | 84,27 | 12,65 | 89,16 | ||
| OH- | мг-экв/л | 0 | 0 | 0 | 0 | 0 | ||
| HCO3- | мг-экв/л | 5,09 | 0,45 | 3,00 | 0,45 | 6,00 | ||
| Cl- | мг-экв/л | 3,56 | 3,56 | 23,69 | 3,56 | 25,07 | ||
| SO42- | мг-экв/л | 4,00 | 8,64 | 57,58 | 8,64 | 58,10 | ||
| ∑An | мг-экв/л | 12,65 | 12,65 | 84,27 | 12,65 | 89,16 | ||
| µ | моль/л | 0,01907 | 0,14249 | 0,14934 | ||||
| f' | 0,8696305 | 0,72942858 | 0,72549367 | |||||
| f" | 0,571925 | 0,28309428 | 0,27703492 | |||||
| СО2р | моль/л | 0,00061 | 0,00049 | 0,00201 | ||||
| pHр | 7,3260001 | 7,11390278 | 6,80012363 | |||||
| Dк | 4,64149119 | 4,24 | ||||||
| p1 | 1,2 | 1,2 | ||||||
| p2 | 0,05 | 0,05 | ||||||
| p3 | 0,1619375 | 0,1483932 | ||||||
| ∆t | °С | 10 |
|
|||||
| К | 0,12 |
|
||||||
| Ку | 6,6620463 | 7,0485945 | ||||||
| Dпг | т/ч | 6160 | 6160 | |||||
| n | шт | 3 | 6 | |||||
| r | кДж/кг | 2424,34 | 2424,34 | |||||
| Dn | т/ч | 18480 | 18480 | |||||
| Dk | т/ч | 11088 | 11088 | |||||
| D3 | т/ч | 1731,5256 | 1586,70235 | |||||
| D3 | т/год | 12120679,6 | 11106916,4 | |||||
| D2 | т/ч | 534,627723 | 534,627723 | |||||
| D2 | т/год | 3742394,06 | 3742394,06 | |||||
| D1 | т/ч | 12831,0654 | 12831,0654 | |||||
| D1 | т/год | 89817457,5 | 89817457,5 | |||||
| Do | т/ч | 1069255,45 | 1069255,45 | |||||
| Добавочная вода | 15097,2187 | 14952,3954 | ||||||
| Ca2+*f''*SO42-*f" | 4,51E-05 | 4,61E-05 | ||||||
| ПРCaSO4 | 2,50E-05 | 2,50E-05 | ||||||
| -80,41826 | -84,43813 |
|
||||||
| Обознач. | Ед. изм. | Исх. вода | Изв г.р. | +H2SO4 | ОСО 4 | Изв б.р. | +H2SO4 | ОСО 4 | Изв с. | +H2SO4 |
| Ca2+ | мг-экв/л | 5,87 | 3,62 | 3,62 | 60,78 | 1,07 | 1,07 | 26,75 | 0,10 | 0,10 |
| Mg2+ | мг-экв/л | 2,96 | 0,65 | 0,65 | 10,89 | 2,96 | 2,96 | 74,10 | 0,43 | 0,43 |
| Na+ | мг-экв/л | 3,82 | 3,82 | 3,82 | 64,16 | 3,82 | 3,82 | 95,44 | 7,60 | 7,60 |
| ∑Кt | мг-экв/л | 12,65 | 8,08 | 8,08 | 135,829 | 7,85 | 7,85 | 196,29 | 8,13 | 8,13 |
| OH- | мг-экв/л | 0 | 0,30 | 0,00 | 0,00 | 0,07 | 0,00 | 0,00 | 0,35 | 0,00 |
| HCO3- | мг-экв/л | 5,09 | 0,50 | 0,36 | 6,00 | 0,50 | 0,24 | 6,00 | 0,50 | 0,24 |
| Cl- | мг-экв/л | 3,56 | 2,78 | 2,78 | 46,72 | 2,78 | 2,78 | 69,49 | 2,78 | 2,78 |
| SO42- | мг-экв/л | 4,00 | 4,50 | 4,95 | 82,11 | 4,50 | 4,83 | 120,80 | 4,50 | 5,11 |
| ∑An | мг-экв/л | 12,65 | 8,08 | 8,08 | 135,83 | 7,85 | 7,85 | 196,29 | 8,13 | 8,13 |
| µ | моль/л | 0,01907 | 0,21322 | 0,307 | ||||||
| f' | 0,8696305 | 0,6951114 | 0,663 | |||||||
| f" | 0,571925 | 0,2334628 | 0,1935 | |||||||
| СО2р | моль/л | 0,00061 | 0,00229 | 0,00076 | ||||||
| pHр | 7,326 | 6,726 | 7,187021 | |||||||
| Dк | 0,44 | 0,33 | 0,61 | |||||||
| p1 | 1,2 | 1,2 | ||||||||
| p2 | 0,05 | 0,05 | ||||||||
| p3 | 0,026 | 0 | ||||||||
| ∆t | °С | 10 | ||||||||
| К | 0,12 | |||||||||
| Ку | 16,807 | 25 | ||||||||
| Dпг | т/ч | 6160 | 6160 | |||||||
| n | шт | 3 | 3 | |||||||
| r | кДж/кг | 2424,34 | 2424,34 | |||||||
| Dn | т/ч | 18480 | 18480 | |||||||
| Dk | т/ч | 11088 | 11088 | |||||||
| D3 | т/ч | 277,1124 | 0 | |||||||
| D3 | т/год | 1939786,7 | 0 | |||||||
| D2 | т/ч | 534,62772 | 534,628 | |||||||
| D2 | т/год | 3742394,1 | 3742394,1 | |||||||
| D1 | т/ч | 12831,065 | 12831,065 | |||||||
| D1 | т/год | 89817457,5 | 89817457 | |||||||
| Do | т/ч | 1069255,4 | 1069255,4 | |||||||
| Добавочная вода | 13642,805 | 13365,693 | ||||||||
| Ca2+*f''*SO42-*f" | 6,88E-05 | 3,03E-05 | ||||||||
| ПРCaSO4 | 2,50E-05 | 2,50E-05 | ||||||||
| 16,81 | 25 |
Вывод: оптимальным является режим с минимальной величиной продувки, в данном случае - бикарбонатный режим известкования и известкование с содированием.
Оборотные системы охлаждения (ОСО)
Расчет потерь воды в ОСО
В
результате циркуляции по замкнутому циклу в системе охлаждения часть оборотной
воды выводится из системы вследствие испарения ![]() , часть выносится из градирни в
виде капельного уноса
, часть выносится из градирни в
виде капельного уноса ![]() и, наконец, еще одна ее часть
выводится из системы в виде продувки или на технологические нужды
и, наконец, еще одна ее часть
выводится из системы в виде продувки или на технологические нужды ![]() .
.
Коэффициент концентрирования не выпадающих в осадок солей:
![]() ,
,
![]()
где к зависит от температуры воздуха,
∆t -
охлаждение воды в градирне, принимается 5-10![]() .
.
![]() выбирается в
зависимости от вида градирни. Выбираем башенную градирню c каплеуловителем. Для
неё:
выбирается в
зависимости от вида градирни. Выбираем башенную градирню c каплеуловителем. Для
неё:
![]() =0,05.
=0,05.
![]() задаемся в
каждом случае отдельно.
задаемся в
каждом случае отдельно.
ОСО1
Т.к. концентрация НСО3- в исходной воде больше 3 мг-экв/л, расчет не производится, т.к. система является нецелесообразной
ОСО2
Для предупреждения выпадения гипса необходимо выдерживать такое неравенство:
Ca2+ < 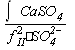 .
.
Где, CaSO4 = 2,5 10-5 (моль/кг)2.
Доза серной кислоты:
![]()
Рассчитываем
![]() для
данной системы охлаждения:
для
данной системы охлаждения:
![]()
![]()
![]() .
.
![]()
ОСО3
Добавляем
оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок ![]() :
:
![]() <2,5·10-5
<2,5·10-5
(табличное значение),значит не выпадет.
Рассчитываем
![]() для
данной системы охлаждения:
для
данной системы охлаждения:
Доза серной кислоты:
![]()
ОСО4
Добавляем
оксиэдилдифосфоновую (ОЭДФК) и серную кислоты. Проверяем выпадет ли в осадок ![]() :
:
![]() <2,5·10-5
<2,5·10-5
(табличное значение),значит не выпадет.
Добавляем
известь и серную кислоту, проверяем, выпадет ли в осадок ![]() .
.
![]() <2,5·10-5
<2,5·10-5
(табличное значение),значит не выпадет.
Рассчитываем
![]() для
данной системы охлаждения:
для
данной системы охлаждения:
![]()
Таблица 9
| Поверочный расчёт производительности осветлителя | ||
| 4 осветлителя 250-И | ||
| Обознач. | Ед. изм. | Числ. Знач. |
| Qр | т/ч | 253.46 |
| Fкс | м2 | 53,00 |
| Vo | мм/с | 1,33 |
| Co | мг/л | 0,109 |
| П | м | 3 |
| aс | 0,907 | |
| Hc | м | 2,3 |
| aк | % | 6,17 |
| Dк | мг-экв/л | 0,567 |
| Э | 36 | |
| ГДПбв | мг/л | 330,94 |
| ГДП | мг/л | 11 |
| ГДПнк | мг/л | -140,15 |
| ГДПк | мг/л | 460 |
| Vy | мм/с | 2,15 |
| t | °C | 20 |
Вывод: т.к.,(|898.2- 250*4|/898.2)*100= 11.34 % выбранные осветлители 250-И подходят по производительности.
Поверочный расчет осветлителя
Выбор осветлителя: необходимо выбирать не менее двух одинаковых осветлителей (т.к. обязательно нужен резервный на случай выхода из строя одного из осветлителей) и не более трех, т.к. на их обслуживание идут большие экономические затраты.
Выбираем 4 осветлителя 250-И.
Производительность
осветлителя, ![]() :
:
![]() .
.
где ![]() - площадь
поперечного сечения зоны контактной среды,
- площадь
поперечного сечения зоны контактной среды, ![]() :
:
![]() =11
=11![]() ,
,
![]() - расчетная
скорость восходящего движения воды на выходе из контактной зоны осветлителя,
- расчетная
скорость восходящего движения воды на выходе из контактной зоны осветлителя, ![]() :
:
![]() :
:
где ![]() - условная
скорость свободного осаждения шлама, мм/с (находим по
- условная
скорость свободного осаждения шлама, мм/с (находим по ![]() ):
):
![]()
где ![]() - доза
коагулянта, мг-экв/л,
- доза
коагулянта, мг-экв/л,
Э эквивалент коагулянта,
t
температура воды в интервале ![]() С;
С;
![]() - объемная
концентрация шлама в зоне контактной среды осветлителя, мл/мл:
- объемная
концентрация шлама в зоне контактной среды осветлителя, мл/мл:
 ,
,
где П прозрачность воды по кресту, см:
П=300![]() ,
,
![]() =1 (по диаметру
осветлителя),
=1 (по диаметру
осветлителя),
Приведенная высота зоны контактной среды осветлителя, м:
![]() =1,8 м,
=1,8 м,
![]() - суммарное
количество грубодисперсных примесей, поступающих в осветлитель и образующихся в
нем, мг/л.
- суммарное
количество грубодисперсных примесей, поступающих в осветлитель и образующихся в
нем, мг/л.
Выбранный осветлитель 250-И подходит нам по производительности.
Выводы: Для данной исходной воды с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальным является гидратный режим известкования (стр 31[1]), при котором величина продувки имеет минимальное значение и затраты на реагенты меньшие.
Список использованной литературы
1. Кишневский В.А. Современные методы обработки воды в энергетике: Учебное пособие. - Одесса: ОГПУ,1999-196 с.
2. Громогласов А.А., Копылов А.С., Пильщиков А.П. Водоподготовка: Процессы и аппараты: Учеб. пособие для вузов.-М.: Энергоатомиздат,1990-272с.
3. Кульский Л.А., Строкач П.П. Технология очистки природных вод.-Киев: Вища школа. Головное изд-во,1981.-328 с.
4. Стерман Л.С. и др.Тепловые и атомные электростанции: Учебник для вузов.- М.: Энергоиздат,1982.-456 с., ил.
© 2009 База Рефератов