
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: ЭМА без применения электролиза, кондуктометрия прямая и косвенная (кондуктометрическое титрование)
Реферат: ЭМА без применения электролиза, кондуктометрия прямая и косвенная (кондуктометрическое титрование)
ЭМА без применения электролиза, кондуктометрия прямая и косвенная (кондуктометрическое титрование)
Электpохимические методы анализа (ЭМА) основаны на процессах, пpотекающих на электpодах или межэлектpодном пpостpанстве. ЭМА являются одними из стаpейших ФХМА (некотоpые описаны в конце 19 века). Их достоинством является высокая точность и сpавнительная пpостота как обоpудования, так и методик анализа. Высокая точность опpеделяется весьма точными закономеpностями используемыми в ЭМА, напpимеp, закон Фаpадея. Большим удобством является то, что в ЭМА используют электpические воздействия, и то, что pезультат этого воздействия (отклик) тоже получается в виде электрического сигнала. Это обеспечивает высокую скоpость и точность отсчета, откpывает шиpокие возможности для автоматизации. ЭМА отличаются хорошей чувствительностью и селективностью, в pяде случаев их можно отнести к микpоанализу, так как для анализа иногда достаточно менее 1 мл pаствоpа.
Инстpументом для ЭМА служит электpохимическая ячейка, пpедставляющая собой сосуд с pаствоpом электpолита, в котоpый погpужены как минимум два электpода. В зависимости от решаемой задачи pазличными могут быть фоpма и матеpиал сосуда, число и пpиpода электpодов, pаствоpа, условия анализа (пpилагаемое напpяжение (ток) и регистрируемый аналитический сигнал, температура, перемешивание, продувка инертным газом и т.п.). Опpеделяемое вещество может входить как в состав электpолита, заполняющего ячейку, так и в состав одного из электpодов. Если аналитическая окислительно-восстановительная реакция протекает на электродах ячейки самопроизвольно, то есть без приложения напряжения от внешнего источника, а только за счет разности потенциалов (ЭДС) ее электродов, то такую ячейку называют гальваническим элементом. При необходимости ячейку можно подсоединить к внешнему источнику напряжения. В этом случае, приложив достаточное напряжение, можно изменить направление окислительно-восстановительной реакции и тока на противоположное тому, что имеет место в гальваническом элементе. Окислительно-восстановительную реакцию, протекающую на электродах под действием внешнего источника напряжения, называют электролизом, а электрохимическую ячейку, являющуюся потребителем энергии, необходимой для протекания в ней химической реакции, называют электролитической ячейкой.
Полная электрическая цепь прибора для ЭМА состоит из внутренней цепи (электрохимической ячейки) и внешней цепи, включающей проводники, регуляторы тока (напряжения) и измерительные приборы.
По разновидностям аналитического сигнала ЭМА подразделяют на:
1) кондуктометрию - измерение электропроводности исследуемого раствора;
2) потенциометрию - измерение бестокового равновесного потенциала индикаторного электрода, для которого исследуемое вещество является потенциоопределяющим;
3) кулонометрию - измерение количества электричества, необходимого для полного превращения (окисления или восстановления) исследуемого вещества;
3) вольтамперометрию - измерение стационарных или нестационарных поляризационных характеристик электродов в реакциях с участием исследуемого вещества;
5) электрогравиметрию - измерение массы вещества, выделенного из раствора при электролизе.
ЭМА можно подразделить по признаку применения электролиза. На принципах электролиза базируются кулонометрия, вольтамперометрия и электрогравиметрия; электролиз не используют в кондуктометрии и потенциометрии.
ЭМА имеют самостоятельное значение для прямого проведения химического анализа, но могут применяться как вспомогательные в других методах анализа. Например, использоваться в титриметрии для регистрации конца титрования не с помощью химического цветопеременного индикатора, а по изменению потенциала, электрической проводимости тока и т.д.
Электрод представляет собой систему, в простейшем случае состоящую из двух фаз, из которых твердая обладает электронной, а другая - жидкая - ионной проводимостью. Твердая фаза с электронной проводимостью считается проводником I рода, а жидкая фаза с ионной проводимостью - II рода. При соприкосновении этих двух проводников происходит образование двойного электрического слоя (ДЭС). Он может быть результатом обмена ионами между твердой и жидкой фазами, или результатом специфической адсорбции катионов или анионов на поверхности твердой фазы при погружении ее в воду или раствор.
При ионном механизме образования ДЭС, например, в случае
когда химический потенциал атомов на поверхности металла (твердой фазы) больше
химического потенциала ионов в растворе, то атомы с поверхности металла будут
переходить в раствор в виде катионов: Me Mez+ + ze-.
Освободившиеся электроны при этом заряжают поверхность твердой фазы
отрицательно и за счет этого притягивают к поверхности положительно заряженные
ионы раствора. В результате на границе раздела фаз образуются два
противоположно заряженных слоя, являющихся как бы обкладками своеобразного
конденсатора. Для дальнейшего перехода заряженных частиц из одной фазы в другую
им необходимо совершить работу, равную разности потенциалов обкладок этого
конденсатора. В случае, если химический потенциал атомов на поверхности твердой
фазы меньше химического потенциала ионов в растворе, то катионы из раствора
переходят на поверхность твердой фазы, заряжая ее положительно: Mez++ze-Me. Как в первом, так и во втором случае указанные
процессы протекают не бесконечно, а до установления динамического равновесия,
которое можно изобразить обратимым редоксипереходом типа Мe - ![]() Мez+ или в
общем случае Ох +
Мez+ или в
общем случае Ох + ![]() Redz+.
Redz+.
Процессы, при которых отдача или присоединение электронов происходит на электродах, называются электродными.
Нернстом была получена формула, связывающая разность внутренних потенциалов ДЭС с активностями (концентрациями) частиц, участвующих в обратимом редоксипереходе:
![]() ,
,
где (Me) - потенциал заряженного слоя твердой фазы;
(раствор) - потенциал прилегающего к твердой фазе слоя раствора;
0 - константа, равная разности (Me)
- (р-р), при ![]() (Ох) =
(Ох) = ![]() (Red) = 1 моль/л;
(Red) = 1 моль/л;
R - универсальная газовая постоянная (8,31 Дж/К моль);
T - температура, К;
F - число Фарадея (96 488 Кл/моль);
Z - число электронов, участвующих в редоксипереходе; ![]() (Ох) и
(Ох) и ![]() (Red) - активности
окисленной (Ох) и восстановленной (Red) форм вещества в редоксипереходе, моль/л.
(Red) - активности
окисленной (Ох) и восстановленной (Red) форм вещества в редоксипереходе, моль/л.
Установить внутренние потенциалы отдельных фаз (Me) и (р - р), к сожалению, экспериментально нельзя. Любая попытка подключить раствор с помощью провода к измерительному устройству, вызывает появление новой поверхности соприкосновения фаз металл-раствор, то есть возникновение нового электрода со своей разностью потенциалов, влияющей на измеряемую.
Однако можно измерить разность (Me) - (р - р) с помощью гальванического элемента. Гальваническим элементом называется система, составленная из двух разных электродов, обладающая способностью самопроизвольно преобразовывать химическую энергию протекающей в нем окислительно-восстановительной реакции в электрическую энергию. Электроды, из которых составлен гальванический элемент, называются полуэлементами. Протекающая в гальваническом элементе окислительно-восстановительная реакция пространственно разделена. Полуреакция окисления протекает на полуэлементе, называемом анодом (отрицательно заряженном электроде), а полуреакция восстановления - на катоде.
Кондуктометрия - это метод, основанный на измерении электропроводности анализируемого раствора.
Электропроводностью W называют величину, обратную электросопротивлению R: W = 1/R, [Ом-1 = См (Сименс)].
Растворы электролитов, являясь проводниками II рода,
подчиняются закону Ома: R = U/I. Чтобы измерить сопротивление раствора, в него
погружают электроды и подают внешнее напряжение U. По аналогии с проводниками I
рода сопротивление раствора прямо пропорционально расстоянию между электродами
l и обратно пропорционально площади их поверхности S: ![]() , где - удельное
сопротивление, Ом/см;
, где - удельное
сопротивление, Ом/см;
= R при l = 1 cм и S = 1см2, т.е. - сопротивление 1 см3 (мл) раствора.
Величину, обратную , называют удельной электропроводимостью (): = 1/r, [Cм см-1]. Величина равна электропроводности 1 см3 (мл) раствора, находящегося между электродами с площадью поверхности 1 см2, удаленными друг от друг на расстоянии 1 см.
Из закона Ома следует, что численно равна току, проходящему через слой электролита с S = 1 см2 под действием градиента потенциала 1В на единицу длины.
Электрическая проводимость разбавленных растворов электролитов зависит от суммарного числа ионов в растворе (то есть концентрации) числа элементарных зарядов, переносимых каждым ионом (то есть заряда иона) и от скорости движения одинаково заряженных ионов к катоду или аноду под действием электрического поля. С учетом этих факторов электропроводящие свойства ионов характеризуются эквивалентной электропроводимостью (). Ею называют проводимостью раствора, содержащего 1 моль вещества эквивалента и находящегося между двумя параллельными электродами, расстояние между которыми 1 см.
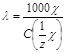 , [См см2/моль].
, [См см2/моль].
уменьшается с увеличением концентрации за счет увеличения межионных взаимодействий. В бесконечно разбавленных растворах приобретает постоянное и максимальное значение : = + + - , где + и - подвижность катионов и анионов раствора. Подвижность - это величина, относящаяся к эквиваленту иона (то есть частице с единичным зарядом, например, K+, ½ Mg2+, Al3+ и т.п.) и равна произведению абсолютной скорости движения иона на число Фарадея.
Ячейка для измерения электрической проводимости состоит из двух параллельных пластинчатых платиновых электродов, впаянных в стеклянный сосуд, на некотором расстоянии друг от друга.
При измерении электропроводности прохождение тока вызывает химические реакции (электролиз), которые могут производить изменение состава раствора у электрода и вызывать поляризацию электродов. Это может являться источником погрешностей при измерениях. Во избежание этого электропроводность измеряют при переменном токе. Незначительная поляризация постоянно уничтожается при перемене направления тока. Поляризацию уничтожает также платинирование электродов, т.е. покрытие их тонкоизмельченной платиной (платиновой чернью), увеличивающей поверхность электродов.
Обычной аппаратурой для измерения сопротивления, а следовательно, и электропроводности является мостик Уитстона. Метод для измерения электропроводности с переменным током был впервые применен Кольраушем и носит его имя. Схема прибора Кольрауша приведена на рис.2.10.1. Сосуд для измерения электро-проводности раствора образует одно плечо мостика с сопротивлением RX, постоянное сопротивление RM (магазин сопротивлений) образует другое, калиброванная проволока "аb" с движком "с" образует третье (R2) и четвертое (R3) плечи мостика.
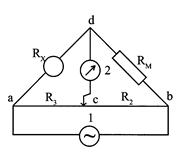
Рис. 1. Схема прибора Кольрауша для измерения электропроводности растворов.
Положение передвижного контакта "с" подбирается так, чтобы нуль-инструмент 2 не показывал ток (или ток был минимален), тогда сопротивление ячейки RX можно рассчитать по формуле
![]() .
.
Неизвестную электропроводимость раствора находят так:
![]() .
.
Промышленностью выпускаются различные приборы для измерения электропроводимости, в том числе и с цифровой индикацией "Импульс", КЛ-1.
Экспериментально измеряемая величина сопротивления раствора зависит от многих факторов, не всегда поддающихся точному учету (размера электродов, их формы, взаимного расположения и мн. др.). Поэтому истинная электрическая проводимость раствора х связана с экспериментальной I посредством поправочного коэффициента К, называемого константой сосуда: = КI. К находят экспериментально с помощью стандартных растворов с известными в широкой области t и с. Обычно в качестве стандартного раствора используют водные растворы KCl.
Различают прямую и косвенную кондуктометрию.
Прямая кондуктометрия (ПК) является неселективным методом анализа - все виды подвижных ионов, находящихся в растворе (или другой исследуемой среде) вносят свой вклад в электропроводность и по измеренным значениям нельзя выявить долю участия отдельных видов. Поэтому ПК используют для определения общей концентрации ионов в растворе, например при непрерывном или периодическом анализе растворов в производственных процессах, степени минерализации природных вод, при контроле процессов промывания осадков и материалов, качества воды после очистки или перегонки. В практической работе обычно используют градуированные графики зависимости электропроводности растворов от концентрации тех или иных электролитов. Малая эффективность является существенным ограничением метода ПК.
Более широко применяется косвенная кондуктометрия - кондуктометрическое титрование (KT). КТ основано на заметном изменении характера зависимости электропроводности раствора от количества добавляемого титранта вблизи точки эквивалентности вследствие изменения ионного состава раствора. КТ применяют для установления конца кислотно-основного, окислительно-восстановительного, осадительного титрования мутных или окрашенных растворов, когда обычные химические цветопеременные индикаторы использовать нельзя. К достоинству метода относится возможность титрования очень разбавленных растворов (меньше 10-4 моль/л) с погрешностью, не превышающей 2%.
Применение кондуктометрического титрования при реакции нейтрализации основано на значительно большей величине подвижностей ОН - и Н+ - ионов по сравнению с подвижностями ионов металла и кислотного остатка. Например, до начала титрования сильноразбавленного раствора гидролиза натрия его эквивалентная электропроводность равна сумме подвижностей ионов Na+ и ОН-, составляет:
(NaOH) = (Na+) +(OH-) = 50+199=249 [См см2/моль].
В момент полной нейтрализации щелочи (ТЭ), например соляной кислотой, в растворе имеются только ионы Na+ и Cl - и эквивалентная электропроводность раствора равна
(NaCl) =50+76.4=126.4 [См см2/моль].
Следовательно, в процессе титрования электропроводность раствора изменяется от 249 до 126,4 См см2/моль. При перетитровании кислотой электропроводность раствора снова начинает расти и равна:
350+76,4+50+76,4 = 553,8 См см2/моль.
Кривая титрования гидроксида натрия соляной кислотой имеет вид (рис. 2):
Аналогичные процессы приводят к этому же виду кривые титрования других сильных оснований сильными кислотами или наоборот. При титровании слабых оснований (слабых кислот) сильными кислотами (сильными основаниями), вследствие слабой диссоциации веществ титруемых растворов и связывании в воду Н+ и ОН - ионов, добавляемых с титрантом, электропроводность до точки эквивалентности растет очень слабо. Избыток титранта после ТЭ - приводит к появлению в титруемом растворе несвязанных Н+(ОН-) ионов и к резкому росту электропроводности (рис. 3).
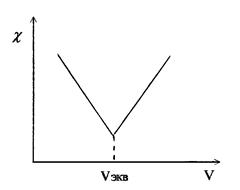
Рис. 3. Вид кривой кондуктометрического титрования сильных кислот оснований) сильными основаниями (кислотами).
При титровании смеси сильной и слабой кислот (основания) описанные выше процессы приводят к двум изломам на кривой титрования, позволяющим зафиксировать обе ТЭ (рис. 4).
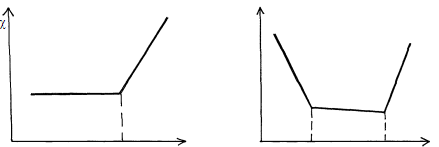
Vэкв Vэкв. сил. Vэкв. сл.
Рис. 4. Вид кривых кондуктометрического титрования: а - слабой кислоты (основания) сильным основанием (кислотой); б - смеси слабой и сильной кислот (оснований) сильным основанием (кислотой).
Различия в подвижностях ионов позволяет проводить их кондуктометрическое определение титрованием.
Высокочастотное кондуктометрическое титрование - одна из разновидностей КТ. Установки для высокочастотного титрования во многом отличаются от установок обычной низкочастотной кондуктометрии.
Ячейка с анализируемым раствором при высокочастотном титровании помещается или между пластинками конденсатора, или внутри индукционной катушки. Соответственно этому в первом случае ячейку называют конденсаторной или емкостной, или С-ячейкой, а во втором - индуктивной или L-ячейкой (рис. 5).
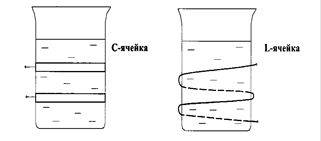
Р и с. 5. Схемы установок для высокочастотного кондуктометрического титрования: С - ячейка; L - ячейка.
В ячейках высокочастотного титрования электроды не соприкасаются с исследуемым раствором, что является одним из существенных достоинств метода, позволяющих анализировать высокоагрессивные растворы.
Изменения в ячейке, происходящие в результате реакции титрования, вызывают изменения в режиме работы высокочастотного генератора. Индуктивная L-ячейка с анализируемым раствором включается в цепь колебательного контура (помещается внутрь катушки индукции).
Изменение состава раствора при титровании в такой ячейке вызывает изменение индуктивности, что легко фиксируется микроамперметром через несложную схему. В конденсаторных С-ячейках при титровании раствора вследствие изменения диэлектрической проницаемости происходит сдвиг рабочей частоты генератора, что устанавливается с помощью измерительного конденсатора. При построении кривой титрования показания прибора откладывают как функцию объема добавленного титранта. Промышленностью выпускаются стандартные высокочастотные титраторы.
© 2009 База Рефератов