
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Непредельные углеводороды ряда ацетилена (алкины)
Реферат: Непредельные углеводороды ряда ацетилена (алкины)
Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов). Это видно из сравнения числа атомов водорода в ряду:
С2Н6 C2H4 С2H2
этан этилен ацетилен
(этен) (этин)
Алкины образуют свой гомологический ряд с общей формулой, как и у диеновых углеводородов СnH2n-2
1. Строение алкинов
Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
Н—СºС—Н или Н:С:::С:Н
структурная электронная
формула формула
По названию первого представителя этого ряда — ацетилена эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной s- и двух p-связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль. Модели пространственного строения ацетилена представлены на рис. 1.
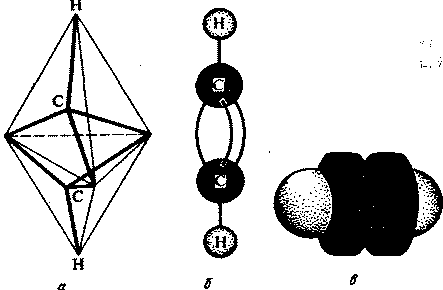
Рис.1. Модели пространственного строения молекулы ацетилена:
а - тетраэдрическая; б - шаростержневая; в -по Бриглебу
2. Номенклатура и изомерия
Номенклатура. По систематической номенклатуре ацетиленовые углеводороды называют, заменяя в алканах суффикс -ан на суффикс -ин. В состав главной цепи обязательно включают тройную связь, которая определяет начало нумерации. Если молекула содержит одновременно и двойную, и тройную связи, то предпочтение в нумерации отдают двойной связи:
СН3
|
Н—СºС—СН2—СН3 Н3С—СºС—СН3 Н2С=С—СН2—СºСН
бутин-1 бутин-2 2-метилпентен-1-ин-4
(этилацетилен) (диметилацетилен)
По рациональной номенклатуре алкиновые соединения называют, как производные ацетилена.
Непредельные (алкиновые) радикалы имеют тривиальные или систематические названия:
Н—СºС - этинил;
НСºС—СН2— -пропаргил
Изомерия. Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
Н—СºС—СН—СН3 Н—СºС—СН2—СН2—СН3 Н3С—С=С—СН2—СН3
|
СН3
3-метилбутин-1 пентин-1 пентин-2
3. Получение алкинов
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
1. Высокотемпературным разложением (крекинг) природного газа метана:
2СН4 1500°C® НСºСН + 3Н2
или этана:
С2Н6 1200°C® НСºСН + 2Н2
2. Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C® CaC2 + CO
СаС2 + 2Н2O ® НСºСН + Са(ОН)2
3. В лаборатории производные ацитилена можно синтезировать из дигалогенопроизводных, содержащих два атома галогена при одном или соседних углеродных атомах, действием спиртового раствора щелочи:
Вr
|
Н3С—СН—СН—СН3 + 2КОН ® Н3С—СºС—СН3 + 2KBr + 2Н2О
|
Br
2,3-дибромбутан бутин-2
(диметилацетилен)
4. Физические и химические свойства
физические свойства. Ацетиленовые углеводороды, содержащие в молекуле от двух до четырех углеродных атомов (при обычных условиях), — газы, начиная с C5H8 — жидкости, а высшие алкины (с С16Н30 и выше) — твердые вещества. Физические свойства некоторых алкинов показаны в табл. 1.
Таблица 1. Физические свойства некоторых алкинов
| Название | Формула |
t пл,°С |
t кип,°С |
d204 |
| Ацетилен (этан) | HCºCH | - 81,8 | -84,0 | 0,6181* |
| Метилацетилен (пропин) |
НСºС—СН3 |
-101,5 | -23,2 | 0,7062** |
| Этилацетилен (бутин-1) |
НСºС—С2Н5 |
-125,7 | +8,1 | 0,6784 |
|
симм-Диметилацетилен (бутин-2) |
Н3C—CºС—CH3 |
-32,3 | +27,0 | 0,6510 |
| Пропилацетилен (пентин-1) |
НСºС— (СН2)2—СН3 |
-90,0 | +40,2 | 0,6900 |
| Метилэтилацетилен (пентин-2) |
Н3С—СºС—С2Н5 |
-101,0 | +56,1 | 0,7107 |
| Бутилацетилен (гексин-1) |
НСºС— (СН2)3—СН3 |
-131,9 | +71,3 | 0,7155 |
*При температуре -32 °С,
**При температуре- 50 °С.
Химические свойства. Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Реакции присоединения. Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, — в одинарную. Казалось бы, алкины, обладая двумя p-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
1. Гидрирование. Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем — алканы:
H2 H2
HCºCH —® H2C=CH2 —® H3C—CH3
ацетилен этилен этан
2. Галогенирование. Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит сту пенчато:
Br2 Br2
HCºCH —® CHBr=CHBr —® CHBr2—CHBr2
1,2-дибромэтан 1,1,2,2-тетрабромэтан
3. Гидрогалогенирование. Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HCl
HCºCH + HCl —® H2C=CHCl —® H3C—CHCl2
хлорэтен 1,1-дихлорэтан
(хлористый винил)
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
4. Присоединение воды (реакция М.Г.Кучерова,. 1881). Катализатор — соль ртути:
HgSO4 é ù
HCºCH + HOH ——® ú H2C=CH—OHú ® H3C—C=O
ë û \ H
виниловый уксусный
спирт альдегид
(промежуточный
неустойчивый продукт)
Неустойчивое промежуточное соединение — виниловый спирт перегруппировывается в уксусный альдегид.
5. Присоединение синильной кислоты:
НСºСН + HCN кат.® H2C=CH—CN
акрилонитрил
Акрилонитрил — ценный продукт. Он используется в качестве мономера для получения синтетического волокна — нитрон.
6. Присоединение спирта. В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
НСºСН + HO—C2H5 KOH® H2C=CH—O—C2H5
этилвиниловый эфир
Присоединение спиртов в присутствии алкоголятов — типичная реакция нуклеофильного присоединения.
Реакции замещения. Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена — ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С—H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H ® CºC ¬ H
Но эта "подвижность", конечно, несравнима со "свободой" протона в настоящих кислотах: соляная кислота, например, почти в 1033 раз сильнее по кислотности, чем ацетилен. Но и такая подвижность водорода достаточна, чтобы произошла его замена на металл в щелочной средe. Так, при действии на ацетилен аммиачного раствора оксида серебра образуется ацетиленид серебра:
HCºCH + 2[Ag(NH3)2]OH ® Ag—CºC—Ag + 4NH3 + 2H2O
ацетиленид серебра
С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Реакция изомеризации. Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:
Н3С—СН2—СºСН Na(спирт р-р)® Н3С—СºС—СН3
бутин-1 бутин-2
Реакции полимеризации. Ацетилен в зависимости от условий реакции способен образовывать различные продукты полимеризации — линейные или циклические:
Cu2Cl2
НСºСН + НСºСН —®НСºСН—CН=CH2
80°C
винилацетилен
(бутен-1-ин-3)
Эти вещества представляют большой интерес. Например, при присоединении к винилацетилену хлороводорода образуется хлоропрен, который в качестве мономера используется в производстве хлоропренового каучука:
Н2С=СН—CºCH + 2HCl ® Н2С=С—СН==СН2
|
С1
винилацетилен хлоропрен
Реакция окисления. Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается. Эта реакция является качественной на кратные (двойные и тройные) связи:
3НСºСН + 10KMnO4 + 2H2O ® 6CO2 + 10КОН + 10MnO2
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
2НСºСН + 5O2 ® 4СO2 + 2Н2O
При неполном сгорании образуется углерод (сажа):
НСºСН + O2 ® С + СО + Н2О
5. Отдельные представители
Ацетилен (этин) НСºСН — бесцветный газ, без запаха (технический ацетилен имеет неприятный запах, что объясняется присутствием различных примесей). Ацетилен мало растворим в воде, хорошо — в ацетоне. На воздухе горит сильно коптящим пламенем [ высокое (в процентах) содержание углерода в молекуле]. При горении в кислороде ацетилен создает высокотемпературное пламя (до 3000 °С). Это используется для сварки и резки металлов. Смеси ацетилена с кислородом или воздухом взрывоопасны, поэтому ацетилен хранят и транспортируют в специальных баллонах (маркировка: белый баллон с красной надписью "Ацетилен"). Этот баллон заполняют пористым материалом, который пропитывают ацетоном.
Ацетилен — ценный продукт для химической промышленности. Из него получают синтетический каучук, уксусный альдегид и уксусную кислоту, этиловый спирт и многие другие вещества.
Винилацетилен (бутен-1-ин-3) НСºC—СН=CН2 — газ с неприятным запахом. При восстановлении образует бутадиен-1,3, а при присоединении хлороводорода 2-хлорбутадиен-1,3 (хлоропрен).
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://chemistry.narod.ru/
© 2009 База Рефератов