
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Учебное пособие: Химическая связь
Учебное пособие: Химическая связь
Лекция № 4 и 5
Химическая связь
I. Ионная
II. Ковалентная.
III. Координационная.
IV. Металлическая.
V. Водородная.
VI. Межмолекулярная.
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Основным условием образования химической связи является понижением полной энергии многоатомной системы по сравнению с энергией изолированных атомов, т.е. ЕАВ<ЕА+ЕВ в случае образования вещества АВ из А и В. Более точно химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков, и сопровождается уменьшением полной энергии системы.
Основными параметрами химической связи является её длина, прочность и валентные углы, характеризующие строение веществ, которые образованы из отдельных атомов.
Длина связи – это межъядерное расстояние между химическими связанными атомами.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется валентным углом. Энергия связи – энергия, необходимая для разрыва такой связи.
I. Для объяснения ионной связи необходимо уяснить себе следующие понятия:
Потенциал ионизации энергия, которую необходимо затратить для удаления 1-го электрона с внешней орбитали, при этом атом переходит из нейтрального в положительно заряженный ион (катион).
Чем меньше потенциал ионизации, тем легче атом теряет электроны, тем сильнее выражены у электрона металлические свойства. Потенциал ионизации растет в пределах периода слева направо, уменьшается сверху вниз.
Атом может не только
терять электроны, но и присоединять. Энергия, которая выделяется при
присоединении электронов к атому, называется сродством к электрону. Чем больше
эта энергия, тем более неметалл этот элемент. Сродство к электрону увеличивается
слева направо, уменьшается сверху вниз. Условная величина, характеризующая
способность атома притягивать к себе электроны называется
электроотрицательностью. Она равна полусумме потенциала ионизации и энергии
сродства к электрону: ![]() (
(![]() ядра). Электроотрицательность
растет слева направо и уменьшается сверху вниз (увеличение числа электронных
оболочек). Наиболее электроотрицательный элемент –
ядра). Электроотрицательность
растет слева направо и уменьшается сверху вниз (увеличение числа электронных
оболочек). Наиболее электроотрицательный элемент – ![]() .
.
В зависимости от величины электроотрицательности все элементы делятся на:
1. электроположительные (элементы 1-3 группы)
2. электротрицательные (все остальные элементы)
Ионная связь образуется между элементами сильно отличающимися по электроотрицательности, а именно DЭ>1,9.
Полинг ввел шкалу электроотрицательности.
Ионная связь образуется за счет перехода одного или нескольких электронов от одного атома на внешнюю оболочку другого атома.
Атом, отдавший электрон
становится положительно заряженным, а получивший – отрицательно заряженный.![]()
Связь между разноименными ионами осуществляется за счет сил электростатического притяжения.
Образование ионной связи происходит по октаэдрическому правилу. Согласно этому правилу атом принимает, теряет или разделяет электроны таким образом, чтобы электронное облако для него соответствовало ближайшему инертному газу.
1S22S22P63S1 (![]() ) 1S22S22P63S23P5 (
) 1S22S22P63S23P5 (![]() )
)
1S22S22P6 (![]() ) 1S22S22P63S23P6 (
) 1S22S22P63S23P6 (![]() )
)
Ионная связь наиболее характерна для неорганических соединений.
II. Ковалентная связь
Тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета:
1. метод валентных связей (МВС)
2. метод молекулярных орбиталей (ММО)
Согласно методу валентных
связей ковалентная связь образуется не путем передачи, а путем обобществления
неспаренных электронов с антипараллельными спинами по 1-му от каждого атома. Образовавшаяся
в этом случае электронная пара принадлежит обоим атомам. ![]()
![]() −
−![]() – обозначение ковалентной связи.
– обозначение ковалентной связи.
Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве.
Ковалентная связь в отличие от ионной имеет направленность.
Атомные орбитали могут перекрываться двумя способами:
1-ый способ: перекрывание в направлении главных осей (осей, связывающих ядра).
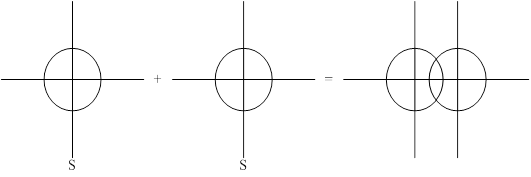
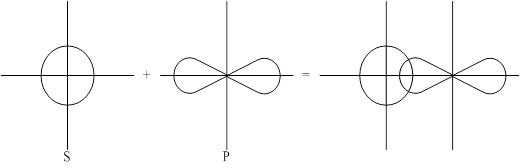
Образовавшаяся при этом перекрывании ковалентная связь называется s-сигма связь.
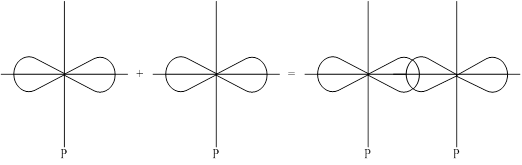
2-ой способ: P-орбитали с параллельными осями.
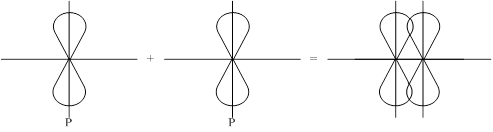
Боковое перекрывание образует p-связь, менее прочную связь чем s- сигма. В соответствии с правилом Паули между двумя атомами может быть либо 1s-сигма связь, либо 1s-сигма и 1p-связь, либо 1s-сигма и 2p-связи.
![]() Связи:
Связи:
![]() одинарная 1s −
одинарная 1s −
![]() двойная 1s+1p =
двойная 1s+1p =
![]() тройная 1s+2p ≡
тройная 1s+2p ≡
При увеличении кратности, длина уменьшается:
одинарная
1,54 ![]()
двойная
1,34 ![]()
тройная
1,2 ![]()
Так как нахождение 2-х электронов в поле действия 2-х ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании ковалентной связи принимает участие все одноэлектронные орбитали внешнего энергетического уровня. Например, атом азота имеет три неспаренных электрона на внешнем уровне и может образовывать за счет таких электронов 3 ковалентных связи:
N 2P
![]()
![]()
![]()
![]()
![]() 2S ↑ ↑ ↑
2S ↑ ↑ ↑
![]()
![]() ↓↑
↓↑
![]()
Число
неспаренных электронов может увеличиваться при переходе атома в возбужденное состояние
за счет “расспаривания”: у ![]() в этом случае атом способен
образовывать 4 связи. “Расспаривание” электрона требует затраты энергии,
которая компенсируется при образовании связей.
в этом случае атом способен
образовывать 4 связи. “Расспаривание” электрона требует затраты энергии,
которая компенсируется при образовании связей.
При участии в образовании
s-связей орбиталей разных типов,
например, в молекуле ![]() следовало бы ожидать
формирование связей, отличающихся друг от друга по длине и прочности. Однако
все связи
следовало бы ожидать
формирование связей, отличающихся друг от друга по длине и прочности. Однако
все связи ![]() −
−![]() равноценны и
располагаются симметрично друг другу. В рамках МВС эти факты объясняются на
основе концепции гибридизации атомных валентных орбиталей. Согласно ей в
валентных состояниях электроны распределяются не на чистых S и P орбиталях, а на смешанных (гибридных). Число гибридных равно
числу атомных орбиталей. Гибридные орбитали одинаковы по форме и энергии. В отличии
от атомных орбиталей гибридные более вытянуты в направлении образования химической
связи.
равноценны и
располагаются симметрично друг другу. В рамках МВС эти факты объясняются на
основе концепции гибридизации атомных валентных орбиталей. Согласно ей в
валентных состояниях электроны распределяются не на чистых S и P орбиталях, а на смешанных (гибридных). Число гибридных равно
числу атомных орбиталей. Гибридные орбитали одинаковы по форме и энергии. В отличии
от атомных орбиталей гибридные более вытянуты в направлении образования химической
связи.
Типы гибридизаций:
SP3 – гибридизация – при взаимодействии 1S и 3P орбиталей,
SP2 – гибридизация – при взаимодействии 1S и 2P орбиталей,
SP – гибридизация – при взаимодействии 1S и 1P орбиталей
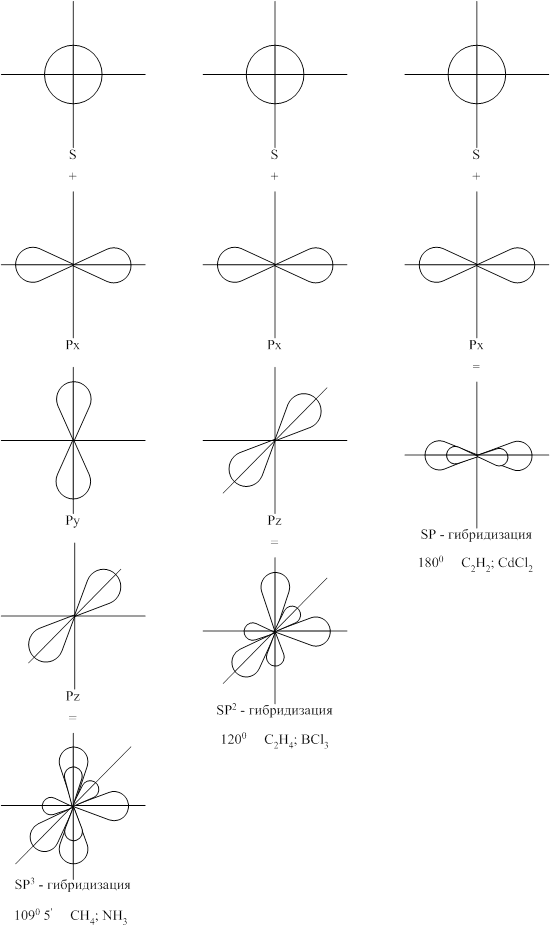
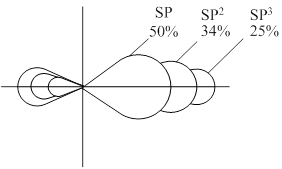
Доля s-орбитали составляет:
SP- гибридизации – 50%,
SP2- гибридизации – 34%,
SP3- гибридизации – 25%.
МВС не всегда объясняет ряд свойств веществ: спектральные, магнитные.
Метод молекулярных орбиталей предполагает, что при образовании ковалентной связи атомные орбитали образуют молекулярные орбитали. С позиции ММО каждый электрон принадлежит всей молекуле и движется в поле всех её ядер и электронов, т. е. находится на орбитали, охватывающей всю молекулу. Такая орбиталь называется молекулярной. Молекулярная орбиталь (МО) представляет собой линейную комбинацию атомных орбиталей: yAB=yA+yB. При сложении волновых функций атомных орбиталей образуется связывающая молекулярная орбиталь. При вычитании образуется разрыхляющая молекулярная орбиталь. При переходе атомных орбиталей в связующую молекулярную орбиталь происходит уменьшение энергии, а при разрыхляющих – энергия увеличивается. Связывающая молекулярная орбиталь характеризуется повышением электронной плотности между двумя ядрами.
Образование связывающей и разрыхляющей МО из исходной АО:
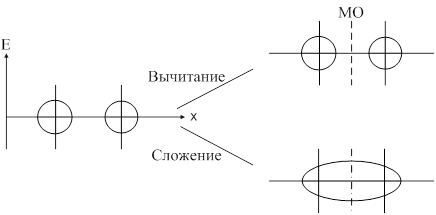
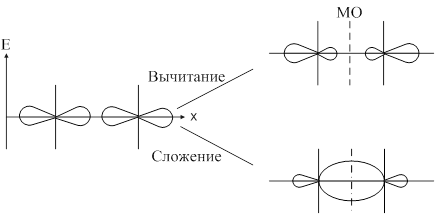
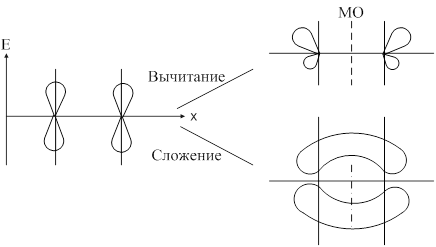
Согласно ММО образование химического соединения возможно только тогда, когда число электронов на связывающей МО больше числа электронов на разрыхляющих.
Полуразность числа электронов на связывающих и разрыхляющих орбиталях называется порядком связи.
![]()
![]()
![]() - порядок связи (валентность)
- порядок связи (валентность)
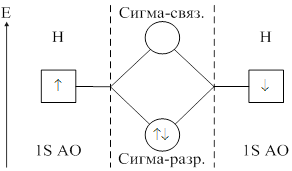
Ковалентная связь характеризуется длиной, энергией, полярностью, поляризуемостью и имеет определённую направленность в пространстве.
С увеличением кратности связи, длина связи уменьшается:
![]() −
−![]() 0,154 нм
0,154 нм
![]() =
=![]() 0,134 нм
0,134 нм
![]() ≡
≡![]() 0,12 нм
0,12 нм
Энергия связи – энергия, которую надо затратить, чтобы разорвать химическую связь. Тоже количество энергии выделяется при образовании химической связи. С увеличением кратности связи, энергия увеличивается. Энергия p-связи меньше энергии s-связи.
Ковалентная связь может быть:
1.
полярной (если
атомы различаются по электроотрицательности, то электронная пара будет
смещаться к атому с большей электроотрицательностью) ![]()
2.
неполярной (между
атомами 1-го типа, с одинаковой электроотрицательностью) ![]() −
−![]()
Мерой полярности служит дипольный
момент:![]() , где
, где
![]() −заряд электрона,
−заряд электрона,
![]() −расстояние между центрами
заряда.
−расстояние между центрами
заряда.
С увеличением электроотрицательности одного из атомов полярность молекулы увеличивается.
Процесс смещения электронной пары к наиболее электроотрицательному атому называется поляризацией.
Поляризуемость динамическая поляризация, способность молекулы изменять свою полярность под действием внешнего электрического поля. Поляризуемость уменьшается с уменьшением размера атома:
![]() −
−![]() >
>![]() −
−![]() >
>![]() −
−![]() >
>![]() −
−![]()
III. Координационная связь – (донорно-акцепторная) может рассматриваться, как результат наложения ионных и ковалентных связей
Координационная связь,
как и ковалентная связь обладает определенной жесткостью, однако атомы,
образующие эту связь несут на себе ![]() как в ионной связи. При образовании
координационной связи атомы приобретают заряды. Образование координационной
связи происходит в результате обобщения пары электронов, принадлежащих только одному
атому – донору, в то время как второй является акцептором, имеющим свободную
орбиталь.
как в ионной связи. При образовании
координационной связи атомы приобретают заряды. Образование координационной
связи происходит в результате обобщения пары электронов, принадлежащих только одному
атому – донору, в то время как второй является акцептором, имеющим свободную
орбиталь.
Классический пример образования иона аммония:
![]()
2P
![]()
![]()
![]()
![]()
![]() 2S ↑ ↑ ↑
2S ↑ ↑ ↑
![]()
![]() ↓↑
↓↑
![]()
2S22Px12Py12Pz1
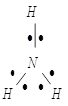
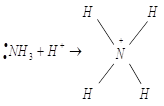
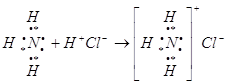
![]()
Разновидностью донорно-акцепторной связи является семиполярная связь. Она образуется, как и донорно-акцепторная, но донор заряжён положительно «+», а акцептор отрицательно «−».
![]()
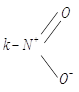
IV. Металлическая связь
При обычных условиях металлы, за исключением ртути Hg, существуют в виде кристаллов. Взаимодействие, удерживающее атомы металлов в едином кристалле, называется металлической связью.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металлов количество таких электронов меньше количества вакантных орбиталей. Электроны слабо удерживаются ядром. Поэтому они могут переходить из одной орбитали в другую. Стремясь принять более устойчивое состояние, а это структура инертного газа, атомы металлов довольно легко отдают валентные электронные электроны, превращаясь в положительно заряжённые ионы. Внутри этой решётки находятся валентные электроны, которые не принадлежат конкретно какому-то атому. Благодаря малым размерам электроны более или менее свободно перемещаются по всему объёму кристаллической решётки, поэтому возникает большое число многоцентрированных орбиталей. Электроны на этих орбиталях обобщены сразу несколькими атомами.
Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью.
По прочности
металлическая связь меньше ковалентной связи в 3-4 раза. Металлическая связь не
имеет определённой направленности в пространстве. Электроны сталкиваясь с
ионами образуют нейтральные частицы, которые сразу теряют электроны: ![]() . Электронные
газы отражают световые лучи.
. Электронные
газы отражают световые лучи.
В результате движения внутри решётки электроны способны переносить тепловую энергию от нагретых участков к ненагретым, этим объясняется теплопроводность.
Если приложить нагрузку к металлу, происходит деформация без разрушения решётки, металлам характерна ковкость, пластичность.
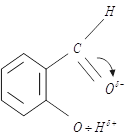
V. Водородная связь – одна из разновидностей межмолекулярного взаимодействия
Когда очень
электроотрицательный атом (![]() ,
, ![]() ,
, ![]() ) связан с атомом
) связан с атомом ![]() , последний в результате
смещения электронной пары ковалентной связи к наиболее электроотрицательному
атому становится настолько электроно-дефицитным, что начинает проявлять остаточное
сродство к электрону и поэтому он способен образовывать донорную связь:
, последний в результате
смещения электронной пары ковалентной связи к наиболее электроотрицательному
атому становится настолько электроно-дефицитным, что начинает проявлять остаточное
сродство к электрону и поэтому он способен образовывать донорную связь:
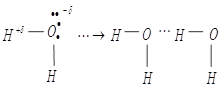
Различают водородную связь: межмолекулярную и внутримолекулярную.
Энергия водородной связи на 1, 2 порядка меньше энергии ковалентной связи.
VI. Межмолекулярное взаимодействие
Взаимодействие между молекулами без образования химической связи – это электростатическое взаимодействие (силы Ван-дер-Ваальса). Они обуславливают притяжение молекул и агрегацию вещества, превращение газов в жидкое состояние и далее в твёрдое.
Различают 3 типа электростатического воздействия:
1. ориентационное (диполь-дипольное) осуществляется в результате взаимодействия ориентированных полюсов полярных молекул при сближении
2. индукционное электростатическое взаимодействие полярных и неполярных молекул (Допустим, встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной группы)
3.
дисперсионное
возникает в результате взаимного притяжения так называемых мгновенных диполей в
неполярных молекулах вследствие несовпадения центров тяжести электронного
облака и ядер: ![]() .
.
Ван-дер-Ваальсово
взаимодействие очень слабо по сравнению с ковалентной связью (если энергия
диссоциации ![]() на
атомы = 243 кДж/моль, то энергия сублимации (возгонки) кристаллов
на
атомы = 243 кДж/моль, то энергия сублимации (возгонки) кристаллов ![]() = 25 кДж/моль).
= 25 кДж/моль).
Вопросы для самоконтроля
1. Основные параметры связи.
2. Типы связи.
3. Примеры соединений с различным типом связи.
4. Межмолекулярное взаимодействие.
© 2009 База Рефератов